AMENORREA HIPOTÁLAMO HIPOFISARIA
Anuncio

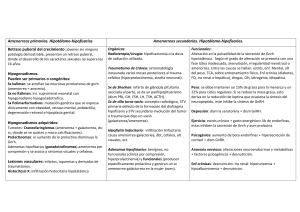
AMENORREA HIPOTÁLAMO HIPOFISARIA ROCÍO LÓPEZ‐JURADO JOSÉ ANTONIO LÓPEZ MEDINA TERESA GONZÁLEZ LUCENA Las alteraciones del ciclo menstrual son uno de los principales motivos de con‐ sulta en ginecología. La presencia regular de menstruaciones puede considerarse un signo de salud, porque la amenorrea es motivo de preocupación por asociarse fre‐ cuentemente con pérdida de feminidad o fertilidad. La amenorrea es un síntoma rápidamente percibido por la mujer y habitual‐ mente le plantea la necesidad de acudir a una consulta médica. La evaluación diagnóstica debe realizarse ante una niña con ausencia de menstruación a los 15 años y retraso del crecimiento puberal o de desarrollo de ca‐ racteres sexuales secundarios, o bien cuando, independientemente del crecimiento y del desarrollo de los caracteres sexuales secundarios no se ha producido la mens‐ truación a los 16 años. Así mismo, en los casos en que una vez establecidos los ciclos menstruales, desaparecen al menos tres de ellos. La amenorrea es un síntoma, no una enfermedad, de ahí la dificultad en en‐ contrar su origen que puede afectar a distintos órganos y sistemas. Hay que recordar que para que se produzca la menstruación hace falta: − La integridad anatómica y funcional del hipotálamo y la hipófisis con sus múltiples conexiones con el sistema nervioso central. − Ambiente endocrino‐metabólico adecuado. − Aparato genital bien desarrollado. Por todo ello, a la hora de evaluar una amenorrea, debemos hacer una valora‐ ción completa, integrando el estudio del aparato genital con el análisis de una posible causa central de la misma. La amenorrea hipotálamo‐hipofisaria, también denominada amenorrea de causa central (AC) puede ser el primer síntoma de patologías muy graves que escapan de nuestro área de conocimiento. Por ello, el objetivo por parte del ginecólogo es orientar el diagnóstico de forma adecuada, haciendo partícipes también a otros es‐ pecialistas (endocrinología, neurología … ) a la hora de pedir las pruebas complemen‐ [1] Actualización Obstetricia y Ginecología 2011 tarias más oportunas que confirmen la patología de la que se trata y buscar de forma multidisciplinar el tratamiento individual más adecuado. REGULACIÓN NEUROENDOCRINA DEL EJE REPRODUCTOR La función reproductora en la mujer sigue una pauta cíclica entre la menarquía y la menopausia que se denomina ciclo menstrual. Este ciclo requiere de la acción coordinada del hipotálamo, la hipófisis y las gónadas. Además, a la luz de los conoci‐ mientos neurofisiológicos actuales, se demuestra que para una correcta función de este eje, son precisos múltiples factores hormonales, genéticos, de transcripción y de comunicación intercelular que modulan el desarrollo sexual, la pubertad, la fertilidad y la menopausia. No pretendemos en este capítulo revisar toda la fisiopatología de la ameno‐ rrea central, pero sí es conveniente una aproximación a los factores más importantes que pueden verse afectados. La GnRH es una hormona peptídica producida en el hi‐ potálamo y que a través del sistema portal induce la síntesis y liberación de hormona folículo estimulante (FSH) y hormona luteinizante (LH) a nivel de la adenohipófisis; esta acción está regulada por factores ováricos y extragonadales. Se han identificado dos formas de GnRH: GnRH I y GnRH II codificadas por genes distintos. Ambas formas se localizan en distintos órganos y ejercen acciones endocrinas a nivel hipofisario y extrahipofisario. La GnRH I se encuentra en mayor concentración a nivel central, pero presenta receptores y capacidad de producción propia en las trompas de Falopio, en las células de la granulosa, en el endometrio o en embriones y tejido placentario. La liberación pulsátil de GnRH es fundamental en la secreción fisiológica de las gonadotropinas hipofisarias: FSH y LH. Un estímulo continuo induce una primera respuesta estimuladora (flare up), seguida de una inhibición de la secreción, lo que se denomina “desensibilización” hipofisaria o down regulation. Estas respuestas hipofi‐ sarias constituyen la base en la utilización terapéutica de los análogos de la GnRH. Las gonadotropinas hipofisarias son las hormonas que estimulan los procesos fisiológicos de desarrollo, maduración folicular e inducción de la ovulación. La FSH de manera cíclica rescata una cohorte de folículos del proceso de atresia, uno de los cua‐ les adquiere dominancia y continúa su crecimiento hasta que se produce la ovulación bajo el estímulo de la LH. La síntesis y liberación de la LH y FSH está mediada a su vez por esteroides y hormonas ováricas como el estradiol o la inhibina folicular1. Además de su efecto en la función reproductora, se ha constatado como los esteroides sexuales actúan en un gran número de tejidos, no sólo en el sexo femeni‐ no, sino también en el masculino, entre ellos el cartílago de crecimiento, el hueso y el SNC2. [2] Ginecología Las inhibinas, activinas, foliculoestatinas y otros péptidos de origen ovárico que se secretan al líquido folicular y a la circulación sanguínea regulan la síntesis de FSH/LH disminuyendo los receptores para la GnRH (inhibina) o aumentando éstos (activina). La foliculoestatina es un péptido glucosilado diferente de ambas y desem‐ peña un papel regulador de activinas e inhibinas. Otras hormonas y mecanismos de neurotransmisión están implicados en el eje gonadal. La prolactina regula la función lactopoyética y su elevación puede provocar amenorrea al inhibir directamente en el ovario la síntesis de estradiol y de progeste‐ rona, y bloquear la maduración del folículo ovárico3. Las β‐endorfinas varían a lo largo de las fases del ciclo reproductor, tienen una gran acción inhibidora sobre las neuro‐ nas productoras de GnRH. La melatonina se ha relacionado con el rescate de la apop‐ tosis del folículo dominante, así como de la maduración del ovocito. Factores nutri‐ cionales y metabólicos influyen notablemente en el desarrollo puberal y la fertilidad, de hecho, hormonas como la leptina y la grelina tienen acciones directas sobre el eje hipotálamo‐hipofisario en la liberación de GnRH y sobre las gónadas. CLASIFICACION El primer problema que nos encontramos a la hora de orientar el diagnóstico de AC es la diversidad de clasificaciones que se han realizado. La Organización Mundial de la Salud (OMS) en 1974 estableció una clasifica‐ ción en la cual diferencia el fallo hipotálamo‐hipofisario, o amenorreas tipo I, de la disfunción hipotálamo‐hipofisaria o amenorreas tipo II, y dedica un nuevo grupo de amenorreas tipo VII para tumores hipotálamo‐hipofisarios no hiperprolactinémicos. Los grupos V y VI se corresponden con el prolactinoma y la hiperprolactinemia fun‐ cional, respectivamente, cuando todos estos grupos podrían estar incluidos en el compartimento central y con una numeración más lógica que permita ser recordada con mayor facilidad. El sistema compartimental de Speroff, simplifica la clasificación dividiendo las amenorrea en cuatro grupos, pero invierte la numeración considerando comparti‐ mento I a los trastornos del canal genital o útero, II a los del ovario , III a los de la hipófisis y IV a los del sistema nervioso central (hipotálamo). La Sociedad Española de Ginecología (SEGO) propone en su protocolo hasta cuatro tipos de clasificaciones: clínica, topográfica, endocrina y la de la OMS, si bien, no aconseja el uso prioritario de ninguna de ellas. La Sociedad Americana de Medicina Reproductiva (ASRM), a la vez que tiene en cuenta la clasificación clásica de la OMS reestructura algunos de sus grupos con‐ [3] Actualización Obstetricia y Ginecología 2011 cediendo especial importancia al aspecto clínico y establece cuatro tipos de ameno‐ rrea de acuerdo con los niveles séricos de estradiol, FSH y prolactina. Recientemente el Grupo de Interés de Endocrinología Reproductiva (GIER) de la Sociedad Española de Fertilidad (SEF) ha planteado la necesidad de establecer una nueva clasificación de las amenorreas, más sencilla, útil y práctica a la hora de abor‐ dar su estudio, que enlace con esquemas diagnósticos de iguales características, lo cual permite en el menor tiempo posible localizar la patología y realizar un tratamien‐ to4. Se trata de una propuesta que establece en primer lugar, una diferencia entre amenorrea primaria y secundaria, para después ubicar su etiología principal en un compartimento central (hipotálamo‐hipofisario), gonadal (ovárico), o genital (útero‐ vaginal). Las amenorreas centrales con niveles bajos de estradiol, y normales o bajos de gonadotrofinas, se han subdividido en hipotalámica, hipofisaria y secundarias a hiperprolactinemias, distinguiendo en los dos primeros casos entre causas orgánicas y funcionales por sus distintas implicaciones diagnósticas y terapéuticas. El grupo de la hiperprolactinemia, aunque conceptualmente puede tratarse de una entidad hipotalámica o hipofisaria, por su importancia clínica y la característica elevación de los niveles de prolactina se ha considerado de forma independiente. Dentro de las amenorreas gonadales, podemos considerar una patología prin‐ cipalmente orgánica con disminución de la reserva folicular y fallo ovárico, en la que se produce un descenso de los niveles de estradiol junto con un incremento de los valores de gonadotrofinas; y una patología funcional con reserva folicular normal y valores normales de estradiol y bajos o normales de gonadotrofinas como el Síndro‐ me de Ovario Poliquístico (SOP). Por último, en las amenorreas genitales, podría establecerse una diferencia‐ ción dependiendo de si la alteración se encuentra a nivel uterino o a nivel vaginal. AMENORREAS HIPOTALAMICAS O RGÁNICAS 1.‐ Déficit congénitos relacionados con la GnRH − Síndrome de Kallman − Alteraciones de la síntesis de GnRH o en la activación del receptor 2.‐ Lesiones malformativas del área hipotalámica [4] Ginecología − Síndrome de Prader Willi − Síndrome de Lawrence‐Moon‐Bield 3.‐ Lesiones destructivas del área hipotalámica secundarias a una lesión − − − − − Tumores del SNC Enfermedades destructivas Procesos infecciosos Lesiones directas al hipotálamo Radiaciones F UNCIONAL 1. 2. 3. 4. Amenorrea hipotalámica asociada a la pérdida de peso Amenorrea hipotalámica por ejercicio físico Amenorreas psicógenas o de estrés Idiopática AMENORREAS HIPOFISARIAS O RGÁNICAS 1.‐ Defectos celulares y anatómicos − Síndrome de silla turca vacía. − Lesiones tumorales de la hipófisis − Tumores secretores − Hipofisitis linfocítica 2. Defectos vasculares − Síndrome de Sheehan − Apoplejía hipofisaria F UNCIONALES Hiperprolactinemia DIAGNÓSTICO Para llegar al diagnóstico de AC es imprescindible realizar una valoración global de la amenorrea. La diferenciación entre amenorrea primaria y secundaria es funda‐ mental para orientar adecuadamente la anamnesis y exploración clínica de la pacien‐ te que siempre debe incluir la valoración del estado nutricional, el examen de carac‐ [5] Actualización Obstetricia y Ginecología 2011 teres sexuales secundarios, y la exploración de los genitales externos e internos, sin olvidar otros signos y síntomas como la galactorrea, la androgenización o la clínica sugestiva de patología tiroidea. Dentro de las pruebas complementarias básicas se encuentran la analítica ge‐ neral y la analítica hormonal. Aunque la ASRM sólo considera necesarias las determinaciones de FSH, prolac‐ tina y test de gestación basándose en que con las mismas, se pueden descartar prácticamente todas las causas de amenorrea5, si se añade la determinación de LH, estradiol y TSH al examen basal, no se incrementa mucho el coste aportando una in‐ formación adicional que acelera la orientación diagnóstica. La AC se caracteriza por niveles normales o bajos de FSH y/o LH. Los niveles de estradiol suelen estar bajos en la gran mayoría de los casos, lo que hace que no se produzca deprivación tras el test de gestágenos, y es necesario un test de estropro‐ gestágenos para conseguir la menstruación. La ecografía genital se considera básica. Permite confirmar la presencia o au‐ sencia de genitales internos, en caso de amenorrea primaria, así como valorar el gra‐ do de hipoestrogenismo a través de la línea endometrial y la reserva folicular me‐ diante contaje de folículos antrales. Uno de los principales problemas del hipogonadismo hipogonadotropo cuando se presenta en la pubertad es su diagnóstico diferencial con la pubertad retrasada constitucional. Antecedentes familiares de talla baja en relación con talla genética, falta de adrenarquia, estudio de edad ósea correspondiente a menos de 11 años en ausencia de otras alteraciones como olfato normal orientan al retraso constitucional6. Otras pruebas de diagnóstico específicas como la Resonancia Magnética Nu‐ clear, estudios genéticos, y campimetría entre otras, serán necesarias sólo en deter‐ minados casos, para confirmar o descartar determinadas sospechas diagnósticas. TRATAMIENTO T RATAMIENTO DE LA AMENORREA EN MUJERES SIN DESEO GESTACIONAL El fundamento del tratamiento en mujeres sin deseo gestacional es la terapia hormonal (TH) para evitar las causas del hipoestrogenismo, particularmente la pre‐ vención de la osteoporosis, así como el deterioro de otros órganos y tejidos; sin olvi‐ dar nunca el tratamiento específico según la causa etiológica. [6] Ginecología TRATAMIENTO HORMONAL El objetivo fundamental es la reposición del déficit de estradiol, sin embargo, en mujeres con útero intacto es necesario el uso de preparados gestagénicos para evitar la acción proliferativa mantenida de los estrógenos sobre el endometrio. Se pueden emplear pautas cíclicas de estrógenos asociando algún progestáge‐ no durante 12‐14 días al mes o bien pueden utilizarse anticonceptivos hormonales que proporcionan una pauta continua de estrógenos y gestágenos. La vía de adminis‐ tración puede ser oral, transdérmica o vaginal ya que no se ha demostrado mayor eficacia o seguridad con ninguna de ellas. Se recomienda realizar mediciones periódicas de densidad mineral ósea me‐ diante densitometria ósea con absorciometría radiológica de doble energía (DEXA) con el fin de determinar la idoneidad de tratamiento hormonal elegido. En pacientes con osteopenia que tienen contraindicaciones para el tratamien‐ to hormonal o han presentado efectos secundarios adversos graves se han propuesto terapias alternativas como el uso de bifosfonatos7. De todas formas, aunque los anti‐ conceptivos hormonales se han recomendado para mejorar la masa ósea en pacien‐ tes con AC, hay que tener presente que ningún estudio ha demostrado incremento en la masa ósea en estas pacientes8,9. En cualquier caso se debe suplementar el tratamiento con calcio y vitamina D para completar las necesidades mínimas que no se ingieran con la dieta, lo que equi‐ vale a completar con 1.000‐1.500 mgr de calcio y 800 unidades de vitamina D al día10. TRATAMIENTO CAUSAL Cuando la alteración de la función menstrual es secundaria al ejercicio físico intenso y continuado, al stress o a los trastornos de la conducta alimentaria, no es suficiente proporcionar TH,. se hace necesario también el apoyo y asesoramiento de un equipo multidisciplinar que ofrezca atención especializada a estas pacientes. TRATAMIENTO DE LA AC PROVOCADA POR EL EJERCICIO FISICO Aunque el ejercicio físico favorece la mineralización ósea, cuando éste se reali‐ za de forma intensa, como en casos de atletas o bailarinas profesionales, no compen‐ sa los efectos del hipoestrogenismo sobre los huesos sobre todo en las adolescen‐ tes11. Por eso en pacientes que han iniciado su práctica deportiva a corta edad, se hace necesaria la necesidad de extremar las medidas encaminadas a la ganancia ósea. Clásicamente se atribuye la amenorrea y la ospeopenia de estas pacientes a la pérdida de peso, pero hay más factores implicados. El descanso periódico y la reduc‐ [7] Actualización Obstetricia y Ginecología 2011 ción de la intensidad del ejercicio físico al inicio del ciclo, sin modificación del peso, permite una mejor secreción de gonadotropinas. Además se recomienda la TH, utilizándose habitualmente los antinceptivos hormonales de baja dosis, que corrigen la carencia estrogénica además de conferir una protección al embarazo no deseado. En deportistas de élite que deseen evitar la menstruación, se pueden emplear de modo continuo. TRATAMIENTO DE LA AC PROVOCADA POR TRASTORNOS DE LA CONDUCTA ALIMENTARIA El primer objetivo del tratamiento es restaurar el peso corporal normal y los hábitos alimentarios y debe ser abordado por un equipo multidisciplinar que incluye enfermeras, médicos, un nutricionista o dietista y profesionales en salud mental. El mayor desafío en el tratamiento de la anorexia nerviosa es el reconocimien‐ to de la enfermedad por la paciente. La mayoría de las personas que sufren este tipo de anorexia niega tener un trastorno alimentario. Cuando el trastorno afecta a una adolescente, el tratamiento se fundamenta en la terapia familiar. Los métodos más nuevos miran a la familia como una parte de la solución, más que la causa del trastorno alimentario12. Hay que tener en cuenta que las recaídas son frecuentes y probablemente se ensayarán muchas terapias hasta que el paciente logre vencer este trastorno. En muchas ocasiones medicamentos, como antidepresivos, antipsicóticos y es‐ tabilizadores del estado de ánimo, pueden ayudar a algunos pacientes anoréxicos cuando se administran como parte de un programa de tratamiento completo13. Debido a la distorsión importante del esquema corporal que sufren estas pa‐ cientes, se recomiendan pautas de TH que consigan el sangrado cíclico para reforzar la identidad femenina. Se recomienda la vía vaginal o transdérmica que no se ve afec‐ tada por los vómitos. La necesidad de mantener la TH dependerá de si se ha corregido el trastorno alimentario con una adecuada ganancia ponderal, pero cada caso debe individualizar‐ se. TRATAMIENTO EN MUJERES CON DESEO GESTACIONAL Hay que tener siempre presente que el tratamiento etiológico es fundamental, y que muchas de las mujeres que consiguen recuperar la menstruación también solu‐ cionan su problema de fertilidad. [8] Ginecología En la práctica clínica habitual, las pacientes demandan, incluso en su etapa adolescente, tratamientos que restauren su menstruación consiguiendo la ovulación en cada ciclo ovárico y a largo plazo. Aunque hoy día disponemos de distintos prepa‐ rados hormonales con actividad GnRH, FSH y LH, su acción se limita en el tiempo y va orientada al desarrollo folicular en un ciclo concreto. Entre las pacientes con AC nos encontramos con diferentes etiologías, con una gran variedad de situaciones clínicas y distintos grados de déficit hormonal. Se debe de realizar una correcta valoración hormonal de las pacientes para individualizar el tratamiento. Las dosis de gonadotropinas requeridas serán mayores cuando existe un déficit total de GnRH, como el Síndrome de Kallman, que en los casos de déficit tem‐ porales, como la amenorrea por estrés o inducida por ejercicio físico. Pero también hay que tener en cuenta la posible coexistencia de hipogonadismo hipogonadotropo y el SOP en la misma paciente, cuya respuesta al tratamiento de estimulación ovárica acaba siendo similar al de las pacientes con SOP14. Para valorar correctamente las necesidades de folitropinas podríamos tener en cuenta tanto los niveles de folitropinas basales como la ecografía ovárica en la que se ha descrito un recuento de folículos antrales igual al de las mujeres normoovulado‐ ras15. PAUTAS DE INDUCCIÓN DE LA OVULACIÓN Las pacientes con AC son las candidatas más evidentes al tratamiento con go‐ nadotropinas exógenas para inducción de la ovulación. El clomifeno y otros fármacos relacionados son poco eficaces, porque su mecanismo de acción necesita de un eje hipotálamo‐hipofisario intacto, tan sólo han dado resultados en casos seleccionados después de impregnación estrogénica16. INDUCCIÓN DE LA OVULACIÓN CON FSH Y LH La inducción de la ovulación en pacientes con amenorrea central precisa de la administración tanto de FSH como de LH, lo que no sólo nos permite el crecimiento folicular y la maduración del ovocito sin también una adecuada esteroidogénesis, lu‐ teinización y ovulación normales. A la hora de elegir la folitropina, como ocurre con otras indicaciones fuera de la AC, no se han descrito diferencias en cuanto a la eficacia entre las folitropinas uri‐ narias y las recombinantes17. En líneas generales, las pacientes con AC en las que buscamos conseguir un desarrollo monofolicular no precisan de dosis muy elevadas de gonadotropinas sien‐ do el protocolo estándar comenzar con una dosis de 75/150 UI de HMG o bien 75/150 de FSHr +75 UI de LHr. El primer control se realiza a los 7 días de tratamiento [9] Actualización Obstetricia y Ginecología 2011 y se pueden ir incrementando 75 UI de HMG o FSHr por semana hasta un máximo de 225U. Cuando en algún control ecográfico se observe un folículo de 18 mm de diáme‐ tro, la maduración folicular final se puede realizar con HCGr (250µg) vía subcutánea. La ovulación se produce en las siguientes 24‐36 horas. Se recomienda el apoyo de la fase lútea con suplementos de HCG (150‐2500 UI) cada 3‐4 días o bien con progeste‐ rona natural micronizada (600 mg/dia) para compensar los niveles bajos de LH endó‐ gena. Las tasas de embarazo acumuladas no difieren de las pacientes con anovula‐ ción de otro origen, aunque en determinados subgrupos se han descrito mayor inci‐ dencia de complicaciones y abortos18. INDUCCIÓN DE LA OVULACIÓN CON BOMBA DE INFUSIÓN DE GNRH Se ha descrito como una opción válida cuando la función hipofisaria está con‐ servada. La GnRH puede administrarse de una forma pulsátil continua mediante una minibomba programable pulsátil que se lleva las 24 horas del día. Las pacientes con AC suelen responder a dosis entre 5‐20 µg/ pulso lo que permite conseguir la ovulación a la vez que mantener niveles de LH y conseguir nive‐ les de progesterona normales en fase lútea. Una vez que se produce la ovulación, se puede mantener el tratamiento con una frecuencia de pulsos más lenta, pero resulta más sencillo interrumpir la bomba y realizar un refuerzo con HCG o progesterona. Análisis retrospectivos han descrito tasas de ovulación superiores con este tra‐ tamiento que con el tratamiento de gonadotropinas (97% vs 93%), con la ventaja adi‐ cional de requerir menos controles ecográficos, incluso ninguno, cuando ya se ha es‐ tablecido la pauta terapéutica eficaz19. Lamentablemente se trata de un tratamiento costoso y pocos ginecólogos están familiarizados con este método. FECUNDACIÓN IN VITRO En muchas ocasiones, o bien por fracaso de otras técnicas de reproducción o bien porque la anovulación de la paciente no es la única causa de esterilidad de la pareja, nos vemos obligados a acudir a la fecundación in vitro. Habitualmente, se requieren dosis de gonadotropinas mayores a las pacientes con otras indicaciones. También se ha descrito la necesidad de mayor número de días de estimulación y menor número de ovocitos y niveles de estradiol. Cuando la res‐ puesta conseguida es la adecuada, se han referido tasas de gestación iguales a las alcanzadas por otros grupos 20. [10] Ginecología LECTURAS RECOMENDADAS Speroff L, Fritz M. Amenorrea. En: Endocrinología ginecológica clínica y esterilidad. Speroff L, Fritz M, editores. Lippincott Williams & Wilkins Philadelphia, EEUU; 2006: 401‐63. Bajo Arenas JM, Lailla Vicens JM, Xercavins Montosa J. Alteraciones por defecto. Amenorreas. En: Fundamentos de Ginecología. Sociedad Española de Ginecología y Obstetricia (SEGO) 2009:61‐9. Tur R, Herrero J, Graña M. Amenorrea Central. Editorial Médica Panamericana S.A. Madrid España 2010. BIBLIOGRAFIA 1. Tena‐Sempere M, Aguilar Benítez de Lugo E, Pinilla Jurado L. Fisiología del eje hipotálamo‐ hipófiso‐ovárico. En: Actualizaciones en Endocrinología: Gonadas. Diéguez C, Yturriaga R (ed). Madr‐ id, McGraw‐Hill.‐ Interamericana de España 2001; 21‐42. 2. Audí Parera L, Granada Ybern ML. Gónadas: regulación de la biosíntesis esteroidea y de la gametogénesis. Métodos de exploración. En Tratado de endocrinología pediátrica. Pombo y otros (ed). Madrid, McGraw‐Hill.‐ Interamericana de España 2009; 481‐504. 3. Ma W, Ikeda H, Yoshimoto T. Clinicopathologic study of 123 cases of prolactin‐secreting pi‐ tuitary adenomas with special reference to multihormone production and clonality of the adenomas. Cancer 2002;95: 258‐266. 4. Fontes J, Valverde M, Hurtado F. Conceptos, clasificación y clínica. En: Amenorrea Central. Tur R, Herrero J, Graña M editores. Editorial Médica Panamericana S.A. Madrid España 2010: 19‐28. 5. The Practice Committee of the American Society for Reproductive Medicine. Current evalu‐ ation of amenorrea. Fertil Steril 2008; 90 (suppl 3): S219‐25. 6. Fernández‐Vazquez G, Melián E, González N, Sánchez F. Amenorrea primaria por hipogo‐ nadismo hipogonadotropo. Endocrinol Nutr 2005; 52(5): 209‐14. 7. Ward L, Tricco AC, Phuong P et al. Bisphosphonate therapy for children and adolescents with secondary osteoporosis. Cochrane Database Syst Rev 2007 Oct 17: (4): CD005324. 8. Strokosch GR, Friedman AJ, Wu SC, Kamin M. Effects of an oral contraceptive (norgesti‐ mate/ethinyl estradiol) on bone mineral density in adolescent females with anorexia nervosa: a double‐blind placebo‐controlled trial. J Adolesc Health 2006; 39:819‐27. 9. Gordon CM, Grace E, Emans SJ et al. Effects of oral dehydroepiandrosterone on bone densi‐ ty in young women with anorexia nervosa: a randomized trial. J Clin Endocrinol Metab 2002; 87:4935‐ 41. 10. Nichols DL, Sanborn CF, Essery EV. Bone density and Young Athletic women. An up‐ date.Sport Med 2007; 37:1001‐4. 11. Warren MP, Brook‐Gunn J, Fox RP et al. Osteopenia in exercise‐associated amenorrea us‐ ing ballet dancers as a model: a longitudinal study. J Clin Endocrinol Metab 2002; 87: 3162‐5. 12. Couturier J, Isserlin L, Lock J. Family‐based treatment for adolescents with anorexia nervo‐ sa: a dissemination study. Eat Disorder 2010; 18 (3): 199‐209. 13. Claudino AM, Hay P, Lima MS et al. Antidepressants for anorexia nerviosa. Cochrane Da‐ tabase Syst Rev. 2006 Jan25; 81): CD004365. 14. Wang JG, Lobo RA. The complex relationship between hypothalamic amenorrea and poly‐ cystic ovary síndrome. J Clin Endocrinol Metab 2008; 93: 1394‐7. 15.Jonard S, Pigny P, Jacquesson L et al. The ovaian markers of the FSH insufficiency in func‐ tional hypothalamic amenorrea. Human Reprod 2005; 20: 101‐7. 16.Borges LE, Morgante G, Musacchio MC et al. New protocol of clomiphene citrate treat‐ ment in women with hypothalamic amenorrea. Gynecol Endocrinol 2007; 23: 343‐6. [11] Actualización Obstetricia y Ginecología 2011 17. Dickey Rp, Nichosl JE, Steinkampf MP et al. Highly purified human‐derived follicle‐ stimulating hormone has equivalent efficacy to follitropin‐beta in infertil women undergoing in vitro fertilization. Reprod Biolog Endocrinol 2003; 1: 63‐7. 18. Hall R, Manski‐Nankervist J, Goni N et al. Fertility outcomes in women with hypopituitar‐ ism. Clin Endocrinol 2006; 65: 71‐4. 19. Martin KA, Hall JE, Adams JM, Crowley WF Jr. Comparison of exogenous gonadotropins and pulsatile gonadotropin‐releasing hormone for induction of ovulation in hypogonadotropic ame‐ norrea. J Clin Endorinol Metab 1993;77:125‐9. 20.Kumbak B, Kahraman S. Women with hypogonadotropic hypogonadism: cycle characte‐ ristics and results of assisted reproductive techniques. Act Obstet Gynecol 2006; 85: 1453‐57. [12]