BIO2-Temas_15-16_files/15-16 T
Anuncio

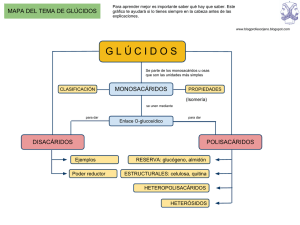
1.- INTRODUCCIÓN 2.- FUNCIONES GENERALES DE LOS GLÚCIDOS 3.- CLASIFICACIÓN DE LOS GLÚCIDOS 4.- MONOSACÁRIDOS 4.1.- INTRODUCCIÓN 4.2.- FÓRMULA LINEAL 4.3.- PROPIEDADES 4.4.- ISOMERÍA 4.5.- ACTIVIDAD ÓPTICA 4.6.- ESTRUCTURA CÍCLICA 4.7.- MONOSACÁRIDOS DE INTERÉS BIOLÓGICO 5.- OLIGOSACÁRIDOS 5.1.- INTRODUCCIÓN 5.2.- TIPOS DE ENLACE Y NOMENCLATURA 5.3.- PRINCIPALES DISACÁRIDOS 5.4.- OLIGOSACÁRIDOS 6.- POLISACÁRIDOS 6.1.- INTRODUCCIÓN 6.2.- HOMOPOLISACÁRIDOS 6.3.- RELACIÓN ENTRE ESTRUCTURA Y FUNCIÓN DE LOS POLISACÁRIDOS 6.4.- HETEROPOLISACÁRIDOS 7.- HETERÓSIDOS 1.- INTRODUCCIÓN Los glúcidos son compuestos orgánicos constituidos por carbono, hidrógeno y oxígeno. Se les ha llamado hidratos de carbono porque algunos responden a la fórmula general Cn(H2O)n y azúcares por su sabor dulce, aunque sólo los de baja masa molecular lo tienen. Concepto: Químicamente son polialcoholes con un grupo carbonilo o lo que es lo mismo polihidroxialdehídos, polihidroxicetonas, sus derivados o sus polímeros (más adelante se explicarán estos conceptos). Algunos son moléculas de relativamente baja masa molecular; la glucosa tiene una Mm=180da. Otros, como el almidón, tienen masas moleculares de más de 100000 da y son grandes moléculas, macromoléculas. Sus propiedades físicas y químicas son muy variadas como veremos a lo largo del tema. 2.- FUNCIONES GENERALES DE LOS GLÚCIDOS - Función energética: constituyen la fuente de energía de la mayoría de los seres vivos. La glucosa proporciona energía inmediata a la célula ( una molécula de glucosa al degradarse libera 266Kcal ). La sacarosa es la forma más común en la cual el azúcar se transporta en los vegetales, desde las células fotosintéticas hasta otras partes de la planta. Polisacáridos como el almidón ( vegetales ) y el glucógeno (animales) facilitan a los seres vivos el formar reservas de glucosa (formas de almacenamiento de glucosa, fácilmente movilizables). Esta energía está contenida en determinados enlaces que unen los átomos de estas moléculas. - Función estructural: Tiene especial importancia el tipo de enlace (enlace β), éste debe ser de tal naturaleza que impida la fácil degradación de estas moléculas. Así encontramos dos polisacáridos: la celulosa que forma parte de la pared celular de los vegetales y la quitina que constituye el exoesqueleto de los artrópodos. Ribosa y desoxirribosa forman parte de los ácidos nucleicos. - Almacenamiento de información: diversos oligosacáridos unidos a proteínas y lípidos de membrana ( glicoproteínas y glicolípidos) y que se sitúan en la cara externa de la misma, contribuyen a que los diferentes tipos de células se reconozcan entre sí. 1 3.- CLASIFICACIÓN DE LOS GLÚCIDOS Dependiendo de si son capaces de hidrolizarse o no es decir, de romperse en moléculas más sencillas , se clasifican en: ♦ Monosacáridos u osas: son los más sencillos. No son hidrolizables (no se pueden descomponer por hidrólisis en otros glúcidos más sencillos) Constituyen los monómeros a partir de los cuales se forman los demás glúcidos. ♦ Ósidos: Formados por la unión de varios monosacáridos mediante enlaces "O-glicosídicos", pudiendo poseer en su molécula otros compuestos diferentes de los glúcidos. Son hidrolizables, descomponiéndose en los monosacáridos y demás compuestos que los constituyen. Se dividen en: * Holósidos. Son aquellos que están constituidos solo por monosacáridos. A su vez se dividen en: -Oligosacáridos, formados por entre 2 y 10 monosacáridos unidos. Los disacáridos son los más importantes. -Polisacáridos, formados por un gran número de monosacáridos, más de 10. Estos se dividen a su vez en: + Homopolisacáidos: Al hidrolizarse dan un solo tipo de monosacáridos. + Heteropolisacáridos: Al hidrolizarse dan dos o más tipos de monosacáridos. * Heterósidos. Formados por osas y otros compuestos que no son glúcidos. 4.- MONOSACÁRIDOS 4.1.- INTRODUCCIÓN Concepto: Químicamente son polihidroxialdehídos, polihidroxicetonas o sus derivados. Se caracterizan por no ser hidrolizables. Un polihidroxialdehído es un compuesto orgánico que tiene una función aldehído en el primer carbono y en los restantes carbonos una función alcohol. Las polihidroxicetonas en lugar de una función aldehído tienen una función cetona, normalmente en el carbono 2. Los monosacáridos que tienen función aldehído se llaman aldosas y cetosas los que tienen una función cetona. Son sólidos, blancos y cristalinos. Tienen sabor dulce y son solubles en agua. Además, presentan isomería espacial. Los monosacáridos responden a la fórmula empírica Cn(H2O)n, de aquí proviene el nombre de hidratos de carbono. El valor de n normalmente está comprendido entre 3 y 7. Se nombran con la terminación –osa y Según el número de átomos de carbono se clasifican en : Triosas........n=3 Tetrosas.......n=4 Pentosas.......n=5 Hexosas........n=6 Heptosas.......n=7 2 Así, un monosacárido con 6 átomos de carbono y con la función aldehído será una aldohexosa; si tiene cuatro átomos de carbono y una función cetona, será una cetotetrosa, y así sucesivamente. Se enumeran empezando por el carbono terminal más próximo al grupo carbonilo. Si nos fijamos en las siguientes fórmulas vemos que en las aldosas el carbono 1 siempre es el del grupo carbonilo. Adohexosa Cetopentosa 4.2.- FÓRMULA LINEAL DE LOS MONOSACÁRIDOS Las fórmulas lineales de los monosacáridos se escriben con la cadena carbonada en vertical. El primer carbono será el que lleve el grupo aldehído o el más próximo al grupo cetona 3 4.3.- PROPIEDADES - - Físicas: son sólidos, cristalinos, blancos, de sabor dulce. Como los grupos hidroxilo son polares, los monosacáridos son muy solubles en agua, pues se establecen enlaces polares con las moléculas de agua y son insolubles en disolventes apolares. Presentan esteresoisomería o isomería espacial y actividad óptica. Químicas: El grupo carbonilo reduce fácilmente los compuestos de cobre (licor de Fehling) y de plata, oxidándose y pasando a grupo ácido. Esta propiedad es característica de estas sustancias y se utiliza para su reconocimiento químico, mediante la reacción de Fheling. El licor de Fheling contiene sales cúpricas que en presencia de una disolución de monosacáridos y en caliente, se reducen a sales cuprosas, esto hace virar el reactivo de azul a rojo ladrillo. 2NaOH SO4Cu Calor 2Cu(OH)2 + R-CHO Na 2SO4 + Cu(OH)2 R-COOH + Cu2O+2H2O 4 4.4.- ISOMERÍA Es una característica de muchos compuestos , que siendo diferentes presentan la misma fórmula molecular. Los monosacáridos presentan esta característica. Existen diferentes tipos de isomería: - - Isomería de función: la presentan aquellos compuestos que presentan la misma fórmula empírica pero, tienen diferentes grupos funcionales. Ej. glucosa (aldosa) y fructosa (cetosa), tienen como fórmula empírica: C6H 12 O 6 Estereoisomería: La presentan moléculas aparentemente iguales, pero con diferentes propiedades, porque sus átomos tienen diferente disposición espacial. Se debe a la presencia de carbonos asimétricos. Todos los monosacáridos excepto la dihidroxiacetona, presentan al menos un carbono asimétrico. ¿Qué es un carbono asimétrico? , es aquel que tiene las cuatro valencias saturadas con diferentes radicales. • • Enantiómeros: Se diferencian en la posición relativa de los grupos – OH de sus carbonos asimétricos (colocación a un lado u otro del esqueleto carbonado de la molécula). Por lo tanto son imágenes especulares, es decir una molécula es el reflejo de la otra en un espejo. Diastereoisómeros: son esteresoisómeros que no son imágenes especulares. Se denominan, epímeros, cuando sólo varía la posición del grupo –OH de un carbono asimétrico. Ej. Glucosa y galactosa. 5 Por convenio aquellos monosacáridos que presentan el grupo –OH del último carbono asimétrico a la derecha, son formas D y si lo presentan a la izquierda son formas L. El número de estereoisómeros de un monosacárido es igual a 2n (n= nº de carbonos asimétricos). En la naturaleza los más frecuentes son las formas D. Las enzimas son capaces de diferenciar los distintos estereoisómeros y por lo tanto de seleccionarlos, siendo esto de gran importancia biológica. 4.5.- ACTIVIDAD ÓPTICA Es la capacidad que poseen algunas moléculas en disolución de desviar el plano de la luz polarizada. Cada estereoisómero desvía ese plano con un valor de ángulo concreto. Si lo desvía hacia la derecha, se dice que el compuesto es dextrógiro o forma (+) y si lo desvía hacia la izquierda es levógiro o forma (-­‐). Los isómeros ópticos no se corresponden necesariamente con las formas L y D., por ejemplo la D-­‐fructosa es fuertemente levógira y viceversa. 4.6.- ESTRUCTURA CÍCLICA DE LOS MONOSACÁRIDOS Los monosacáridos de 5, 6 y 7 carbonos, en disolución acuosa se ciclan. Los anillos más estables son los de 5 y 6 vértices. La ciclación se debe a la interacción entre el grupo carbonilo, que previamente se ha hidratado, y uno de los grupos – OH de la misma molécula, estableciéndose un puente de oxígeno intramolecular. Esto se debe a que las cadenas lineales de los monosacáridos no son rígidas, ya que los enlaces del carbono forman ángulos próximos a 120º, lo cual permite en una cadena muchos giros, uno de 6 ellos hace que el penúltimo –OH se aproxime al grupo carbonilo e interaccionen. Como resultado de la reacción entre el grupo carbonilo y el –OH se forman un hemiacetal en el caso del aldehído y un hemicetal en el caso de la cetona. La representación de estos ciclos en forma lineal se debe a Fischer, pero fue Haworth, el que propuso la representación de estas moléculas en anillos pentagonales y hexagonales. En uno de los vértices se sitúa el oxígeno y en los otros los carbonos, disponiéndose los grupos –OH y –H perpendicularmente al plano del anillo, de manera que si en la fórmula lineal el grupo –OH está hacia la derecha se sitúa hacia abajo y si está a la izquierda, hacia arriba. 7 Las formas pentagonales son formas furanósicas y las formas hexagonales, formas piranósicas. Estas últimas presentan dos configuraciones, una forma cis o de “bote” y otra forma trans o de “silla”. Con la formación de esta estructura cíclica, se produce un nuevo centro de asimetría (carbono hemiacetal o hemicetal), que recibe el nombre de carbono anomérico. Esto va a provocar la aparición de dos nuevos estereoisomeros, cada uno de los cuales desvían el plano de la luz polarizada con un ángulo distinto. Estos nuevos isómeros se denominan formas anoméricas. En las formas D, que como hemos dicho son las más abundantes, si el grupo –OH del carbono anomérico se encuentra debajo del plano del anillo, se dice que es forma α y si está por encima del anillo es forma β . Generalmente las fórmulas de Haworth se suelen escribir de forma simplificada. En disolución acuosa las formas α y β están continuamente interconvirtiéndose, a través del paso intermedio que es la forma lineal ( presente en 1%). Como el paso de la forma α a β y viceversa supone un cambio en los valores de rotación del plano de la luz polarizada, se produce lo que se conoce como mutarrotación. Decir, que los monosacáridos ciclados mantienen el poder reductor, pues el grupo –OH hemiacetálico/hemicetálico goza de las propiedades de los grupos carbonilos y por tanto es capaz de oxidarse, reduciendo otros compuestos. Para nombrar la forma cíclica de un monosacárido, se indica en primer lugar si es α o β , a continuación, si es forma D o L y por último, el nombre del monosacárido y el tipo de anillo. Por ejemplo: α D-­‐glucopiranosa , β-­‐ D fructofuranosa. Normalmente, las fórmulas cíclicas de los monosacáridos se representan con el carbono anomérico hacia la derecha, el resto de los carbonos del ciclo por orden en el sentido de las agujas del reloj. No obstante, la molécula puede representarse bien girada (giro de 180º según el eje Y) o volteada (giro de 180º según el eje Z). 8 4.7.- MONOSACÁRIDOS DE INTERÉS BIOLOGICO Glucosa: Sustancia muy difundida tanto entre los vegetales (uvas) como entre los animales. Forma parte de muchos disacáridos y polisacáridos. Importante fuente de energía de las células. En la sangre hay un uno por mil de glucosa procedente de la digestión. Glucemia. Si aumenta la concentración hablamos de hiperglucemia y si disminuye de hipoglucemia Fructosa: Cetohexosa. Sustancia muy difundida entre las plantas, sobre todo en sus frutos, y en la miel. En el hígado se transforma en glucosa. Junto con la glucosa forma el disacárido sacarosa. Ribosa: Aldopentosa. Forma parte Desoxirribosa: Derivada de la ribosa. de muchas sustancias orgánicas de Le falta el grupo alcohol en el carbono 2. gran interés biológico, como el ATP, Forma parte del ADN. NAD o el ARN. 9 Galactosa: Junto con la glucosa D- Ribulosa: interviene en la fijación del forma la lactosa, disacárido de la dióxido de carbono en la fotosíntesis leche. (ciclo de Calvin). N-Acetilglucosamina: Derivado de la glucosa. Se encuentra en las paredes de las bacterias y es también el monómero que forma el polisacárido quitina presente en el exoesqueleto de los insectos y las paredes celulares de muchos hongos. 10 5.-­‐ OLIGOSACÁRIDOS 5.1 INTRODUCCIÓN Son ósidos y holósidos .Están formados por la unión de un número reducido de monosacáridos ( 2 a 10) unidos mediante enlace O-­‐glucosídico, desprendiéndose agua. Los más importantes son los disacáridos, constituidos por dos monosacáridos. C6H12O6 + C6H12O6 → C12H22O11 + H2O Conservan las mismas propiedades físicas que los monosacáridos, es decir son solubles en agua, dulces y cristalizables. Pueden hidrolizarse dando lugar a monosacáridos. La hidrólisis se puede llevar a cabo en medio ácido, en caliente o mediante enzimas. 5.2 TIPOS DE ENLACE Y NOMENCLATURA Existen dos tipos de enlace O-­‐glucosídico: a) Monocarbonílico: si el enlace se establece entre el –OH del carbono anomérico de uno de los monosacáridos y el – OH de un carbono cualquiera del otro monosacárido. Estos disacáridos conservan el poder reductor, pues queda libre el carbono anomérico de uno de los monosacáridos. b) Dicarbonílico: en el enlace participan los dos carbonos anoméricos. En este caso el disacárido pierde el poder reductor. 11 El -­‐OH o los -­‐OH que intervienen en la unión pueden encontrarse bien en forma α o ß, lo que dará lugar a sustancias diferentes. ¿Cómo se nombran estos disacáridos? De forma ordenada , el primer monosacárido con el sufijo –IL y el 2º monosacárido con el sufijo –OSA si aporta elgrupo hidroxilo de un carbono cualquiera y el sufijo -­‐OSIDO si aporta el grupo hidroxilo del carbono anomérico. También se indica si es α o β y el número de los carbonos que intervienen en el enlace. 5.3.- PRINCIPALES DISACÁRIDOS Maltosa: Formada por dos D-­‐glucosas unidas por un enlace monocarbonílico α(1 → 4). Disacárido reductor. Se obtiene por hidrólisis del almidón y del glucógeno. Aparece en la germinación de la cebada empleada en la fabricación de la cerveza. Le da el sabor dulzón. Tostada se emplea como sucedáneo del café (malta). La forma β es más abundante en la naturaleza. Isomaltosa: Formada por dos moléculas de D-­‐glucosa unidas por enlace α (1 6). Es reductor y se obtiene mediante la hidrólisis del almidón y glucógeno Celobiosa: Formada por dos D-­‐glucosas unidas por un enlace monocarbonílico ß (1→ 4). Disacárido reductor. Se obtiene por hidrólisis de la celulosa. Se hidroliza con dificultad. Sacarosa: Formada por α-­‐D-­‐glucosa y ß-­‐D-­‐fructosa unidas mediante enlace dicarbonílico α(1→2), y por lo tanto no posee poder reductor.Para establecer el enlace la fructosa sufre un giro a la vez que rotan todos los radicales. Es el azúcar de mesa. Se encuentra en la caña de azúcar y en la remolacha. Es dextrógira., pero si se hidroliza, la mezcla resultante (D-­‐glucosa y D-­‐fructosa) es levógira (azúcar invertido). Como ocurre con la miel a causa de la enzima sacarasa que proviene de la saliva de las abejas. Lactosa: Formada por una molécula de glucosa y galactosa, unidas mediante enlace monocarbonílico ß (1-­‐>4). Constituye el azúcar de la leche de los mamíferos. Es un azúcar reductor, pues el –OH del C anomérico está libre y puede oxidarse. Se hidroliza por la acción de la lactasa. 12 13 5.4.- OLIGOSACÁRIDOS Existe una enorme diversidad de oligosacáridos, dependiendo del nº de monosacáridos, tipo de monosacáridos y tipo de enlace (ramificaciones). Esto hace que tengan capacidad para almacenar información siendo muy importante en la membrana celular ,pues es la parte glucídica de las glicoproteínas y de los glicolípidos la responsable de una señal de identidad; de manera que los diferentes tipo de células se reconocen entre si por los oligosacáridos presentes en el exterior de las membranas. También actúan como receptores de membrana, donde se anclan bacterias, y donde las hormonas reconocen las células diana. En la fecundación externa los espermatozoides reconocen a los ovocitos de su propia especie gracias a los oligosacáridos que presentan en su membrana. 14 POLISACÁRIDOS: 6.1.- INTRODUCCIÓN Son ósidos ,holósidos. Son polímeros formados por unidades más sencillas o monómeros. Están formados sólo por monosacáridos, cuyo número varía de unos pocos cientos a miles, dando lugar a cadenas de gran longitud y elevado peso molecular (p.m.). Se forman por la unión, mediante enlaces O-glucosídicos, de n moléculas de monosacáridos, liberándose n-1 moléculas de agua. polimerización n monosacáridos polisacárido + (n-1) H2O hidrólisis No son dulces, no cristalizan, no son solubles sino que forman disoluciones coloidales ( engrudo de almidón). No poseen carácter reductor. 6.2.- HOMOPOLISACÁRIDOS: Por hidrólisis dan un solo tipo de monosacárido. v DE RESERVA. (monosacáridos unidos por enlace α) Almidón: Es el polisacárido de reserva de los vegetales, abunda semillas, legumbres y cereales, patatas y frutos (bellotas y castañas). Es un polímero de estructura helicoidal, formado por miles de moléculas de glucosa.En realidad es una mezcla de dos constituyentes, la amilosa y la amilopectina. - La Amilosa (30%): es un polímero de α – D glucopiranosa unidas mediante enlace 1 à 4´.Molécula lineal enrollada en forma de hélice,(6 moléculas de glucosa por cada vuelta de espira de la hélice). Con el yodo se tiñe de color azul oscuro, esta coloración se debe a que el yodo se introduce entre las espiras de la hélice, formándose un compuesto de inclusión que modifica una de las propiedades físicas, como el color. Esto se aprovecha para su identificación mediante la reacción de Lugol. 15 - La Amilopectina (70%): formada por moléculas de glucosa unidas mediante enlaces α (1à4´) pero se diferencia de la amilasa en que por cada 25-30 monómeros se ramifica como consecuencia del enlace α (1 à 6´). El almidón procede de la polimerización de la glucosa que sintetizan los vegetales en el procesos de fotosíntesis, almacenándose en los amiloplastos. En su digestión intervienen dos enzimas: -amilasa (rompe enlaces 1-4) y la (1,6) glucosidasa para romper las ramificaciones, dando lugar a moléculas de dextrinas y que finalmente debido a la acción de la enzima maltasa se hidroliza en moléculas de glucosa. 16 Los seres vivos tienden a almacenar la glucosa en forma de polisacáridos, para evitar la enorme presión osmótica que supondría la presencia de millones de moléculas disueltas en el medio. Dextranos: Polisacárido de reserva de bacterias y levaduras. Glucógeno: Polisacárido de reserva en los animales. Es un polímero de α – D glucopiranosa. Se acumula en el hígado(10%) y músculo(2%) preferentemente, desde donde se moviliza cuando es necesario convirtiéndose en glucosa. Estructura molecular helicoidal ramificada. Por lo tanto presenta enlaces α(1 à 4´) y α(1 -> 6´). Posee mayor ramificación que la amilopectina (cada 8-12 glucosas) Se requieren dos enzimas para su hidrólisis (glucógeno-fosforilasa) y (1-6) glucosidasa, dando lugar a unidades de glucosa. La naturaleza ramificada de este polisacárido favorece que las enzimas hidrolíticas puedan actuar simultáneamente en muchas ramas aumentando así la velocidad de liberación de glucosa, lo que resulta de gran utilidad para las células cuando necesitan un aporte energético importante de una manera inmediata. Esto supone una ventaja adaptativa para los animales, pues ante un ataque o huída necesitan movilizar sus reservas energéticas rápidamente. Cada molécula de almidón o de glucógeno posee tantos extremos no reductores como ramas y un solo extremo reductor, lo que explica que estos polisacáridos carezcan de poder reductor. Las enzimas hidrolíticas actúan a partir de los extremos no reductores. El glucógeno se almacena hidratado por lo que su masa molecular aumenta mucho. Por este motivo, las reservas de glucógeno son limitadas y se agotan rápidamente. 17 v ESTRUCTURALES (monosacáridos unidos por enlace β) Celulosa: Polisacárido estructural, exclusivo de las células vegetales, forma parte de la pared celular. Es el componente principal de la madera (el 50% es celulosa) algodón, cáñamo Es el polisacárido más abundante de la biosfera. Es un polímero no ramificado, insoluble en agua y difícilmente hidrolizable. Está formado por unidades de β- Dglucopiranosa unidas mediante enlace 1à 4 Es una molécula lineal con más de 1000 moléculas de glucosa. Cada molécula de glucosa “silla”, está girada 180º respecto a la anterior, lo que le da a la celulosa una estructura lineal, pero retorcida; por otro lado los puentes de hidrógeno (intracatenarios) que se establecen entre grupos hidroxilo (-OH) de moléculas colindantes, refuerzan dicha estructura; además se establecen puentes de hidrógeno entre diferentes cadenas (intercatenarios), lo que favorece el empaquetamiento de varias cadenas, formando haces que se empaquetan en microfibrillas paralelas que a su vez se agrupan en fibrillas, que, se disponen junto a otras, y forman la pared de celulosa. Esta estructura presenta una gran cohesión, ideal para la función de sostén. La mayoría de los animales no digieren la celulosa, ya que no poseen las enzimas capaces de romper ese enlace β . Lo herbívoros tienen en su tubo digestivo bacterias y protozoos que producen celulasa, la enzima capaz de degradar este polisacárido. Quitina: Polisacárido presente en el exoesqueleto de artrópodos y en la pared celular de muchos hongos. Es un polímero no ramificado de N-acetil β- glucosamina, el enlace es β (1 à 4´). Las cadenas de estos polímeros se disponen en capas superpuestas con orientaciones diferentes, lo que proporciona gran consistencia a los caparazones. 18 P 6.3.- RELACIÓN POLISACÁRIDOS ENTRE ESTRUCTURA Y FUNCIÓN DE LOS Glucógeno y almidón: Las moléculas de glucosa están unidas mediante enlace α (1 4´) y α (1 6´)esto hace que adopten una configuración enrollada en hélice, lo que favorece la formación de gránulos densos adecuados para el almacenamiento. Celulosa y quitina: Las moléculas de glucosa están unidas mediante enlaces β (1 4´), lo , por lo que adoptan una configuración alargada, extendida, además experimentan una agregación lateral formando fibrillas insolubles en agua , esto las hace adecuadas para una función estructural. Cómo conclusión se puede afirmar que la función de una molécula algunas veces está determinada no por su composición, sino por su estructura. Si bien es cierto que la composición determina la estructura. 6.4.- HETEROPOLISACÁRIDOS: Mediante hidrólisis dan diferentes monosacáridos. 19 v ORIGEN VEGETAL: § § § Agar-Agar: Presente en las algas rojas, se utiliza en microbiología como medio de cultivo de microorganismos. También se utiliza en la industria alimentaria como espesante (E406). Gomas vegetales (goma arábiga, de cerezo,…): Son sustancias viscosas que segregan determinadas plantas para cerrar una herida. Al secarse al aire cristalizan , disueltas en agua sirven para obtener pegamentos. Pectinas y hemicelulosas: componentes de la pared celular de vegetales.Contribuyen a la formación de la pared celular de las plantas. Debido a su capacidad gelificante la pectina se utiliza en la fabricación de mermeladas. Es un polímero de un derivado de la galactosa. Abundante en la manzana, pera, ciruela y membrillo. v ORIGEN ANIMAL: Glucosaminoglucanos: Polímeros lineales de disacáridos en los que uno de los dos azúcares es siempre un aminoazúcar (acetilglucosamina o N-acetilgalactosamina. La mayoría aparecen ligados a proteínas formando proteoglucanos en la matriz extracelular y en las secreciones. Están muy hidratados y forman un gel. Algunos ejemplos son: o Ácido hialurónico: en tejido conjuntivo, humor vítreo del ojo y líquidos sinoviales. Actúa como lubricante o Condroitín sulfato: en tejido cartilaginoso y óseo. o Heparina: es una sustancia anticoagulante, presente en la sustancia intercelular de todos los tejidos, especialmente hígado, pulmones, músculos, pared de las arterias, glándulas salivales de animales hematófagos,… 7.- HETERÓSIDOS: § Son ósidos y presentan una parte glucídica y otra no glucídica (aglucón). • • • Principios activos de plantas medicinales, como la digitonina que es un cardiotónico , otros son cianogenéticos , como los que hay en la almendra amarga, su ingestión libera ácido cianhídrico que puede ser mortal. Glucolípidos: La parte no glucídica es un lípido. Son componentes de las membranas celulares, como los Gangliósidos y Cerebrósidos. Glucoproteínas: el aglucón es una proteína, predomina ésta. 20 - - Mucoproteínas ó Mucinas: Sustancias gelatinosas, pegajosas ó resbaladizas, que debido a su elevada viscosidad actúan como lubricantes, se localizan en el tracto digestivo, respiratorio y urogenital. Proteínas séricas: como las inmunoglobulinas (anticuerpos) Hormonas: LH y FSH Glucoproteínas estructurales, que junto con los glucolípidos, actúan como marcadores biológicos y lugares de reconocimiento celular. Por ello: 1) Se comportan como determinantes antigénicos es decir, zonas de la superficie de la membrana capaces de estimular la síntesis de anticuerpos. (grupos sanguíneos) 2) Actúan como receptores o lugares de anclaje de virus y bacterias. 3) Influyen en el tiempo de vida de las células sanguíneas. Pétidoglicanos: Son componentes de la pared bacteriana. Están formados por un armazón de naturaleza polisacárida, en la que largas cadenas de N-acetil glucosamina y ácido N-acetil murámico están conectadas por cortos péptidos. Como predomina la parte glucídica son proteoglucanos. 21