NOMBRE: Riboflavina (VITAMINA B2) Solución, 25mg/mL.
Anuncio

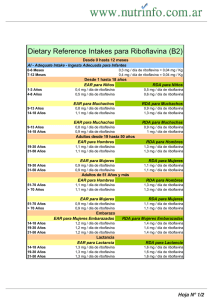
Servicio de Farmacia. NORMAS DE CORRECTA ELABORACIÓN Y CONTROL. FM PROCEDIMIENTOS NORMALIZADOS. NOMBRE: Riboflavina (VITAMINA B2) Solución, 25mg/mL. PRESENTACIÓN: 50mL en frasco cristal topacio de 60mL. PREPARACIÓN DESTINADA A PACIENTES PEDIÁTRICOS EQUIVALENCIA: 1mL contiene 31,75mg de RIBOFLAVINA Fosfato sódico y 0,065mEq de Sodio. INDICACIONES, PROPIEDADES TERAPÉUTICAS: En defectos de β-oxidación mitocondrial y en déficit de la cadena respiratoria mitocondrial. VÍA DE ADMINISTRACIÓN: VÍA ORAL–EXCLUSIVAMENTECOMPOSICIÓN por: • Riboflavina (A) 100mL ....................................... • Agua esterilizada para preparaciones inyectables 2,5g mL 25mg 100mL MATERIAS PRIMAS NECESARIAS ( para preparar 100mL). (A) Riboflavina fosfato sódico.2H2O, 3,42g. (B) Agua esterilizada para preparaciones inyectables®. APARATOS Y UTILLAJE: Balanza digital 0,001. Espátula. Vaso de precipitados. Probeta. Embudo. Agitador magnético. Varilla magnética. Vidrio de reloj. Mortero y pistilo. Gasa hidrófila de algodón rectangular 10x20. ¾ Compresas estériles 16x25. ¾ Papel de filtro. ¾ PHmetro. ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ Nota: la capacidad del utillaje empleado se escogerá en función del volumen del lote que se vaya a preparar. TÉCNICA DE ELABORACIÓN ENVASES Y ETIQUETAS TRABAJAR CON LAS MÁXIMAS CONDICIONES DE HIGIENE (PN/L/PG/003/00) Y SIGUIENDO EL PROTOCOLO DE ELABORACIÓN DE Soluciones (FN/L/FF/007/00). Envase: Frasco ESTÉRIL de cristal topacio con cuenta gotas. Solución acuosa BEBIBLE, 50mL contiene 0,065mEq de sodio/mL NEVERA RIBOFLAVINA 25mg/mL PACIENTE LOTE: PROTEGER DE LA LUZ Etiqueta: VIA ORAL 1.- Medir (B) en Probeta. Reservar. 2.- Pesar (A) en Vidrio de reloj y colocarlo en el Mortero. 3.- Añadir al paso 2 una pequeña parte de (B) y humectar con ayuda de la mano del Mortero hasta obtener una pasta homogénea. Añadir un poco más de agua hasta disolución y trasvasar al Vaso de precipitados. Lavar varias veces el mortero con pequeñas porciones de (B) que se irán añadiendo al Vaso hasta completar el volumen total. 4.- Colocar la varilla magnética en el Vaso de precipitados y agitar bajo agitación magnética hasta total disolución. 5.- Determinar el pH y anotarlo en la Hoja de Elaboración. CADUCIDAD: mantener fuera del alcance de los niños Acondicionar la solución, con la ayuda del embudo, en los envases correspondientes debidamente etiquetados y cerrar herméticamente. EXCIPIENTES DE DECLARACIÓN OBLIGATORIA: CADUCIDAD: 2 semanas. CARACTERÍSTICAS DEL PRODUCTO TERMINADO: Solución transparente y color naranja, de sabor muy amargo, cuyo pH debe encontrarse entre 5 y 6,5. CONDICIONES DE CONSERVACIÓN: PROTEGER DE LA LUZ. GUARDAR EN NEVERA. ADVERTENCIAS Y PRECAUCIONES: Elaborar manteniendo las máximas condiciones de asepsia. BIBLIOGRAFÍA: REAL FARMACOPEA ESPAÑOLA. 2ª Edición. Madrid 2002, Pág. 2254. FORMULACIÓN MAGISTRAL DE MEDICAMENTOS. Colegio Oficial de Farmacéuticos de Vizcaya, 1993, Pág. 80. THE INDEX MERK. 12ª Edición. Rahway, N.J., U.S.A., 1996, pag1410. REMINGTON. Farmacia. 20 Edición (edición española). Buenos Aires, 2003, Pág. 2170. Martindale. THE COMPLETE DRUG REFERENCE. 33ª Edición. Londres, 2002, Pág. 1386. FNP 38(1988), FNP 52 (1992). DRUGS PREGNANCY and LACTATION, 5 edición, 1997, Pág. 943. Área de Farmacotecnia y Acondicionado de Medicamentos en Forma Unitaria. FÓRMULAS MAGISTRALES. Servicio de Farmacia. NORMAS DE CORRECTA ELABORACIÓN Y CONTROL. FM PROCEDIMIENTOS NORMALIZADOS. CONTROLES ANALÍTICOS A EFECTUAR, MÉTODOS Y LÍMITES Riboflavina fosfato: Polvo cristalino, amarillo o amarillo naranja, higroscópico, soluble en agua, muy poco soluble en alcohol, prácticamente insoluble en éter. PM Riboflavina 376,4 PM de Riboflavina fosfato 478,3 (con 2 mol de agua= 514,3). El fosfato de riboflavina y sodio es una mezcla que contiene riboflavina 5’-(hidrogenofosfato de sodio) como componente principal y otras riboflavinas monofosfato de sodio. Contiene no menos del 73,0% y no más del 79,0% de riboflavina (C17H20N4O6, PM 376,4), calculado con respecto a la sustancia desecada. Contiene cantidades variables de agua. Debe cumplir los requisitos especificados en la Monografía 786 de la RFE. Agua esterilizada para preparaciones inyectables: El agua esterilizada para preparaciones inyectables es agua purificada por destilación o por ósmosis inversa destinada para preparaciones inyectables a granel distribuida en envases adecuados, cerrados y esterilizados por calor en condiciones tales que aseguren que el producto todavía satisface el ensayo de endotoxinas bacterianas. El agua esterilizada para inyectables está exenta de sustancias añadidas. Examinada con visibilidad adecuada, el agua esterilizada para preparaciones inyectables es límpida e incolora. NUESTRA PREPARACIÓN: Solución transparente, color naranja, de sabor muy amargo, cuyo pH debe encontrarse entre 5 y 6,5. INFORMACIÓN ADICIONAL DISPENSACIÓN: Esta solución es una fórmula individualizada. Las preparaciones realizadas en el Servicio de Farmacia del Hospital son exclusivamente para enfermos hospitalizados. 1,27g de la sal equivalen a 1g de la base y contiene 0,06g de Na. 1mL de la solución contiene 31,75 mg de la sal y 0,065mEq de sodio (1,5mg ) Vitamina hidrosoluble esencial para la utilización de energía a partir de los alimentos. La formas fosforiladas activas participan como coenzimas en las reacciones metabólicas oxireductoras. Es necesaria para el funcionamiento de la Piridoxina y del Ácido nicotínico. FARMACOCINÉTICA: Se absorbe en el tubo digestivo. Se convierte a coenzima flavino mononucleótido y más tarde a flavina adenina diinucleótido. Se une a proteínas en un 60% y se excreta por orina. DOSIS PEDIÁTRICAS: 100-120mg/día (sólo 2 casos publicados: GRIEBEL y otros 1990 y ARTS y otros 1983) (Defectos en el enzima mitocondrial NADH deshidrogenasa). INFORMACIÓN AL PACIENTE Paciente: TELÉFONO: RIBOFLAVINA Solución, 25mg/mL. FORMA FARMACÉUTICA: SOLUCIÓN VÍA DE ADMINISTRACIÓN: VÍA ORAL–EXCLUSIVAMENTECOMPOSICIÓN por mL: Riboflavina 25mL y agua. POSOLOGÍA: Administrar sólo bajo prescripción médica y según sus indicaciones. CONDICIONES DE CONSERVACIÓN: Mantener el recipiente perfectamente cerrado. Guarde la fórmula al abrigo de la luz y en NEVERA. Nunca en el cuarto de baño. CADUCIDAD: La indicada en el envase. PRECAUCIONES Y NORMAS PARA SU CORRECTA ADMINISTRACIÓN: VÍA ORAL–EXCLUSIVAMENTE- Si está tomando cualquier otra medicación debe de comunicárselo a su médico antes de comenzar el tratamiento. Lávese bien las manos antes y después de la utilización del preparado. No usar una vez pasada la fecha de caducidad. Mantener el envase bien cerrado después de cada uso. Si observa algún cambio en el aspecto de la fórmula consulte a su farmacéutico antes de seguir utilizándola. Si se produce algún tipo de reacción alérgica consulte inmediatamente con su médico. Servicio de Información Toxicológica, Telf. : 915620420. ADVERTENCIA: LOS MEDICAMENTOS DEBEN MANTENERSE FUERA DEL ALCANCE DE LOS NIÑOS. Área de Farmacotecnia y Acondicionado de Medicamentos en Forma Unitaria. FÓRMULAS MAGISTRALES. EQUIVALENCIA: 1mL de esta solución contienen 31,75mg de fosfato disódico de Ribiflavina. Solución BEBIBLE 25mg/mL Cambio de cápsulas de diferentes dosis a: PRESCRIPCIONES EN PEDIATRÍA 50mL LOTE: PACIENTE CADUCIDAD: mantener fuera del alcance de los niños Solución acuosa BEBIBLE, 50mL HOSPITAL 12 de OCTUBRE. Servicio de Farmacia VIA ORAL RIBOFLAVINA 25mg/mL NEVERA CARACTERÍSTICAS PARTICULARES DE ESTA SOLUCIÓN: 50mL en FRASCO cristal TOPACIO 60 mL Laboratorio de Farmacotecnia. FÓRMULAS MAGISTRALES PROTEGER DE LA LUZ CONSERVAR EN NEVERA 0,1 mL = 2,5 mg 0,2mL = 5mg 0,3mL = 7,5mg 0,4mL = 10mg 0,5mL = 12,5mg 0,6mL = 15mg ............................ Solución límpida, transparente, color naranja, de sabor muy amargo, cuyo pH debe encontrarse entre 5 y 6,5. COMPONENTES DE LA SOLUCIÓN: Fosfato disódico de Riboflavina (0,75mEq de sodio/mL de solución )y agua. SOLUCIÓN de RIBOFLAVINA 25mg/mL RIBOFLAVINA PROTEGER DE LA LUZ