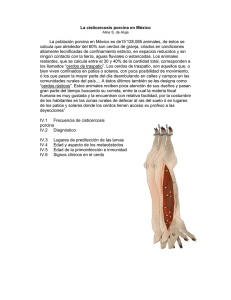
El descubrimiento de Lawsonia intracellularis
Anuncio

SIMPOSIO EUROPEO SOBRE ENTERISOL® ILEITIS | 13-15 DE OCTUBRE DE 2005 | BARCELONA Steven McOrist, Connie Gebhart El descubrimiento de Lawsonia intracellularis Dr. Steven McOrist QAF Industries, Corowa, NSW 2646, Australia Dr. Connie Gebhart Facultad de Veterinaria, Universidad de Minnesota, St. Paul, EE.UU abcd Introducción observados en el intestino de los cerdos mediante microscopía electrónica y técnicas de tinción especiales. El agente etiológico de la enteropatía proliferativa porcina (EP, ileítis) es la bacteria intracelular obligada Lawsonia intracellularis, que crece preferentemente en el citoplasma de las células epiteliales del intestino. El crecimiento de esta bacteria se ve acompañado invariablemente por la proliferación localizada de las células inmaduras de las criptas que son infectadas. Hasta el momento no se ha logrado cultivar a Lawsonia en un medio sin células, probablemente porque depende de los trifosfatos sintetizados en las mitocondrias celulares o de una fuente de energía similar localizada en la célula hospedadora para satisfacer sus necesidades metabólicas. Este fenómeno de “parasitismo energético” es similar al de otras bacterias intracelulares obligadas como algunas especies de clamidias y rickettsias, aunque Lawsonia no está emparentada con dichas bacterias. Historia de la investigación de la ileítis Harry Biester y otros investigadores del Veterinary Medical Research Institute de Ames, Iowa, EE.UU., fueron los primeros en describir allá por los años treinta las lesiones de la enteropatía proliferativa en los cerdos. Sus trabajos facilitaron una descripción anatomopatológica de las lesiones y planteaban la hipótesis de que podían estar asociadas con las dietas ricas en grano y pobres en vitaminas, comunes en la época. Los trabajos publicados a partir de entonces y hasta la década de 1950 aportaron una serie de descripciones de casos en Escandinavia y otros lugares, también centrados en los aspectos anatomopatológicos. A finales de la década de los años sesenta, los métodos de explotación intensiva irrumpieron con fuerza en la industria porcina y con ellos los antibióticos incorporados en el pienso como la tilosina, cambios que probablemente propiciaron un aumento del contagio de Lawsonia y la aparición de poblaciones de cerdos sensibles a ella. Esto potenció un mayor número de descripciones clínicas y anatomopatológicas, fruto de los trabajos de varios investigadores de la Universidad de Edimburgo, Allan Rowland, Giles Rowntree y Gordon Lawson, que investigaban los grandes brotes acontecidos en el Reino Unido. Como parte de esta labor, dichos investigadores desarrollaron un programa de investigación productiva y examinaron los cambios proliferativos Allan Rowland 3 BOEHRINGER INGELHEIM | EUROPEAN ENTERISOL® ILEITIS SYMPOSIUM Rowland, Rowntree y Lawson descubrieron la presencia habitual de pequeñas bacterias curvas en el interior de las células proliferativas anómalas al examinar la ultraestructura de las lesiones o emplear tinciones de plata (ver Rowland y Lawson 1974). Estas bacterias eran bacilos vibrioides gramnegativos, curvados o rectos, de extremos puntiagudos o romos, y 1,25-1,75 µm de largo y 0,25-0,43 µm de ancho. Las bacterias permanecían normalmente libres en el citoplasma apical de las células epiteliales infectadas y no aparecían unidas a la membrana durante las etapas principales de la infección. Un primer experimento de transmisión con mucosa homogeneizada afectada por la enteropatía proliferativa, extraída de un caso natural y administrada como un inóculo oral, arrojó resultados positivos (ver Roberts et al 1977), indicando que dichas bacterias eran los agentes causantes de las lesiones. Sin embargo, posteriores intentos para repetir el experimento, incluso con el mismo inóculo por parte de los citados investigadores, resultaron infructuosos. Este problema de inóculos fallidos, recurrente en varios estudios posteriores realizados en el marco de la enteropatía proliferativa en EE.UU., Australia y otros lugares, se atribuyó a la pérdida de título infeccioso durante la permanencia en los contenedores de muy baja temperatura de la época. Algunos de estos primeros trabajos citan a la bacteria intracelular como organismo afín a Campylobacter, una designación basada exclusivamente en la similitud morfológica con este género. A lo largo de muchos años de trabajo, diversas especies de Campylobacter, en particular C. mucosalis, C. hyointestinalis, C. jejuni, “C. hyoilei” (después considerada una variante de C. jejuni) y C. coli, fueron aisladas de las lesiones proliferativas en cultivos puros por distintos grupos de investigación que perseguían la identificación del presunto agente causal. Las lesiones proliferativas características o la colonización intracelular, empero, no aparecían tras inocular estas bacterias a los cerdos. Todos los ensayos realizados con una amplia gama de cerdos (de distintas edades, individuos gnotobióticos, libres de patógenos específicos, etc.) y de técnicas de exposición a las bacterias no produjeron resultados significativos. Esta larga cadena de experimentos fallidos se prolongó durante los años setenta y ochenta y dio rienda suelta a hipótesis sobre la implicación de virus, especies de Chlamydia o agentes infecciosos dobles. En realidad, las especies de Campylobacter eran agentes secundarios oportunistas que aprovechaban las condiciones alteradas del intestino para colonizarlo, de ahí su aumento en las lesiones de la enteropatía proliferativa. Este fenómeno de colonización por bacterias oportunistas no es exclusivo de la enteropatía proliferativa y puede observarse en otras enfermedades intestinales que afectan al cerdo como la disentería porcina. El descubrimiento de la bacteria intracelular en el marco de la enteropatía proliferativa porcina condujo a los investigadores a detectar la presencia de agentes infecciosos afines en lesiones similares de la ileítis proliferativa observada en hámsters de laboratorio en EE.UU. (ver Frisk y Wagner 1977). Los estudios de exposición subsiguientes realizados en hámsters culminaron con éxito. Los hámsters eran afectados por las bacterias intracelulares obtenidas de las lesiones provocadas por la enteropatía proliferativa tanto en cerdos como en individuos de su propia especie, un claro indicio de que ambos hospedadores se veían afectados por el mismo agente causal. Por desgracia, los estudios de cultivo y de otro tipo realizados con estos roedores durante los años setenta y ochenta y destinados a identificar el microorganismo correcto, Lawsonia, resultaron tan infructuosos como los estudios realizados en cerdos. El descubrimiento de Lawsonia intracellularis Los estudios de antígenos y los estudios de exposición fallidos de finales de los años ochenta descartaron que la bacteria intracelular causante de la enteropatía proliferativa fuera una especie de Campylobacter de vida libre. El claro ciclo de vida intracelular que mostraba el microbio llevó a pensar en la posibilidad de que se tratara de una bacteria intracelular obligada, con ciertas semejanzas con algunas especies de rickettsias, una hipótesis que se materializó en diversos intentos de cultivar las bacterias intracelulares en células de cultivo a partir de inóculos obtenidos de las lesiones de la enfermedad. El primer informe de cocultivo de Lawsonia en una estirpe celular cultivada se remonta a 1978, en concreto al grupo de Robert Jacoby, que investigaba la enteropatía proliferativa en hámsters. Después del fracaso de los trabajos con Campylobacter de los años ochenta, este trabajo pionero de cultivo celular fue redescubierto y retomado a principios de los noventa por Hal Stills y Connie Gebhart en EE.UU. y por Gordon Lawson y Steven McOrist en Escocia. Stills publicó la primera descripción de un cultivo de bacterias Lawsonia a partir de casos de enteropatía proliferativa en hámsters en 1991, pero por desgracia una clamidia no patógena sin ninguna relación con el patógeno de interés contaminó los cultivos, por lo que no se pudieron practicar inoculaciones a los animales y realizar los trabajos taxonómicos con el auténtico agente causal. La identidad de la bacteria y su papel etiológico en la enteropatía proliferativa porcina se resolvieron finalmente en 1993 gracias al cultivo del microorganismo intracelular en células cultivadas y a la reproducción de la enfermedad en cerdos mediante un cultivo puro de este agente infeccioso (ver Lawson et al. 1993, y McOrist et al. 1993). Ese mismo año se dilucidó también su posición taxonómica (ver Gebhart et al. 1993), la bacteria recibió el nombre de Artículo publicado en Nature en 1973. Bacteria intracelular y de morfología curva asociada a la proliferación de las células epiteliales en la enteropatía proliferativa. Reseña de uno de los primeros trabajos Lawsonia intracellularis y fue incluida en la familia Desulfovibrionaceae (ver McOrist et al., 1995). El nombre de Lawsonia se escogió para honrar la labor y la perseverancia del veterinario escocés Gordon Lawson, cuya contribución resultó fundamental para su descubrimiento. El desarrollo del cocultivo de Lawsonia exigió especial precaución en la localización de la fuente del material de enteropatía proliferativa y en las técnicas de extracción, así como en la atmósfera y las técnicas de mantenimiento, las técnicas de pase y la reducción de contaminaciones en el cultivo celular, amén de muchos otros detalles. El desarrollo de los estudios de exposición requirió considerar detalladamente el origen de los cerdos y de su flora bacteriana, etc. Y dada la naturaleza endémica del agente infeccioso entre las piaras que podían utilizarse como fuente de los cerdos de los estudios, los ensayos de exposición tuvieron que realizarse bajo un control minucioso para detectar los casos espontáneos de enteropatía proliferativa entre los controles negativos. Características de Lawsonia intracellularis Lawsonia intracellularis presenta una morfología bacilar vibrioide, curva o recta, con extremos puntiagudos o romos, y mide 1,25 – 1,75 µm de largo y 0,25-0,43 µm de ancho. La pared celular trilaminar es típica de las bacterias gramnegativas y no se han observado fimbrias o esporas. Algunas cepas cultivadas en estirpes celulares presentan un único flagelo polar, largo y de motilidad pulsátil, pero sólo cuando la bacteria se encuentra en el medio extracelular. Lawsonia tiene un solo cromosoma circular de pequeño tamaño y tres megaplásmidos que suman un total de 1,72 millones de pares de bases de ADN y 1324 marcos de lectura abiertos (genes funcionales). El pequeño tamaño del genoma, la respiración dependiente de la célula hospedadora (“parásito energético”) y el bajo cociente G+C de su BOEHRINGER INGELHEIM | EUROPEAN ENTERISOL® ILEITIS SYMPOSIUM 4 La explosión de la investigación sobre la enteropatía proliferativa Una vez identificado el agente causal de la enteropatía proliferativa a mediados de los años noventa, los grupos citados y muchos otros grupos de investigación europeos y norteamericanos comenzaron a trabajar con celeridad en aspectos más prácticos de la enfermedad para la industria porcina. Cuestiones como la sensibilidad de Lawsonia a diferentes antibióticos, su epidemiología dentro y entre las explotaciones porcinas y los métodos de diagnóstico en cerdos, por citar algunas, fueron objeto de investigación (ver Knittel et al, 1998). En 1994 se iniciaron los trabajos para diseñar una vacuna contra la ileítis que desembocaron en el registro de la primera vacuna (Enterisol® Ileitis, Boehringer Ingelheim) siete años después. Hoy esta eficaz vacuna está registrada en un gran número de países y se utiliza en todo el mundo (ver Guedes y Gebhart 2003, y Kroll et al. 2004). El rápido desarrollo de la vacuna contra la ileítis contrasta con el lento ritmo de desarrollo de otras vacunas destinadas a importantes enfermedades intestinales del ganado porcino como la disentería y la colibacilosis porcina. Fotografía obtenida con microscopía electrónica de transmisión de Lawsonia intracellularis en el interior de una célula cultivada del epitelio intestinal. Se observa la pared celular típica de una bacteria gramnegativa y la morfología de bacilo vibrioide. ADN, así como la expresión significativa de proteínas de choque térmico gro EL, son características que comparte con otras bacterias intracelulares obligadas y simbiontes. El análisis genómico ha permitido localizar varios genes que codifican para el flagelo, genes de biosíntesis de folato y otros genes bioquímicos bacterianos habituales. Los grandes megaplásmidos se han descrito en otras bacterias intracelulares, como algunas especies de Brucella. A pesar de su inclusión en la familia Desulfovibrionaceae, realizada a partir del análisis de la secuencia de ADN, no parece poseer capacidad sulfatorreductora. Un hecho destacable es que, a diferencia de las especies del género Desulfovibrio, parece haber adquirido un mecanismo activo de entrada en la célula y otro mecanismo para actuar sobre las células hospedadoras diana in vivo. Las colonias de L. intracellularis aisladas en cerdos y las de otros orígenes y especies hospedadoras (hámster, caballo, cérvidos) muestran un alto grado de semejanza (>98%) en las secuencias de ADN de regiones de importancia taxonómica clave y en las proteínas de la pared celular, lo que hace factible la existencia de una sola “cepa” homogénea de L. intracellularis. Estos rasgos indican que los considerables cambios genéticos producidos a partir de Desulfovibrio o de otros antepasados bacterianos han tenido lugar recientemente, porque la aparición de distintas “cepas” requiere cierto tiempo para desarrollarse y ser detectada. 5 BOEHRINGER INGELHEIM | EUROPEAN ENTERISOL® ILEITIS SYMPOSIUM La bacteria Lawsonia intracellularis Referencias seleccionadas Frisk, C. S. and Wagner, J. E. (1977): Experimental hamster enteritis: An electron microscopic study. Am J Vet Res 38: 1861–1868. Gebhart, C. J.; Barns, S. M.; McOrist, S.; Lin, G.-F. and Lawson, G. H. K. (1993): Ileal symbiont intracellularis, an obligate intracellular bacterium of porcine intestines showing a relationship to Desulfovibrio species. Int J Syst Bacteriol 43: 533 – 538. Guedes, R. M. C. and Gebhart, C. J. (2003): Onset and duration of fecal shedding, cell-mediated and humoral immune responses in pigs after challenge with a pathogenic isolate or attenuated vaccine strain of Lawsonia intracellularis. Vet Microbiol 91: 135 – 145. Knittel, J. P.; Jordan, D. M.; Schwartz, K. J.; Janke, B. H.; Roof, M. B.; McOrist, S. and Harris, D. L. (1998): Evaluation of antemortem polymerase chain reaction and serologic methods for detection of Lawsonia intracellularis-infected pigs. Am J Vet Res 59: 722 – 726. Kroll, J.; Roof, M. B.; and McOrist, S. (2004): Evaluation of protective immunity in pigs following oral administration of an avirulent live vaccine of Lawsonia intracellularis. Am J Vet Res 65: 559 - 565. Lawson, G. H. K.; McOrist, S.; Sabri, J. and Mackie, R. A. (1993): Intracellular bacteria of porcine proliferative enteropathy: Cultivation and maintenance in vitro. J Clin Microbiol 31: 1136 – 1142. McOrist, S.; Jasni, S.; Mackie, R. A.; MacIntyre, N.; Neef, N. and Lawson, G. H. K. (1993): Reproduction of porcine proliferative enteropathy with pure cultures of ileal symbiont intracellularis. Infect Immun 61: 4286 – 4292. McOrist, S., Gebhart, C. J.; Boid, R. and Barns, S. M. (1995): Characterization of Lawsonia intracellularis gen. nov., sp. nov., the obligately intracellular bacterium of porcine proliferative enteropathy. Int J Syst Bacteriol 45: 820 – 825. Roberts, L.; Rowland, A. C. and Lawson, G. H. K. (1977): Experimental reproduction of porcine intestinal adenomatosis and necrotic enteritis. Vet Rec 100: 12 – 13. Rowland, A. C. and Rowntree, P. G. M. (1972): A haemorrhagic bowel syndrome associated with intestinal adenomatosis in the pig. Vet Rec 91: 235 – 241. Rowland, A. C. and Lawson, G. H. K. (1974): Intestinal adenomatosis in the pig: Immunofl uorescent and electron microscopic studies. Res Vet Sci 17: 323 – 330. Stills, H. R. (1991): Isolation of an intracellular bacterium from hamsters (Mesocricetus auratus) with proliferative ileitis and reproduction of the disease with a pure culture. Infect Immun 59: 3227 – 3236. BOEHRINGER INGELHEIM | EUROPEAN ENTERISOL® ILEITIS SYMPOSIUM 6 Boehringer Ingelheim España, S.A. División Veterinaria Prat de la Riba s/n - Sector Turó Can Matas. 08173 Sant Cugat del Vallès www.boehringer-ingelheim.es/veterinaria e-mail: [email protected]