Monografía de las micosis sistémicas. - Facultad de Medicina
Anuncio

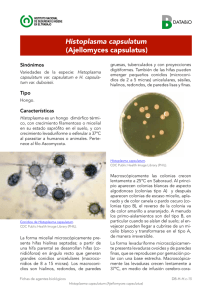
1 CATEDRA ESPECIAL DOCTOR MANUEL MARTÍNEZ BÁEZ MONOGRAFÍA DE LAS MICOSIS SISTÉMICAS PERIODO 2009 -2011 Doctor en Ciencias Laura Rosio Castañón Olivares Profesor Titular A Laboratorio de Micología Médica Departamento de Microbiología y Parasitología Facultad de Medicina, UNAM 2 CÁTEDRA ESPECIAL DR. MANUEL MARTÍNEZ BÁEZ El Dr. Martínez Báez, nació en Morelia, Mich., el 26 de septiembre de 1894 y murió en la ciudad de México el 19 de enero de 1987. Entre otras actividades fue ayudante y maestro de patología general y clínica médica en la Escuela de Medicina de la Universidad Nacional. Se especializó en los institutos de Parasitología de la Universidad de París, en el de Enfermedades e Higiene Tropicales de Hamburgo, en el de Malariología de Navalmoral de la Mata, España, y en la Estación Experimental para la Lucha Antimalárica de Roma. Cursó histología en el Hospital Saint Louis de París y anatomía patológica en el laboratorio de histopatología del doctor Del Río Hortega, en Madrid. La obra de Manuel Martínez Báez se agrupa en torno a cuatro áreas: parasitología, salud pública, sociología médica e historia de la medicina. Su aportación fue relevante porque adecuó a la realidad de los países subdesarrollados los conceptos que, sobre enfermedades tropicales surgieron en países ajenos a esa problemática. En la facultad de medicina, la asignación de Cátedras Especiales, tiene por objeto promover la superación del nivel académico de la UNAM. En esta ocasión ha tocado el turno al área de la micología médica. El presente trabajo tiene como principal objetivo: Ilustrar al alumno, mediante un manual iconográfico, algunas características clínicas, de diagnóstico y micológicas de las micosis sistémicas más frecuentes en nuestro país: histoplasmosis, coccidioidomicosis y paracoccidioidomicosis. 3 LAS MICOSIS SISTÉMICAS Son enfermedades producidas por hongos dimórficos, que viven en forma filamentosa en el ambiente de áreas geográficas definidas y una vez que ingresan, vía inhalación, en el huésped mamífero, se convierten en formas parasitarias que son las causantes de los signos y síntomas de la enfermedad que producen. En nuestro país, las principales micosis sistémicas causadas por hongos patógenos primarios son: INFECCIÓN Hsitoplasmosis Coccidioidomicosis Paracoccidioides HONGO Coccidioides posadasii Coccidioides immitis / Histoplasma capsulatum Paracoccidioides brasiliensis AGENTE (S) ETIOLÓGICO (S) Histoplasma capsulatum var. capsulatum Coccidioides posadasii y C. immitis Paracoccidioides brasiliensis CRECIMIENTO 25 -30°C (forma infectante) 37 - 40°C (forma parásita) Micelio con artroconidios Esférulas con endosporas Micelio con macroconidios Levaduras gemantes tuberculados y microconidios intracelulares Micelio con aleurioconidios Levaduras multigemantes Cuando las partículas infectantes ingresan al humano, se provoca una primoinfección que puede progresar hacia distintas situaciones clínicas según el estado inmunológico del paciente. Histoplasmosis Coccidioidomicosis Paracoccidioidomicosis POSTERIOR A LA INFECCIÓN PULMONAR, LOS HONGOS SE DISEMINAN A: Bazo, hígado, ganglios linfáticos Sistema nervioso central, articulaciones, tejido subcutáneo Mucosa bucal, nasal, conjuntival Precauciones de laboratorio Los cuatro hongos tratados en la presente monografía, son considerados como muy infecciosos, por lo que dada la gran producción y peligrosidad de micelio y conidios a partir de los cultivos efectuados a 25-30°C, cualquier manipulación 4 deberá ser efectuada con extremas precauciones y por personal experto de laboratorio, en condiciones de seguridad biológica niveles 2 y 3. NÚMERO DE CASOS DE MICOSIS SISTÉMICAS SEGÚN DATOS DE LA SECRETARÍA DE SALUD AÑO 1988 1989 1990 1991 1992 1993 1994 De 1995 al 2010 HISTOPLASMOSIS 83 149 156 68 130 185 258 COCCIDIOIDOMICOSIS --524 763 200 633 1147 1186 PARACOCCIDIOIDOMICOSIS --------------- --- --- --- NÚMERO DE CASOS DE MICOSIS SISTÉMICAS SEGÚN PUBLICACIONES EN REVISTAS Y MEMORIAS DE CONGRESOS AÑO 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 HISTOPLASMOSIS COCCIDIOIDOMICOSIS PARACOCCIDIOIDOMICOSIS 159 4 15 1 2 14 73 13 10 7 1 6 36 31 62 22 1 7 56 5 --65 115 5 2009 2010 2011 1 --3 5 12 - HISTOPLASMOSIS AMERICANA Definición Es una infección sistémica, que afecta al hombre y otros mamíferos, adquirida por inhalación del hongo Histoplasma capsulatum. Su manifestación en personas inmunocompetentes suele ser asintomática, pero en personas inmunocomprometidas, puede cursar con cuadros parecidos a los de una neumonía, fiebre, dificultad respiratoria y aproximadamente, en el 20% de los pacientes se llega a producir choque séptico, falla renal, coagulopatía y muerte. Etiología La histoplasmosis americana es causada por la fase anamórfica (asexual) del hongo Histoplasma capsulatum var. capsulatum, denominado como dimórfico. La fase teleomórfica (sexual) es identificada como Ajellomyces capsulatus, dentro del filo Ascomycota. Epidemiología La histoplasmosis tiene una amplia distribución geográfica, estando presente en América, África y Asia. Histoplasma capsulatum. var. capsulatum se extiende en América desde el sur de Canadá a las regiones centrales de Argentina; H. capsulatum var. farciminosum afecta a equinos en África, Oriente Medio y Asia; y H. capsulatum var. duboisii es un patógeno humano estricto en África Ecuatorial. En este capítulo, sólo nos referiremos a la histoplasmosis americana causada por H. capsulatum var. capsulatum. La infección es adquirida a través de la inhalación de microconidios y/o trozos de micelio de H. capsulatum presentes en ambientes contaminados con excrementos de aves (estorninos, gallinas y palomas principalmente) y murciélagos, en consecuencia los pulmones son los órganos más frecuentemente afectados. La histoplasmosis en el humano, no tiene preferencia por sexo, edad o raza; sin embargo, se supone que la ocupación tiene un significado importante, por lo que las personas con oficio o profesión de granjeros, criadores de aves de corral, recolectores de guano, mineros, biólogos y espeleólogos entre otros, son más susceptibles a contraer la infección. Para estimar si un individuo a estado en contacto con H. capsulatum, o para pronosticar la evolución de la enfermedad, la prueba cutánea o 6 intradermorreacción con histoplasmina (extracto acuoso del cultivo de H. capsulatum) resulta una herramienta muy útil. FUENTES: 7 Dirección General de Estadística, Informática y Evaluación. Informes Epidemiológicos de Morbilidad de 1988 a 1994. Secretaría de Salud. 8 Patogenia FUENTES: Chanussot C, et al., DermatologíaCmQ. 2011;9:27-8 Ridaura-Sanz C, et al., Acta Pediatr Mex. 2007;28:270-77 Mustieles C. et al., Med Int Mex. 2006;22:462-4 Nandí-Lozano E, et al., Bol Med Hosp Infant Mex. 2006;63:47-54 Una vez inhalados los propágulos infecciosos (forma micelial) de H. capsulatum, son fagocitados por los macrófagos pulmonares dentro de los cuales se multiplican mediante gemación, produciendo levaduras (forma parsitaria). Generalmente los elementos fúngicos son destruidos en mayor o menor plazo y entonces la infección se detiene y es asintomática, pero en casos de pacientes con inmunidad celular deficiente, las levaduras se liberan del fagolisosoma pasan al citoplasma de la célula huésped en donde se multiplican libremente, infectan a otras células y de esa forma se diseminan por todo el organismo. La infección estimula la multiplicación de los macrófagos infectados, dando lugar a proliferaciones con necrosis e infiltración de tipo granulomatoso, muy frecuentes en pulmón, pero presentes también en ganglios, sistema digestivo, piel y sistema nervioso central. La enfermedad generalizada es mortal. Cuadro Clínico En más del 50% de las personas expuestas al hongo, la infección inicial es desapercibida o cursa con ligeros síntomas gripales. En la condición sintomática, en general los signos y síntomas en el paciente dependen del síndrome clínico presente: 9 TIPO CLÍNICO Histoplasmosis pulmonar aguda Histoplasmosis pulmonar crónica Histoplasmosis diseminada Otros síntomas SIGNOS Y SÍNTOMAS Fiebre Escalofríos Tos Dolor torácico al inspirar Tos Dificultad respiratoria Dolor torácico Sudoración Fiebres similares a las de la tuberculosis pulmonar Hemoptisis Fiebre Endocarditis y pericarditis Artralgias y artritis Mediastinitis Anemia Leucopenia Trombocitopenia Enfermedad de Addison Meningitis Ulceras bucales y esofágicas Uveítis y coroiditis Prostatitis Ulceras en genitales 10 11 12 13 Diagnóstico de laboratorio Muestras. Los productos patológicos por analizar dependerán de las manifestaciones clínicas que presente el paciente. Debido a que la micosis se manifiesta principal e inicialmente en sistema respiratorio, las muestras de esputo o líquido del producto de lavado o cepillado bronco-alveolar son los más solicitados. Si se sospecha de una diseminación, entonces podrá pedirse un análisis micológico de: punciones medulares, hepáticas o de ganglios linfáticos, líquido cefalorraquídeo, sangre, exudados de lesiones cutáneas, fragmentos de tejido de pulmón, hígado, bazo, piel o cualquier otro órgano afectado. Asimismo, para efectuar un diagnóstico serológico, se necesitará principalmente el suero del paciente, aunque la orina y los líquidos cefalorraquídeo y bronco-alveolar también pueden ser de utilidad. Examen directo. No recomendado debido a la dificultad para observar las estructuras parasitarias intracelulares en el producto analizado. Frotis. Efectuar el extendido o impronta de la muestra a analizar y teñir con las técnicas de Giemsa, Wright, P.A.S. o Grocott. Deberá buscarse al agente etiológico dentro de células del sistema fagocítico mononuclear e identificarse mediante el hallazgo de levaduras intracelulares de 2 a 5 μm de tamaño. Cultivo a 25-30°C. Todas las muestras mencionadas deberán, al menos, ser sembradas en el medio de agar Sabouraud con cicloheximida y cloranfenicol (Mycosel® o Mycobiotic®). El uso de agar infusión cerebro-corazón (agar BHI) mejora el crecimiento del hongo. Características macroscópicas. Las colonias crecen lento y tienen apariencia de granular a algodonosa, de color blanco (aislados A o albinos) y algunos con la edad cambian a marrón claro (beige) (aislados B o brown). Por el reverso, las colonias son de color amarillo o amarillo-anaranjado. Características microscópicas. Las hifas son septadas e hialinas. Pueden observarse hifas parecidas a conidióforos, las cuales emergen en ángulo recto respecto a la hifa parental. Se presentan macroconidios con pared gruesa, redondos, unicelulares, hialinos, de 8 a 14 μm de diámetro y frecuentemente con proyecciones en forma de dedos sobre su superficie (tubérculos). Asimismo, hay presencia de microconidios (aleurioconidios) unicelulares, de 1 a 6 μm, hialinos y redondos, con paredes lisas o arrugadas. Serología. Puede identificarse al antígeno polisacárido mediante ensayos radioactivos de fase sólida (RIA) y enzimáticos (ELISA), en muestras de orina y suero y con menor sensibilidad en líquido broncoalveolar y cefalorraquídeo. Por otra parte, para la identificación de anticuerpos en suero o líquido cefalorraquídeo, el reactivo diagnóstico estándar es la histoplasmina, cuyos principales 14 constituyentes son los exo-antígenos H y M producidos durante el crecimiento de H. capsulatum. Son frecuentemente utilizadas la reacción de fijación del complemento o la doble inmunodifusión y con menor uso pero mayor sensibilidad y previo tratamiento de los antígenos H y M se usa el Western blot o inmunoblot. Pruebas especiales. Son utilizadas para corroborar la identidad de H. capsulatum, ya que la morfología de la fase micelial puede fácilmente confundirse con otros hongos. Cultivo a 37°C. Utilizado para revertir la fase micelial a la levaduriforme. Características macroscópicas. Un fragmento de la colonia de la fase micelial sospechosa, es sembrada principalmente en agar infusión-cerebro-corazón (BHI) adicionado con 5-10% de sangre. Lentamente crecen colonias cremosas, húmedas y levaduriformes. Características microscópicas. Se forman levaduras con gemaciones ovoides de cuello estrecho. Las levaduras de H. capsulatum var. capsulatum son pequeñas (2- 4 µm). Prueba de exoantígenos. Los antígenos se reproducen poniendo 3–5 ml de caldo Sabouraud o solución salina fisiológica adicionada con timerosal o formaldehido, sobre el cultivo filamentoso sospechoso. Se cultiva a temperatura ambiente 72 h, al término de las cuales se recuperan 0.5 ml de la fase acuosa para ser probados mediante inmunodifusión con antisueros específicos. Histopatología El cuadro histológico muestra a H. capsulatum dentro de histiocitos y células retículo-endoteliales. Las células huéspedes aumentan de tamaño pero sin evidencia de inflamación. Las levaduras intracelulares gemantes, miden aproximadamente 3 μm de diámetro. Las lesiones viejas muestran granulomas bien desarrollados con un área central caseiforme, semejando tuberculosis. Asimismo, en pulmón los nódulos muestran una imagen de anillos circunscritos formados por depósitos de calcio, en donde las levaduras de H. capsulatum se encuentran en el centro de esas lesiones, generalmente muertas. 15 16 17 18 19 20 21 22 23 24 25 COCCIDIOIDOMICOSIS Definición Es una infección sistémica, que afecta al hombre y otros mamíferos, adquirida por inhalación de los hongos pertenecientes al género Coccidioides. Su manifestación en personas inmunocompetentes suele ser asintomática, pero en personas inmunocomprometidas, puede cursar con cuadros parecidos a los de una neumonía, fiebre, dificultad respiratoria y aproximadamente, en el 20% de los pacientes forman lesiones granulomatosas en pulmón con posterior diseminación a otros órganos y sistemas, a partir de las cuales la infección generalmente es mortal. Etiología La coccidioidomicosis es causada por la fase anamórfica (asexual) de los hongos Coccidioides posadasii y C. immitis, denominados como dimórficos. La fase teleomórfica (sexual) es desconocida pero se deduce que pertenece al orden Onygenales dentro del filo Ascomycota. Epidemiología La micosis es característica de zonas áridas y semiáridas de las zonas endémicas (California, Arizona y Texas en USA, los estados del norte de los Estados Unidos Mexicanos y Argentina principalmente). En general el hongo se encuentra en el suelo de esas zonas a 20-25 cm de la superficie, en la época de lluvias, se estimula el crecimiento micelial y en cuanto el ambiente nuevamente es seco, los suelos se agrietan y las esporas son diseminadas por el viento. El humano adquiere la infección por vía aérea al inhalar los artroconidios, partículas infectantes de los hongos Coccidioides posadasii o C. immitis, en consecuencia los pulmones son los órganos más frecuentemente afectados. La coccidioidomicosis en el humano, no tiene preferencia por sexo, edad o raza; sin embargo, se supone que las actividades relacionadas con los suelos de áreas áridas tiene un significado importante, por lo que las personas con ocupación de excavador, antropólogo, campesino, topógrafo e inclusive personas que practican deportes a todo terreno en zonas desérticas, son más susceptibles a contraer la infección. Para estimar si un individuo a estado en contacto con Coccidioides spp., o para pronosticar la evolución de la enfermedad, la prueba cutánea o intradermorreacción con coccidioidina (extracto acuoso del cultivo de Coccidioides spp) resulta una herramienta muy útil. 26 FUENTES: Dirección General de Estadística, Informática y Evaluación. Informes Epidemiológicos de Morbilidad de 1989 a 1994. Secretaría de Salud. 27 FUENTES: Lara FS y Bonifaz A. Dermatologia Rev Mex. 2011; 55:140-151 Vázquez-Lamadrid J, et al., Gac Med Mex. 2011;147:169-71 Silva-Hernández AG, et al., Rev Med Inst Mex Seguro Soc. 2010;48:447-52 Arriaga-Aguilar J y Vázquez-Gálvez A. Rev Mex Urol.2010;70:399-401 Contreras-Soto J, et al., Bol Clin Hosp Infant Edo Son. 2008;25:110-14 28 Patogenia Con una inmunidad celular eficaz, una vez que los artroconidios de Coccidioides spp., se depositan en los alveolos pulmonares, son ingeridos por los macrófagos y eliminados; sin embargo si la inmunidad celular es deficiente, en el tejido pulmonar los artroconidios se hidratan y aumentan isotrópicamente de tamaño mientras simultáneamente en su interior, el citoplasma y el núcleo sufren una replicación masiva (endoesporulación) hasta formar una estructura redonda de 60 μm, llena de aproximadamente 300 endosporas que a su vez comienzan a crecer isotrópicamente y que se liberan al hacer estallar a la esférula madre. Cada endospora puede formar nuevas esférulas y colonizar otros tejidos por contigüidad, vía linfohemática. Si la inmunidad celular no es eficaz, la evolución es granulomatosa y en algunos casos puede quedar latente la infección, mientras en otros la enfermedad progresa, extendiéndose por pulmón y a otros tejidos, especialmente al meníngeo, óseo, subcutáneo y cutáneo, formas progresivas que tienden a ser mortales. Cuadro Clínico En más del 50% de las personas que tienen contacto con el hongo, la infección inicial puede ser inadvertida o cursar con ligeros síntomas gripales. En el caso de coccidioidomicosis sintomática, los signos y síntomas en el paciente dependen del síndrome clínico presente: 29 Tipo clínico Signos y síntomas Fiebre Escalofríos Tos Coccidioidomicosis pulmonar aguda Dolor torácico al inspirar Fatiga Manifestaciones cutáneas como rash con pequeñas pápulas o eritemas nodoso o multiforme. Tos Disnea persistente Dolor torácico Coccidioidomicosis pulmonar Sudoración crónica Fiebre intermitente Hemoptisis Pérdida de peso Fiebres Dolor de cabeza Rigidez en el cuello Coccidioidomicosis diseminada Hidrocefalia Meningitis Osteomielitis Sinovitis y derrames en articulaciones Lesiones cutáneas: úlceras, nódulos con tendencia a la supuración Otros Aborto en mujeres embarazadas 30 31 32 33 34 35 36 37 Diagnóstico de laboratorio Muestras. Los productos patológicos por analizar dependerán de las manifestaciones clínicas que presente el paciente. Debido a que la micosis se manifiesta principal e inicialmente en sistema respiratorio, las muestras de esputo o líquido del producto de lavado o cepillado bronco-alveolar son los más solicitados. Si se sospecha de una diseminación, entonces podrá pedirse un análisis micológico de: escamas de nódulos, exudados de lesiones cutáneas, pus, líquidos cefalorraquídeo y sinovial, fragmentos de tejido de pulmón, hígado, bazo, piel o cualquier otro órgano afectado e inclusive fragmentos de sondas y catéteres permanentes en el paciente. Para efectuar un diagnóstico serológico podrá utilizarse el suero de la persona. Examen directo. En caso de esputo, podrá agregarse KOH al 15% para aclararlo. Todas las muestras podrán observarse directamente al microscopio y la identificación de Coccidioides spp., se hará por el enfoque de esférulas (20-60 μm) redondas, de pared gruesa con endosporas, estructuras que por su tamaño facilitan su caracterización. Podrá agregarse lugol, azul de algodón ó inclusive blanco de calcoflúor (reactivo fluorescente) a la preparación, para evidenciar las estructuras parasitarias. Frotis. Debido a la facilidad de diagnosticar la micosis mediante el examen directo, el frotis generalmente no se efectúa. En caso de utilizarlo se deberán fijar, al calor o con metanol, el extendido o impronta de la muestra a analizar y teñir con Giemsa, P.A.S. o ténicas de tinción argéntica (Gomori/Grocott/plata metenamina), con las cuales se observarán esférulas con endosporas o endosporas (2-5 μm de diámetro) libres en los tejidos o entre las células del producto examinado. Esa imagen es patognomónica de la enfermedad. Cultivo a 25-30°C. Todas las muestras mencionadas deberán, al menos, ser sembradas en el medio de agar Sabouraud con cicloheximida y cloranfenicol (Mycosel® o Mycobiotic®). Ambas especies de Coccidioides presentan crecimiento rápido. Características macroscópicas. Las colonias jóvenes se muestran glabras, brillantes, grises y húmedas. Con la edad se transforman en blancas aterciopeladas, algodonosas y lanosas, que al madurar dan enormes cantidades de artroconidios infecciosos. En ocasiones pueden observarse hirsurtos (agrupaciones en pico formadas por filamentos largos). Características microscópicas. Las hifas son septadas e hialinas y el micelio forma artroconidios en células alternas. Los artroconidios libres presentan forma de barril, de 3 x 6 μm y pared gruesa, en ocasiones pueden observarse los faldones que representan las reminiscencias de las células adyacentes que les dieron origen. 38 Serología. La identificación de anticuerpos es frecuentemente efectuada en suero. La prueba de precipitación en tubo capilar, es utilizada para identificar IgM sólo durante las primeras tres semanas post-infección. Los anticuerpos IgG, son identificados por pruebas como la reacción de fijación del complemento, ensayos enzimáticos y doble inmunodifusión. Pruebas especiales. Son utilizadas para corroborar la identidad de Coccidioides spp., ya que la morfología de la fase micelial puede fácilmente confundirse con otros hongos. Cultivo a 37°C. Utilizado para al revertir la fase infectante (micelial) a la parasitaria (esférulas). Características macroscópicas. Un fragmento de la colonia de la fase micelial sospechosa, es sembrada en el medio líquido de Converse y en presencia de CO2, en el cual lentamente crecen colonias cremosas que se depositan en el fondo del tubo de cultivo. Características microscópicas. Se forman esférulas redondas y de pared gruesa, con tamaños heterogéneos y con diferente desarrollo de maduración, pudiéndose observar endosporas en su interior. Prueba de exoantígenos. Los antígenos se reproducen poniendo sobre el cultivo filamentoso sospechoso, de 3–5 ml de caldo Sabouraud o solución salina fisiológica adicionada con timerosal o formaldehido; se cultiva a temperatura ambiente 72 h, al término de las cuales se recuperan 0.5 ml de la fase acuosa para ser probados mediante inmunodifusión con antisueros específicos. Histopatología Se muestra una imagen de granulomas extensos, ricos en macrófagos, polimorfonucleares y linfocitos, con poca tendencia a la fibrosis y a la caseificación, envolviendo esférulas en diversos estadios de madurez y endosporas libres o fagocitadas. 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 PARACOCCIDIOIDOMICOSIS Definición Micosis profunda, sistémica y crónica adquirida por la inhalación del hongo Paracoccidioides brasiliencis. Su manifestación en personas inmuoncompetentes suele ser asintomática, pero en personas inmunocomprometidas es caracterizada por la presencia de lesiones granulomatosas, principalmente en pulmón (síndrome neumónico) con tendencia a la diseminación a tejido muco-cutáneo, progresando a formas clínicas graves que terminan atentando contra la vida del paciente. Etiología La paracoccidioidomicosis es causada por la fase anamórfica (asexual) del hongo dimórfico Paracoccidioides brasiliensis. Los estudios de concordancia genética han identificado cuatro clados (Pb01, S1, PS2 y PS3) cada uno de los cuales puede ser considerado como una especie filogenética diferente, aún no se ha llegado a un consenso entre los especialistas, que definan formalmente la descripción de esas nuevas especies. La fase teleomórfica (sexual) es desconocida, pero se ubica dentro del filo Ascomycota. Epidemiología La paracoccidioidomicosis tiene una amplia distribución geográfica dentro de América latina. La infección es adquirida a través de la inhalación de aleurioconidios (microconidios) y/o trozos de micelio de P. brasiliensis. Su hábitat natural es desconocido, pero ocasionalmente ha podido aislarse de suelos de ambientes de clima tropical y subtropical, muy asociados con cultivos de café y caña de azúcar. Los huéspedes reconocidos de la enfermedad son el humano y el armadillo de “9 bandas” (Dasypus novemcinctus). La paracoccidioidomicosis en el humano, tiene preferencia por el sexo masculino en una notable proporción de 15:1, aparentemente debida a la presencia de estrógenos femeninos que impiden el dimorfismo parasitario. No hay preferencia por edad o raza; sin embargo, se supone que la ocupación tiene un significado importante, por lo que los trabajadores agrícolas desnutridos entre 30 a 60 años, son los más susceptibles a contraer la infección. La mortalidad puede llegar a un 25% en casos no tratados. Para estimar si un individuo a estado en contacto con P. brasiliensis o para pronosticar la evolución de la enfermedad, la prueba cutánea o intradermorreacción con paracoccidioidina (extracto acuoso del cultivo de P. brasiliensis) resulta una herramienta muy útil. 64 FUENTES: Padilla-Desgarennes MC, et al., Dermatología Rev Mex 2009;53:7-11 López-Martínez R. XVII Congreso Iberolatinoamericano de Dermatología. Quito, Ecuador. Octubre 8-11, 2008 65 Patogenia Los pulmones son los sitios de infección primaria después de inhalar los conidios y fragmentos miceliales del hongo. Estos son capturadas por los macrófagos pulmonares quienes eficientemente eliminan al parásito; sin embargo, si la respuesta inmune es deficiente, el hongo inhalado se convierte a levaduras multigemantes que destruyen el tejido pulmonar y se extienden por vía hemática a otros órganos con especial predilección por la mucosa y la piel, que junto con el sistema linfático y las glándulas suprarrenales, son los tejidos más afectados. Asimismo se considera que en la primoinfección pulmonar asintomática, se generan granulomas, dentro de los cuales las levaduras pueden permanecer inactivas por años o progresar a enfermedad si hay reactivación del foco endógeno latente. La alta frecuencia de lesiones bucofaríngeas podría ser explicada por ser ésta una zona rica en tejidos linfoides y músculos estriados, donde los hongos encuentran lugar propicio para su proliferación. Cuadro Clínico En más del 90% de las personas expuestas al hongo, la infección inicial es desapercibida o cursa con ligeros síntomas gripales. En la condición sintomática, en general los signos y síntomas en el paciente dependen del síndrome clínico presente: 66 Tipo clínico Paracoccidioidomicosis pulmonar aguda Paracoccidioidomicosis pulmonar crónica Coccidioidomicosis diseminada Otros Signos y síntomas Fiebre Escalofríos Tos Disnea Infiltrados pulmonares Tos con esputo purulento y hemorrágico Insuficiencia respiratoria Dolor torácico Sudoración Fiebre intermitente Fiebres Dolor de cabeza Lesiones cutáneas Úlceras bucales y mucosa faríngea con perforación del paladar Puede afectar bazo, tracto digestivo, hígado, huesos, sistema nervioso central y tracto genitourinario masculino. 67 68 69 70 71 72 Diagnóstico de laboratorio Muestras. Los productos patológicos por analizar dependerán de las manifestaciones clínicas que presente el paciente. Debido a que la micosis se inicia en sistema respiratorio, las muestras de esputo o líquido del producto de lavado o cepillado bronco-alveolar son los más solicitados. Si se sospecha de una diseminación, entonces podrá pedirse un análisis micológico de: escamas y exudados de lesiones cutáneas, pus, fragmentos de tejido de pulmón, hígado, bazo, piel o cualquier otro órgano afectado. Para efectuar un diagnóstico serológico podrá utilizarse el suero de la persona. Examen directo. En caso de esputo, podrá agregarse KOH al 15% para aclararlo. Todas las muestras podrán observarse directamente al microscopio y la identificación de Paracoccidioides spp., se hará por el enfoque de levaduras (20-50 μm) redondas, de pared gruesa, gemando simultáneamente en diferentes puntos (2-10 μm de diámetro). Podrá agregarse lugol o cualquier otro colorante primario, para evidenciar las estructuras parasitarias. Frotis. Se deberán fijar, al calor o con metanol, el extendido o impronta de la muestra a analizar y teñir con Giemsa, P.A.S. o ténicas de tinción argéntica (Gomori/Grocott/plata metenamina), con las cuales se observarán levaduras multigemantes en los tejidos o entre las células del producto examinado. Esa imagen es patognomónica de la enfermedad. Cultivo a 25-30°C. Todas las muestras mencionadas deberán, al menos, ser sembradas en el medio de agar Sabouraud con cicloheximida y cloranfenicol (Mycosel® o Mycobiotic®). Paracoccidioides brasiliensis es poco esporulado por lo que presenta crecimiento muy lento (en dos semanas de cultivo la colonia alcanza 1 cm de diámetro). Para una producción elevada de conidios se recomienda la siembra en agar harina de maíz o cualquier otro medio pobre en nutrientes. Características macroscópicas. Las colonias van de glabras a aterciopeladas, de crecimiento lento, de color blanco, amarillo o marrón en la superficie y de amarilloocre a marrón por el reverso. Características microscópicas. Las colonias están constituidas por micelios aéreos delgados, ramificados y provistos de septos; solamente se observan clamidoconidios laterales e intercalares y a veces, se nota también la presencia de aleurioconidios (microconidios) ovales, unicelulares. Serología. El principal componente antigénico de P. brasiliensis es una glicoproteína de 43 Kd llamada GP43. Los anticuerpos (anti-gp43) son identificados en el suero del paciente, mediante técnicas como la doble inmunodifusión en gel y ELISA. 73 Cultivo a 37°C. Es una prueba especial utilizada para corroborar la identidad de Paracoccidioides brasiliensis, ya que la morfología de la fase micelial puede fácilmente confundirse con otros hongos. Se efectúa para revertir la fase infectante (micelial) a la parasitaria (levaduras multigemantes). Características macroscópicas. A partir de un fragmento de la colonia de la fase micelial sospechosa, en medios nutritivos como BHI líquido o sólido, agar sangre o agar chocolate, se desarrollarán colonias levaduriformes, blancas, poco elevadas, de 5 a 15 mm de diámetro, bordes continuos, de textura cremosa y apariencia lisa, arrugada o plegada, en aproximadamente dos semanas de incubación. Características microscópicas. Presencia de levaduras redondas de pared gruesa con gemaciones múltiples, las cuales se unen a la célula madre mediante un “cuello” estrecho. Asimismo, pueden observarse agrupaciones de levaduras formando pequeñas cadenas, antes de separarse de la célula madre. Histopatología Se muestra una imagen de áreas de inflamación granulomatosa conteniendo un área central caseiforme mezclada con abscesos piógenos. Muchas células gigantes están presentes en el granuloma, el cual contiene a los microorganismos. Se observa al hongo como una levadura de 10 a 14 mm de diámetro rodeada de múltiples gemaciones o blastoconidios de diferentes tamaños, unidos a la célula madre mediante cuellos estrechos. 74 75 ) 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 AGRADECIMIENTOS El material fotográfico fue gentilmente donado por las siguientes personas, mencionadas en orden alfabético: Biól. Elva Bazán Mora. Técnica Académica del Laboratorio de Micología Médica del Departamento de Microbiología y Parasitología. Facultad de Medicina, UNAM. M. en C. Alexandro Bonifaz. Jefe del Laboratorio de Micología Médica del Hospital General de México (OD), Secretaría de Salud. Dra. Cristina Canteros. Departamento de Micología. Instituto Nacional de Enfermedades Infecciosas. Administración Nacional de Laboratorios e Institutos de Salud “Dr. Carlos G. Malbrán”. Buenos Aires, Argentina. Q.B.P. Cudberto Contreras Pérez. Responsable del Laboratorio de Micología Médica del Instituto Nacional de Referencia Epidemiológica, Secretaría de Salud. M. C. Especialista en Micología Ramón Fernández. Sección de Micología del Hospital General Dr. Manuel Gea González, Secretaría de Salud. Q.B.P. Bertha Muñoz Hernández. Laboratorio de Micología, Departamento de Investigación del Instituto Nacional de Enfermedades Respiratorias, Secretaría de Salud. Biól. Francisco Pasos. Técnico Académico del Departamento de Biología Celular, Facultad de Medicina, UNAM. Dr. Roberto Suárez. Laboratorio de Microscopía, Departamento de Biología Celular, Facultad de Medicina, Universidad Nacional Autónoma de México. Biól. Armando Zepeda Rodríguez. Coordinador del Laboratorio de Microscopía Electrónica. Departamento de Biología Celular y Tisular. Facultad de Medicina, UNAM. Todas las fotos y figuras presentadas en el presente documento son inéditas y los respectivos autores, están de acuerdo en que el material fotográfico pase a ser propiedad de la Facultad de Medicina, UNAM.