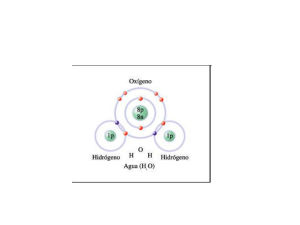
n RT - McGraw-Hill Education
Anuncio

es ill. -h ra w cg .m w w w es w -h ill. w w w .m cg ra QUÍMICA Pere Castells i Esqué Núria Riba i Soldevila Francesc Andreu i Mateu 2 Revisió tècnica Claudi Mans Teixidó Teo Prat Camós BARCELONA - MADRID - BOGOTÀ - BUENOS AIRES - CARACAS - GUATEMALA MÈXIC - NOVA YORK - PANAMÀ - SAN JUAN - SANTIAGO - SÃO PAULO AUCKLAND - HAMBURG - LONDRES - MILÀ - MONT-REAL - NOVA DELHI - PARÍS SAN FRANCISCO - SYDNEY - SINGAPUR - SAINT LOUIS - TÒQUIO - TORONTO 00_quimica_2batx_001-008.indd 1 11/03/13 13:46 cg ra w -h ill. es Totes les activitats d’aquest llibre s’han de resoldre en un quadern a part. és permesa la reproducció total o parcial d’aquest llibre, ni el seu tractament electròNo nic, ni la transmissió de cap forma o per qualsevol mitjà, ja sigui electrònic, mecànic, per fotocòpia, per registre o d’altres mitjans, sense el permís previ i per escrit dels titulars del Copyright. Dirigeixi’s a CEDRO (Centro Español de Derechos Reprográficos) si necessita fotocopiar o escanejar fragments d’aquesta obra (www.conlicencia.com). w w w .m Química 2 ? Batxillerat Drets reservats © 2013, respecte a la segona edició en català per: McGraw-Hill/Interamericana de España, S.L. Edificio Valrealty, 1.a planta Basauri, 17 28023 Aravaca (Madrid) ISBN: 978-84-481-8463-6 Dipòsit legal: M-7879-2013 Editor de projecte: Conrad Agustí Editora: Núria Egido Disseny de coberta: rload.es Disseny d’interiors: QuinTeam! Il.lustracions: Albert Badia i Campos, Lourdes Sogas, Ventall, S. C. P., Firofoto, Prisma, Melba, Pere Castells, AGE Fotostock, Pere Lluís León, BIOPUNT, Rudi Hickl i fons McGraw-Hill Composició: Baber Imprès a: IMPRÈS A ESPANYA - PRINTED IN SPAIN 00_quimica_2batx_001-008.indd 2 11/03/13 13:46 Presentació Aquest llibre va adreçat als estudiants de segon de batxillerat de la modalitat de ciències i tecnologia. L’objectiu general del nostre projecte és aconseguir que l’alumne assoleixi uns coneixements químics i que, alhora, els sàpiga relacionar amb la societat que l’envolta. Per aconseguir aquesta fita, hem plantejat el desenvolupament curricular d’acord amb tres premisses bàsiques: j Estudiar la química des del punt de vista macroscòpic, és a dir, dels fenòmens obser- vables; i al mateix temps continuar amb l’estudi del món atomicomolecular, és a dir, de tot allò relacionat amb els àtoms i les molècules. j Relacionar la química amb la societat, el medi ambient, la indústria i amb d’altres w -h ill. es ciències, per despertar en l’alumne l’interès per conèixer i entendre fets que li són propers sense perdre el rigor científic. j Sistematitzar aspectes concrets de la química, tot proposant mètodes generals per resoldre els problemes i les qüestions correctament. ra Aquest segon llibre s’ha estructurat en onze unitats, que podem agrupar en quatre blocs diferents segons els temes tractats: cg Estudi de la matèria .m — Unitat 1. Classificació de la matèria. Les substàncies pures. — Unitat 3. Cinètica química. — Unitat 4. Equilibri químic. w — Unitat 2. Termodinàmica química. w w Estudi de les característiques de les reaccions químiques Estudi dels diferents tipus de reaccions — Unitat 5. Reaccions de transferència de protons. — Unitat 6. De la hidròlisi a la neutralització. — Unitat 7. Equilibris iònics heterogenis. — Unitat 8. Reaccions de transferència d’electrons. — Unitat 9. Aplicacions de les reaccions redox. Estudi del món atomicomolecular — Unitat 10. Propietats periòdiques dels elements. — Unitat 11. Quantificació de l’energia. Anàlisi espectroscòpica. Enllaç químic. Ens sentirem plenament satisfets si el llibre que teniu a les mans serveix per fer de la química una matèria més propera que ens ajudi a entendre el món que ens envolta d’una manera senzilla i interessant. Agraïm de tot cor l’ajuda, el suport i la confiança que ens ha donat l’editora en aquest projecte. Els autors 00_quimica_2batx_001-008.indd 3 11/03/13 13:46 COM S’UTILITZA AQUEST LLIBRE UNITAT 01 j Calcular l’energia necessària per canviar d’estat una substància pura. j Deduir l’equació dels gasos ideals a partir de consi- w -h ill. deracions teòriques. j Esbrinar com varia la difusió dels gasos en funció de la seva massa atòmica. .m cg ra En aquesta unitat aprendràs a: j Identificar els elements que formen els compostos. j Representar gràficament els diferents estats en què es pot trobar qualsevol substància pura segons la pressió i la temperatura, mitjançant diagrames de fases. j Aplicar la liofilització a alguns processos. j Eliminar productes industrials nocius. es CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES w w w Presentaciódelaunitat:fotografiaiobjectiusprincipalsquel’alumnehad’assolirenacabaraquestaunitat. CENTRE D’ENSENYAMENT ONLINE Material interactiu ideat com a suport per a l’estudiant. S’hi pot trobar informacióreferentalamatèriatantperreforçarcomperampliarconeixementsirecursosútilsperreforçaroampliarelmaterialquejaofereix elllibre,comaraungranventalld’activitats,toteslesil.lustracionsdel llibre,enllaçosallocsweb,bibliografiaiunglossari. 00_quimica_2batx_001-008.indd 4 11/03/13 13:46 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES jPunt crític d’un fluid. Imaginemunrecipienttancatambunlíquidielseuvapor.Amesu- raquepugemlatemperatura,augmentaladensitatilaconcentraciódelgas,alhoraque baixaladensitatdellíquid.Sianemescalfantarribaunmomentapartirdelqualnoés perceptibleladiferènciaentrelíquidigas.Éselpunt crític. En els sòlids, les partícules —molècules, àtoms o ions, segons el tipus de sòlid— no es poden moure, només vibren al voltant d’una posició fixa. Això és així perquè la seva energia tèrmica no pot vèncer les forces d’atracció entre elles (fig. 1.5). Quan escalfem un sòlid es transmet energia a les seves partícules, la qual les fa vibrar més ràpidament, de manera que se separen una mica més les unes de les altres i augmenta una mica el volum del sòlid. Quasi tots els cossos sòlids es dilaten en escalfar-los. Quan s’arriba a la temperatura de fusió, Tf , l’agitació de les partícules és prou gran perquè s’allunyin de les posicions fixes al voltant de les quals vibren, i el cos fon. L’ordre cristal.lí del sòlid es trenca i les partícules es mouen i xoquen les unes amb les altres. Si el sòlid és amorf, o no és una substància pura, la temperatura de fusió, Tf, no es manté constant; és a dir, no hi ha un únic punt de fusió, sinó que es mou en un marge de valors. La quantitat de calor necessària, a pressió atmosfèrica, perquè la unitat de massa passi de l’estat sòlid a l’estat líquid s’anomena calor latent de fusió, lf. La calor latent de fusió, lf, té el mateix valor que la calor latent de solidificació, ls, que correspon al procés de solidificació o pas d’estat líquid a estat sòlid. jB. Líquid-gas En els líquids, les partícules es poden moure perquè tenen una energia cinètica més gran que en el sòlid. Quan els líquids s’evaporen, algunes de les partícules amb energia més alta aconsegueixen separar-se de les del seu voltant i passar a vapor. Per fer-ho han d’agafar energia de l’entorn, i per això la temperatura del líquid baixa. Aquest fenomen el podem observar fàcilment si ens posem acetona al palmell de la mà i deixem que s’evapori: la mà es refreda perquè la calor corporal ha servit per evaporar l’acetona. El trànsit de líquid a gas es pot realitzar per evaporació o per ebullició. En tots dos casos s’esdevé una vaporització. j L’evaporació és un fenomen superficial que es produeix a qualsevol temperatura. Només unes quantes partícules properes a la interfase líquid-gas es poden escapar. j En l’ebullició tot el líquid assoleix una temperatura suficient perquè les partícules puguin Fig. 1.6. Diagrama dels canvis d’estat. La calor de vaporització ens dóna un valor aproximat de les forces d’enllaç entre les partícules d’un líquid. En passar de sòlid a líquid la substància només es desordena una mica, i es mantenen en bona part els enllaços entre partícules. En canvi, en passar de líquid a gas aquests enllaços s’han de trencar tots. Per això la calor de vaporització és molt més gran que la calor de fusió. passar a fase gas o vapor. Si la substància és pura, la temperatura d’ebullició, Te, es manté constant. La calor necessària, a pressió atmosfèrica, perquè la unitat de massa d’una substància es vaporitzi, s’anomena calor latent de vaporització, lv. La calor latent de vaporització és igual a la calor latent de condensació, lc, que correspon al procés de condensació o pas d’estat gasós o vapor a estat líquid. j Punt crític. Caracterització del procés de liquació d’un gas. En comprimir un gas, la pres- sió augmenta, les molècules s’atansen i s’atrauen una mica (per forces de Van der Waals) en estar més properes. Així és possible que el gas es condensi, i passi de l’estat gasós al líquid. Però perquè un gas esdevingui líquid cal que estigui per sota de la temperatura crítica. Aquesta temperatura és característica de cada compost o element. Alguns punts crítics són: H2O 647,1 K i 217,8 MPa; CO2 304,2 K i 7,8 MPa. Pel damunt de la temperatura crítica, és impossible liquar un gas per molt que el comprimim. En aquestes condicions aquests fluids s’anomenen fluids supercrítics. S’utilitzen industrialment com a solvents. 15 1> Classifica els materials següents com a elements, Líquid Sòlid punt triple D A observarem que l’envàs taronja de la bombona es glaça per la part de fora. A què és degut aquest efecte? mescles,substànciespures,compostos Gas E B C T Fig. 1.7. Punt crític. argent calç guix alcohol tinta llautó benzina estany bronze cristalldequars sucre cautxúnatural sabó aspirina sal Cadasòlidtéunapressiódevaporcaracterísticaaunatemperaturadeterminada.Perexemple,l’aiguasòlidaa0°Ctéunapressiódevaporde0,00603atm(4,58mmHg).Siescalfem aigua sòlida que estigui a una temperatura una mica inferior als 0 °C en un recipient que estiguiaunapressiópersotade0,00603atm—creadamitjançantelbuit—,l’aiguapassa directamentd’estatsòlidaestatgasós.Passaelmateixsielgelestàencontacteambunaire moltsec,semprequeelvapord’aiguasiguielquetindriasiestiguéssolenelmateixvolum, alapressióde0,00603atmomenys. pintura detergent diamant Lapressiódevapordelssòlids,comladelslíquids,creixamblatemperatura. 4> Observalafiguradelpunttripledel’aigua. 11> ElCO2sublimaatemperaturaambient.QuanelCO2sò- lidsublimaa760mmHg(pressióatmosfèrica),manté unatemperaturade195K(278°C).Elseupunttriple estrobaa5,11atmia256,4°C. a) Si volem fondre el CO2 sòlid, quina és la pressió mínima necessària perquè passi a l’estat líquid? 2> Quinprocésfapossiblequeelfetdeventar-serefres- b) Aquinatemperaturamínimahofarà?(Eldiagrama defasesdelCO2téunaformaanàlogaaldel’aigua; vegeulafigura1.13.) quilacara? 3> Tantlacondensaciócomlasolidificacióalliberencalor.Quinprocésalliberaméscalor?Perquè? p (mmHg) a) Etsemblaqueéspossiblequeesmantinguienestatlíquidaunapressióde2,5mmHg? Unaltreexemplecaracterísticdesublimacióéseldelgelsec,queésCO2sòlidqueesfaservir perrefrigeraraliments,elqualsublimasensefondreapressióatmosfèrica,perquèlapressió delCO2al’atmosferaésmésbaixaquelapressiódevapordelsòlid(fig.1.8). líquid b) Iaunapressióde6mmHg? 5> Éspossibleteòricamentteniraigualíquidaaunapressióinferiora0,00603atm(4,58mmHg)? La quantitat de calor necessària per sublimar la unitat de massa en estat sòlid fins a l’estat gasós a pressió atmosfèrica s’anomena calor latent de sublimació. Observeulafigura1.4.LescorbesrepresentenelsvalorssimultanisdepiTenelsqualsdues fasesd’aiguapodencoexistirenequilibri.Perexemple,l’aiguasòlidacoexisteixambl’aiguaen estatgasós(vapor)entotselsvalorsdepiTcorresponentsalalíniaOB.Anàlogament,enels valorsdepiTdelacorbaOCcoexisteixenelglaçil’aigualíquida.EnlescondicionsdepiT corresponentsalalíniaOAcoexisteixenl’aigualíquidail’aiguagasosa. EnelpuntO,anomenatpunt triple,podencoexistirlestres fases en equilibri.Elpunttriple del’aiguacorresponaunapressióde0,00603atmiaunatemperaturade0,01°C. LeszonesentrecorbescorresponenacondicionsdepiTenquènoméspotexistiraiguaen unasolafase. L’aiguaaunatemperaturad’1°Ciaunapressióde2mmHgestaràenformadegas.Caldrà aplicar-hiunapressióde8-10mmHgomésperliquar(condensar)l’aigua.Sil’aiguaestigués a250°Ci1mmHgdepressióestariaenfasegasperònoaconseguiríemlaliquaciópermolt quecomprimíssim,jaquenoentraríemenlazonalíquida.L’aiguaescongelariaipassariade gasasòliddirectament(sublimacióregressiva). mantinguienestatlíquidaunatemperaturainferior a0°C? b) L’aigua dels càntirs i sellons de material porós es mantéfrescasiescol.loquenenunlloconhihagi correntd’aire,semprequeestractid’airesec. 10> Sitenimgela20,5ºCihiapliquemunbuitinferiora 0,00603atm(4,58mmHg),quèpensesquepassarà? T (K) 216,4 lid,líquidigasósalhora? 13> Enlescondicionsdevidahabitual,quinaésaproxi- madamentlapressiódevapordelgelquanfon?(Observa detingudament el gràfic de la figura 1.4 del punttripledel’aigua.) 14> Un procediment per refrigerar l’aigua calenta en els processosindustrialsésmitjançantlestorresderefrigeració.Aquestestorresconsisteixenenunsrecintesperonbaixaaiguaiesfacircularsobrematerials sòlids apilats, de manera que formi una pel.lícula fina.Ensentitascendents’impulsauncorrentd’aire. A la part inferior es recull l’aigua que s’ha refre- dat.L’airequesurtperdalttéunaltcontingutd’aigua en forma de gas. Explica per què es refreda l’aigua líquida. ver-lad’esprémernitrinxar? 9> Perquèelbutàquehihaal’interiordelesbombones estroba principalmentenestat líquid iquan crema estàenestatgasós? 10> Si connectem a una bombona de butà un bufador pistolaapteperescalfarindustrialmentil’encenem, Activitats finals Reculld’exercicisiproblemesrelacionatsambels contingutsques’hantractatalaunitat. w w w .m Desenvolupamentdelamatèriaenquès’inclouen els continguts conceptuals i procedimentals, els exemples resolts i, al final de cada apartat, les activitatsd’aprenentatge. 195 Fig. 1.13. Diagrama de fases del CO2. 12> Éspossiblequelessubstànciesestrobinenestatsò- 8> Comextrauriesl’aiguadelsucd’unataronjasenseha- cg Tractament teòric de la matèria punt triple 760 qual pengen uns pesos grans, travessi una barra de glaçindustrialgruixudasensequelabarraestrenqui? Explicaperquè.(Vegeulafigura1.12.) Fig. 1.12 seves molècules i que el niló no en té cap, esbrina per què costa molt més eixugar el cotó mullat que elniló. 3880 7> Com es pot aconseguir que un filferro ben prim, del Fig. 1.8. El diòxid de carboni dins d’un extintor es troba en estat líquid i a una pressió elevada. A uns 25 °C està a unes 62 atm. En obrir-ne l’aixeta, el CO2 líquid es descomprimeix sobtadament, i en fer-ho necessita calor, que agafa majoritàriament d’ell mateix, refredant-se molt i sortint preferentment sòlid. Però a la pressió atmosfèrica el CO2 és gas, i per tant, aquell CO2 sòlid sublima de seguida. 9> Sabent que el cotó té moltíssims grups OH en les a) S’eixugalarobamulladatantsifaventcomsifa calor. gas sòlid 6> En quines condicions ha d’estar l’aigua perquè es ACTIVITATS 8> Investigaperquè: 25 Activitats finals (Fluid supercrític) punt crític jC. Sòlid-gas Elslíquidspursaunatemperaturadeterminadatenenunapressiódevaporcaracterística.En elssòlidstambéexisteixlapressiódevapor,sibéenunamagnitudquesolsermoltinferior. Si les partícules del cristall vibren prou enèrgicament, poden vèncer les forces cristal.lines decohesióquelesenllacenilespartículesperifèriquespodenarribarapassaral’estatgasós. Enaquestcas,diemqueelsòlidsublima. 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES p F es jA. Sòlid-líquid Fig. 1.5. Partícules d’un sòlid vibrant a l’entorn de posicions fixes. 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES j1.4 Canvisd’estat w -h ill. 01 ra 14 10 PROPIETATS PERIÒDIQUES DELS ELEMENTS 281 Prepara la selectivitat bre atòmic 11) són dos elements que es troben en grupsallunyatsentresialataulaperiòdica(grups17 i1,respectivament). a) Calmésenergiaperarrencarunelectród’unàtom defluorgasósod’unàtomdesodigasós?Raoneu larespostaenfunciódelessevesestructureselectròniques. b) Totiquel’iófluoruril’iósoditenenelmateixnombred’electrons,quind’aquestsdosionstéelradi mésgran?Perquè? 2> [Curs 10-11] Dos elements tenen les configuracions electròniquessegüentsenl’estatfonamental:element X:1s2 2s2 2p2;elementY:1s2 2s2 2p4. La primera energia d’ionització d’un dels elements és 1310 kJ?mol 21, mentre que la de l’altre és 1090kJ?mol21. a) Quindelsdoselementstéunradiatòmicmésgran? b) Assigneuelsvalorsdelaprimeraenergiad’ionitzacióacadascundelselements,XiY. Justifiqueulesrespostes. 3> [Curs09-10]Lafigura10.23mostraelradiatòmicdels quaranta-cincprimerselementsdelataulaperiòdica: que s’utilitza en òptica per la seva transparència a la llumultraviolada.Apartirdelsegüentgràfic(fig.10.24): Li4(g) + F(g) + Li+(g) + ½ F2(g) 520 kJ 161 kJ 77 kJ –328 kJ Li+(g) + F–(g) Li(g) + ½ F2(g) –1047 kJ Li(s) + ½ F2(g) –617 kJ – LiF(s) Fig. 10.24. Diagrama d’entalpies del fluorur de liti. a) Indiqueuquinvalortenenl’energiad’ionitzaciódel litiil’afinitatelectrònicadelfluor.Definiuelconcepted’energiareticulard’unsòlidiòniciindiqueu quinvalortéperalfluorurdeliti. b) L’energia reticular del iodur de potassi (KI), serà més petita o més gran que la del fluorur de liti? Justifiqueu-hoapartirdelmodelelectrostàticdel sòlidiònic. Dades:Li:Z53;F:Z59;K:Z519;I:Z553 5> [Curs10-11]Percalcularl’energiareticulardelclorur desodi(2787kJ?mol21)calconèixerlesdadestermodinàmiquesqueapareixenenlataulasegüent: Radi atòmic (pm) Z = 19 Magnituds termodinàmiques 200 Z=3 Z = 33 100 Z=9 05 107 Primera energia d’ionització del Na 496 Entalpia de formació del Cl(g) 2349 Cal intentar reutilitzar les dissolucions per a altres pràctiques; si no és possible, es poden llançar per la pica diluint-les prèviament amb aigua abundant. Els àcids i les bases cal neutralitzar-los abans d’eliminarlos per la pica. 30 Nombre atòmic Z Entalpia de formació del NaCl(s) 2411 a) Justifiqueu,apartirdel’estructuraelectrònicadels àtoms, la variació del radi atòmic al llarg del se- gonperíodedelataulaperiòdica(nombresatòmics del3al9). b) Compareuelradiatòmicdelliti(Z53)ieldelpotassi(Z519)ijustifiqueuaquestsvalorsapartir del’estructuraelectrònicadelsdosàtoms. Producte Color paper indicador — Tubs d’assaig — Dissolució de blau de bromotimol — Comptagotes — Dissolució de taronja de metil Caràcter àcid, bàsic o neutre — Na2CO3 — Vareta — Aigua destil.lada — Al2(SO4)3 Taula 5.19 — KBr — Dissolució de HCl 1 M — H3PO4(aq) concentrat — Paper indicador de pH — KI — Dissolució de fenolftaleïna — Dissolució de NH4Cl 1 M — Dissolució de roig de metil c) Caràcteràciddelsàcidsbromhídriciiodhídric j En un tub d’assaig aboqueu una petita quantitat de KBr i 2 cm3 de H3PO4(aq) concen- trat i escalfeu-ho. Comproveu el caràcter àcid dels vapors emesos mitjançant paper indicador, prèviament mullat amb aigua destil.lada. j Repetiu el mateix procés, però ara amb una petita quantitat de KI. Procediment i anàlisi de resultats d)Caràcterbàsicdel’amoníac j En un tub d’assaig barregeu 2 cm3 de dissolució de NH4Cl 1 M i 2 cm3 de dissolució a) Indicadors j Poseu dotze tubs d’assaig plens fins a la meitat d’aigua destil.lada en una reixeta. i compareu-lo amb el dels altres indicadors. j Afegiu 1 cm3 de NaOH(aq) 1 M en el tercer tub de cada indicador. Observeu-ne el color 1 M de NaOH. j Escalfeu-ho lleugerament i oloreu (no directament) els vapors que se’n desprenen. Quin producte us recorda? Comproveu el caràcter bàsic dels vapors mitjançant paper indicador humitejat amb aigua destil.lada. j Mulleu una vareta amb HCl(aq) concentrat i aproximeu-la a l’obertura del tub d’assaig de què es desprenen els vapors de NH3 fins a observar un fum de color blanc que correspon a la formació de clorur d’amoni d’acord amb l’equació: NH3(g) 1 HCl(aq) f NH4Cl(s) i compareu-lo amb el dels altres. Comproveu el caràcter àcid d’aquest fum blanc amb paper indicador humitejat. Completeu la taula següent: Indicador Tub 1 Fenolftaleïna Roig de metil Blau de bromotimol Taronja de metil Fig. 5.9. Fenolftaleïna. pH aproximat Material j Aboqueu 1 cm3 de HCl(aq) 1 M en el segon tub de cada indicador. Observeu-ne el color b) Expliqueuraonadament,apartirdelmodelelectrostàticdelsòlidiònic,sil’energiareticulardelbromurdepotassiseràmésgranoméspetitaquela delclorurdesodi. Dades:Nombresatòmics(Z):Z (Na)511;Z (Cl)517; Z (K)519;Z (Br)535. Taula 5.18 Tub 2 (HCl(aq)) Tub 3 (NaOH(aq)) Fig. 5.10. Taronja de metil. e) Hidròlisidesals j Afegiu a dos tubs d’assaig una petita quantitat de Na2CO3 i aboqueu-hi 5 cm3 d’aigua destil.lada. j Afegiu una petita quantitat de Al2(SO4)3, juntament amb 5 cm3 d’aigua destil.lada, en altres dos tubs d’assaigs. j Afegiu 2 gotes de fenolftaleïna en un dels tubs de cada parell i, en els altres dos, 2 gotes de roig de metil. j Raoneu el caràcter àcid o bàsic d’aquestes substàncies. Prepara la selectivitat Pràctiques Alfinaldecadaunitatesproposenunseguitd’activitats perquè l’alumnat prepari les proves de selectivitatenrelacióalsconeixementsadquirits. Pràctiquesfàcilsiassequiblesperferallaboratori del’institutoalacuinadecasa.Complementen experimentalmentlateoriaexplicadaalaunitat. 00_quimica_2batx_001-008.indd 5 157 Conèixer indicadors i el caràcter àcid o bàsic de diverses substàncies. altres tubs; 2 gotes de blau de bromotimol en altres tres, i 2 gotes de taronja de metil als tres últims. Etiqueteu els tubs. Observeu-ne el color per a cada indicador. a) Expliqueuladiferènciaquehihaentreelsconceptes energia d’ionització i afinitat electrònica d’un element, i entre els conceptes energia reticular i entalpia de formaciód’uncompostiònic. 05 Esbrineu el pH de diversos productes quotidians mitjançant un paper indicador de pH. Completeu la taula següent: Objectiu j Afegiu 2 gotes de fenolftaleïna en tres dels tubs; 2 gotes de roig de metil en tres Taula 10.5. Dades termodinàmiques en c. e. i a 298 K. 10 Fig. 10.23. Radi atòmic en funció del nombre atòmic. Assajos d’equilibris àcid-base (al laboratori) — Dissolució de NaOH 1 M Gestió de residus 122 Afinitat electrònica del Cl REACCIONS DE TRANSFERÈNCIA DE PROTONS b)Caràcteràcidobàsicdesubstàncies Les pràctiques proposades es poden fer a casa o al laboratori del centre. Normes de seguretat S’ha d’anar amb compte en la utilització de l’hidròxid de sodi i dels àcids fosfòric i clorhídric, perquè són molt corrossius; cal posarse guants per manipularlos. Extremeu les precaucions pel perill d’ingesta de les dissolucions d’indicadors. Realitzeu aquesta pràctica a la vitrina de gasos. Valor (kJ?mol21) Entalpia de sublimació del Na(s) REACCIONS DE TRANSFERÈNCIA DE PROTONS Pràctiques 4> [Curs10-11]Elfluorurdeliti,LiF,ésuncompostiònic Entalpia (kJ) 1> [Curs09-10]Elfluor(nombreatòmic9)ielsodi(nom- 156 11/03/13 13:46 ÍndEX 6 Unitat 1. Classificació de la matèria. Les substàncies pures . . . . . . . . . . . . . . . . . . . 9 1.1 Les substàncies pures dins la classificació de la matèria . . . . . . . . . . . . . . . . . . . . . . . 10 1.2 Elements i compostos. Obtenció dels elements dels compostos . . . . . 11 1.3 Diagrama de fases d’una substància pura . . . . 13 1.4 Canvis d’estat . . . . . . . . . . . . . . . . . . . . . . . 14 1.5 Teoria cineticomolecular dels gasos . . . . . . . 16 1.6 Calor intercanviada en els canvis d’estat . . . . 20 1.7 Les activitats industrials i el medi ambient . . 21 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 25 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 28 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 Unitat 4. Equilibri químic . . . . . . . . . . . . . . . . 91 4.5 Grau de dissociació . . . . . . . . . . . . . . . . . . . 109 4.6 Factors que modifiquen l’equilibri . . . . . . . . . 112 4.7 Relació entre la constant d’equilibri i l’energia lliure de Gibbs . . . . . . . . . . . . . . . 117 4.8 L’equilibri químic i la indústria . . . . . . . . . . . 118 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 121 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 124 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 125 2.3 Calor i treball . . . . . . . . . . . . . . . . . . . . . . . 34 2.5 Relació entre l’energia interna i l’entalpia . . . 38 42 .m 2.6 Mesura de l’entalpia de reacció . . . . . . . . . . . 36 w w 2.7 Llei de Hess . . . . . . . . . . . . . . . . . . . . . . . . 46 w 2.8 Càlcul de les entalpies de reacció a partir de les energies d’enllaç . . . . . . . . . . 48 2.9 L’entropia . . . . . . . . . . . . . . . . . . . . . . . . . Unitat 5. Reaccions de transferència de protons . . . . . . . . . . . . . . . . . . . . . . . . . . . . 127 5.1 Introducció . . . . . . . . . . . . . . . . . . . . . . . . 128 5.2 Teoria de Brönsted i Lowry . . . . . . . . . . . . . . 129 cg 2.4 Energia interna. Primer principi de la termodinàmica . . . . . . . . . . . . . . . . . . es 33 50 94 w -h ill. 2.2 Variables termodinàmiques . . . . . . . . . . . . . 4.2 Constant d’equilibri de concentració Kc . . . . . 4.4 Relació entre les constants d’equilibri Kc i Kp . 107 ra 32 92 4.3 Constant d’equilibri en funció de la pressió Kp . . . . . . . . . . . . . . . . . . . . . 104 Unitat 2. Termodinàmica química . . . . . . . . . . 31 2.1 Introducció a la termodinàmica . . . . . . . . . . 4.1 Introducció a l’equilibri químic . . . . . . . . . . . 5.3 Força relativa d’àcids i bases . . . . . . . . . . . . 132 5.4 Equilibri iònic de l’aigua . . . . . . . . . . . . . . . 137 5.5 Relació entre Ka i Kb . . . . . . . . . . . . . . . . . . 140 5.6 Concepte de pH . . . . . . . . . . . . . . . . . . . . . 143 5.7 Variació del pH en diluir un àcid fort o un àcid feble . . . . . . . . . . . . . . . . . . . . . . 151 5.8 Indicadors àcid-base . . . . . . . . . . . . . . . . . . 152 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 154 2.10 Espontaneïtat de les reaccions. L’energia lliure de Gibbs . . . . . . . . . . . . . . . . 52 2.11 La termodinàmica i la indústria . . . . . . . . . . 57 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 59 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 64 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 155 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 156 Unitat 6. De la hidròlisi a la neutralització . . . 159 65 6.1 Concepte d’hidròlisi. Comportament àcid o bàsic de les sals . . . . . . . . . . . . . . . . 160 Unitat 3. Cinètica química . . . . . . . . . . . . . . . 67 6.2 Dissolucions reguladores del pH . . . . . . . . . . 165 3.1 La velocitat de les reaccions . . . . . . . . . . . . 68 6.3 Reaccions de neutralització . . . . . . . . . . . . . 170 3.2 Teories de les reaccions químiques . . . . . . . . 72 6.4 Valoracions àcid-base . . . . . . . . . . . . . . . . . 174 3.3 Factors que intervenen en la velocitat de les reaccions . . . . . . . . . . . . . . . . . . . . . 75 3.4 Mecanismes de reacció . . . . . . . . . . . . . . . . 82 6.6 Efectes mediambientals dels àcids: pluja àcida . . . . . . . . . . . . . . . . . . . . . . . . . 182 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 85 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 184 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 87 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 186 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 89 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 187 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 00_quimica_2batx_001-008.indd 6 6.5 La importància del pH del sòl . . . . . . . . . . . . 180 11/03/13 13:46 ÍnDEX 7 Unitat 7. Equilibris iònics heterogenis . . . . . . 189 9.4 Aplicacions de les cel.les galvàniques . . . . . . 248 7.1 Equilibris heterogenis . . . . . . . . . . . . . . . . . 190 9.5 Espontaneïtat de les reaccions redox . . . . . . . 252 7.2 Reaccions de precipitació . . . . . . . . . . . . . . 191 7.3 Solubilitat i producte de solubilitat . . . . . . . 192 7.4 Relació entre solubilitat i producte de solubilitat . . . . . . . . . . . . . . . . . . . . . . . 194 7.5 Efecte de l’ió comú . . . . . . . . . . . . . . . . . . . 198 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 255 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 257 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 259 7.6 Efecte salí . . . . . . . . . . . . . . . . . . . . . . . . . 200 Unitat 10. Propietats periòdiques dels elements . . . . . . . . . . . . . . . . . . . . . . . . . . 261 7.7 Precipitació fraccionada . . . . . . . . . . . . . . . 201 10.1 Els elements de la taula periòdica . . . . . . . . 262 7.8 Dissolució de precipitats . . . . . . . . . . . . . . . 203 10.2 Propietats periòdiques dels elements. Variació dins la taula periòdica . . . . . . . . . . 264 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 205 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 208 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 279 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 209 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 281 es Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 282 Unitat 11. Quantificació de l’energia. Anàlisi espectroscòpica. Enllaç químic . . . . . . . 283 w -h ill. Unitat 8. Reaccions de transferència d’electrons . . . . . . . . . . . . . . . . . . . . . . . . . . . . 211 8.1 Introducció a les reaccions redox . . . . . . . . . 212 8.2 Reaccions orgàniques d’oxidació-reducció . . . 214 8.4 Processos redox en els organismes vius . . . . . 218 11.2 L’enllaç covalent i la teoria de Lewis . . . . . . . 292 8.5 Corrosió dels metalls . . . . . . . . . . . . . . . . . . 219 11.3 Paràmetres moleculars: energia, angle i longitud d’enllaç . . . . . . . . . 297 .m cg ra 8.3 Valoracions redox . . . . . . . . . . . . . . . . . . . . 216 11.1 Caracterització de la quantificació de l’energia i del model ondulatori de l’àtom . 284 8.6 Aplicacions de les reaccions redox: l’acer . . . . 221 11.4 Teoria de repulsió entre els parells d’electrons de la capa de valència . . . . . . . . . 299 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 226 11.5 Enllaços polars i molècules polars . . . . . . . . . 302 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 227 11.6 Forces intermoleculars . . . . . . . . . . . . . . . . . 305 Unitat 9. Aplicacions de les reaccions redox . . 229 11.7 Mètodes espectroscòpics de determinació de l’estructura de les molècules . . . . . . . . . . 306 9.1 Electròlisi . . . . . . . . . . . . . . . . . . . . . . . . . 230 9.2 Cel.les galvàniques . . . . . . . . . . . . . . . . . . . 237 Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 316 w w w Activitats finals . . . . . . . . . . . . . . . . . . . . . . . . . 225 9.3 Força electromotriu d’una pila. Potencials normals de reducció . . . . . . . . . . 241 00_quimica_2batx_001-008.indd 7 Prepara la selectivitat . . . . . . . . . . . . . . . . . . . . . 319 Pràctiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 320 11/03/13 13:46 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES es j Calcular l’energia necessària per canviar d’estat una substància pura. j Deduir l’equació dels gasos ideals a partir de consi­ w -h ill. En aquesta unitat aprendràs a: j Identificar els elements que formen els compostos. j Representar gràficament els diferents estats en què es pot trobar qualsevol substància pura segons la pres­ sió i la temperatura, mitjançant diagrames de fases. j Aplicar la liofilització a alguns processos. j Eliminar productes industrials nocius. deracions teòriques. la seva massa atòmica. w w w .m cg ra j Esbrinar com varia la difusió dels gasos en funció de 01_quimica_2batx_008-030.indd 9 04/03/13 10:37 01 10 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES j1.1 Les substàncies pures dins la classificació de la matèria Les substàncies pures també s’ano­ menen espècies químiques. Les substàncies pures només poden ser elements químics (per exemple, sofre o hidrogen) o compostos formats per elements (per exemple: aigua, H2O, o carbonat de calci, CaCO3). Si barregem dos o més elements o compostos obtenim una mescla, que no és una substància pura. Elements (coure) Substàncies pures Compostos (sacarosa) Homogènia Dissolucions (sal en aigua) Matèria es Mescles Heterogènia w -h ill. cg ra Quan les substàncies pures (elements o compostos) es troben en estat sòlid poden formar cristalls. Un mateix compost pot cristal.litzar de maneres diferents. Aquest fenomen s’anome­ na polimorfisme. Per exemple, el carbonat de calci és polimòrfic i es pot trobar en dues formes cristal.lines. .m Un sol element pot formar substàncies diferents, perquè els seus àtoms s’enllacen de manera diferent. Aquest fenomen rep el nom d’al.lotropia. Per exemple, l’oxigen, O2, i l’ozó, O3, són varietats al.lotròpiques d’un mateix element (l’oxigen), de la mateixa manera que el grafit i el diamant ho són del carboni. w w El carbonat de calci natural també té dues formes de cristal.lització: la calcita (sistema romboèdric) i l’ara­ gonita (sistema ròmbic). Tant la calcita com l’aragonita són CaCO3. Aquest fenomen s’anomena dimorfisme. Mescles heterogènies (sang) w Mescles Compostos Tenen les propietats dels seus components. Si es barregen llima­ dures de sofre i ferro, la mescla té les propietats del sofre i del ferro. Tenen propietats específiques pròpies i no les dels elements consti­ tuents. Així, l’àcid nítric, HNO3, no té absolutament cap semblança amb el nitrogen, l’oxigen i l’hidrogen que el constitueixen. La formació d’una mescla no comporta cap bescanvi energètic amb l’entorn o, en tot cas, és negligible. La formació d’un compost comporta un bescanvi energètic impor­ tant amb l’entorn (reacció endotèrmica o exotèrmica). Els components de les mescles es poden separar per mitjans físics, com ara la filtració, la decantació, la sedimentació, la centrifugació, l’evaporació, la destil.lació, les extraccions sòlidlíquid i líquid-líquid, la cristal.lització i la cromatografia. Els constituents dels compostos no es poden separar per procedi­ ments físics, sinó que cal emprar mitjans que modifiquin química­ ment la combinació, com ara l’electròlisi. Les mescles, en general, poden existir en qualsevol proporció dels seus components. El sofre i el ferro, per exemple, els podem barrejar en qualsevol proporció. Els compostos es formen a partir dels elements en una proporció invariable. Per exemple, cada àtom d’oxigen de l’aigua, H2O, va acom­ panyat forçosament de dos àtoms d’hidrogen. Taula 1.1. Diferències principals entre els compostos i les mescles. ACTIVITATS 1> Esbrina quines diferències hi ha en les varietats al.lo­ tròpiques del fòsfor blanc i el fòsfor roig. 01_quimica_2batx_008-030.indd 10 2> El sofre té al.lotropia. Cerca’n les varietats. 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 01 11 j1.2 Elements i compostos. Obtenció dels elements dels compostos Els elements es troben combinats químicament entre ells formant compostos que tenen unes propietats absolutament diferents de les dels elements constituents. Per exemple, els òxids de nitrogen, NxOy, són compostos de nitrogen i oxigen que no recorden gens les propietats dels dos elements constituents. Per contra, en l’aire, que es defineix com una mescla bàsicament de molècules de nitrogen i d’oxigen, els elements constituents es poden separar mitjançant diferents procediments, com ara la refrigeració, fins a arribar a la liquació i la destil.lació posterior de l’aire líquid obtingut. Els dos constituents tenen diferent volatilitat, ja que les molècules de nitrogen són més peti­ tes i destil.len a una temperatura més baixa que les d’oxigen, més grans. Per tant, si es con­ trola la temperatura de destil.lació, es poden separar els dos elements. Molts compostos es poden separar en els seus elements per diferents mètodes, alguns dels quals s’esmenten tot seguit: jDescomposició. Aquest mètode només es pot emprar en alguns casos. Per exemple, l’òxid 2 HgO(s) f 2 Hg(l) 1 O2(g) es de mercuri(ii), HgO, si l’escalfem, es descompon en oxigen gasós i mercuri metàl.lic: w -h ill. jReducció. Un procediment molt utilitzat en metal.lúrgia és l’aïllament dels metalls mitjan­ çant la reducció amb carbó o un altre reductor potent. D’aquesta manera, es pot aïllar el ferro dels seus òxids, FeO, Fe2O3 i Fe3O4. L’estany també es pot aïllar del SnO2; i el zinc, del ZnO: 2 FeO(s) 1 C(s) f 2 Fe(s) 1 CO2(g) ra cg jL’electròlisi. Una manera usual de separar els elements d’un compost és mitjançant l’elec­ .m tròlisi, un procés electroquímic que provoca el canvi químic gràcies a l’electricitat. w w w L’electròlisi es produeix sempre en fase líquida. Aquest líquid, anomenat electròlit, ha de ser conductor elèctric, i perquè ho sigui cal que contingui ions, positius i negatius. Com que té càrrega elèctrica, pot conduir l’electricitat si hi apliquem una diferència de potencial elèctric. Els ions poden provenir d’un mineral en estat fos o d’una solució líquida: jSi es tracta d’un mineral fos, per exemple bauxita, Al2O3 hidratat, el líquid fos conté ions Al31 i ions O22. En aquest cas, el Al2O3 és un electròlit de primera espècie. jEn canvi, si es tracta d’una solució, per exemple de clorur de sodi en aigua, l’aigua gairebé Algunes de les aplicacions indus­ trials més importants de l’electrò­ lisi són l’obtenció de l’alumini i del coure pur. El paper d’alumini, per exemple, permet conservar millor els aliments i coure a la pa­ pillota. En aquest tipus de cocció s’embolica amb un full de paper d’alumini un aliment, generalment carns i peixos, per coure’l al forn. no està ionitzada en H1 i OH2, però conté ions Cl2 i ions Na1, que són els responsables de la conductivitat elèctrica. En aquest cas, el NaCl(aq) és un electròlit de segona espècie. Fig. 1.1. L’electricitat provoca el trencament de la molècula d’aigua en hidrogen i oxigen (gasos). 01_quimica_2batx_008-030.indd 11 04/03/13 10:37 12 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES La conductivitat elèctrica és deguda als ions positius o cations, i als negatius o anions. Sem­ pre s’esdevé un canvi químic prop dels elèctrodes o borns de contacte amb l’electròlit. En electroquímica: Ànode, és on s’esdevé l’oxidació i en les piles és l’elèctrode negatiu. Càtode, és on s’esdevé la reducció i en les piles és l’elèctrode positiu. Els elèctrodes són dues barres, de metall o de grafit, connectades als borns d’un generador de corrent continu de baix voltatge. Un elèctrode és positiu i l’altre negatiu: jÀnode, és l’elèctrode positiu en l’electròlisi. jCàtode, és l’elèctrode negatiu en l’electròlisi. Els elèctrodes han de ser d’un material adient que no reaccioni amb el compost que volem separar en els elements constituents, és a dir, han de ser inerts per a la reacció electroquímica en qüestió. Un element s’oxida quan perd elec­ trons. Per exemple: Fe0 f Fe21 Un element es redueix quan en gua­nya. Com a exemple, estudiarem una electròlisi senzilla: la de la sal comuna fosa. Introduïm el NaCl en un recipient o cubeta anomenada cel.la electrolítica (fig. 1.2) i l’escalfem fins a fon­ dre’l. Fem passar un corrent elèctric de pocs volts entre els dos elèctrodes que estan en con­ tacte amb la sal fosa. Observem que de l’ànode es desprenen bombolles de clor, Cl2, mentre que al càtode, es dipo­ sita el sodi, Na, que sura damunt la sal fosa. L’equació corresponent és: Per exemple: Cl02 f 2 Cl2 w -h ill. es 2 NaCl(l) f 2 Na(s) 1 Cl2(g) Els primers experiments sobre l’electròlisi daten de l’any 1800. W. Nicholson i A. Carlisle van fer passar el corrent d’una pila de Volta a través d’una dissolució d’aigua acidulada, de manera que es van obtenir hidrogen i oxigen gasosos. w w w .m cg ra El PVC o policlorur de vinil es pro­ dueix a partir d’etilè o etè i de clor obtingut de l’electròlisi de la sal comuna (clorur de sodi). 2 H2O(l) f 2 H2(g) 1 O2(g) Fig. 1.2. Esquema de l’electròlisi del NaCl fos. A C T I V I TAT S 3> Cerca informació d’altres aplicacions industrials de l’electròlisi. 4> Esbrina per què van acidular l’aigua Nicholson i Carlisle. 5> Informa’t sobre què són els cromats i niquelats de l’acer. 01_quimica_2batx_008-030.indd 12 04/03/13 10:37 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 13 j1.3 Diagrama de fases d’una substància pura Hi ha diferents maneres de saber si una substància és pura o no. La més senzilla consisteix a obtenir-ne la corba d’escalfament. Si una substància és pura, durant el canvi d’estat (per exemple, de sòlid a líquid o a l’inrevés) la temperatura de la substància és constant. La temperatura d’un canvi d’estat té un valor concret per a una pressió ambiental determina­ da. Per exemple, a una pressió atmosfèrica normal (101,3 kPa), quan fem bullir aigua pura líquida i passa a gas, la temperatura d’ebullició es manté a 100 °C. Mentre hi hagi una mica d’aigua líquida, el conjunt aigua líquida-gas es mantindrà a 100 °C. Just en el moment en què s’hagi evaporat la darrera gota líquida, l’aigua en estat gasós pujarà de temperatura si la con­ tinuem escalfant (fig. 1.3). L’aigua en estat gasós se sol anomenar vapor d’aigua. En canvi, en vaporitzar-se aigua salada, el punt d’ebullició va pujant i no és constant. La fase líquida es va concentrant en sal a mesura que es vaporitza aigua. L’aigua salada, doncs, no és una substància pura, és una mescla. w -h ill. es Tota substància pura, element o compost, sòlida o líquida, desprèn una certa quantitat de vapor, per petita que sigui. La pressió a què està aquest vapor en un recipient en el qual no­ més hi ha la substància i el seu vapor s’anomena pressió de vapor, i és un valor definit per a cada substància i per a una temperatura determinada. Per exemple, l’aigua pura a 30 °C té una pressió de vapor de 0,0418 atm, i a 93 °C, de 0,840 atm. Si l’aigua conté sals o altres produc­ tes dissolts, és a dir, si no és pura, la pressió de vapor és inferior, i varia segons la quantitat de producte dissolt que conté (llei de Raoult). cg ra En el punt triple poden coexistir les tres fases: sòlida, líquida i gasosa. S’esdevé a una pressió i temperatura úniques (punt invariable) (fig. 1.4). w w w .m La sublimació s’utilitza en la liofilització de substàncies. La liofilització és una operació que consisteix en una congelació seguida d’una deshidratació posterior per sublimació. S’efectua en un recipient en el qual s’ha fet el buit. Cal evitar que el glaç format es fongui durant l’ope­ ració, per la qual cosa es treballa a una temperatura inferior al punt triple. p A C 760 mmHg Si fem el mateix procés a una pressió atmosfèrica diferent, per exemple creant un buit parcial, l’aigua bullirà a una temperatura inferior. Una olla de pressió a la cuina treballa a pressió superior a l’atmosfèrica i, per tant, els lí­ quids aquosos del seu interior po­ dran estar a més de 100 °C. Així, doncs, els aliments es couran amb més rapidesa. La relació entre la pressió de va­ por d’una dissolució i la pressió de vapor del dissolvent pur ve dona­ da per la llei de Raoult, que esta­ bleix que en una dissolució en què el solut no és volàtil, el des­ cens relatiu de la pressió de vapor és igual a la fracció molar del so­ lut, segons l’expressió següent: Dp —— 5 xs, o bé Dp 5 xs ? p0 p0 En què Dp és la disminució de la pressió de vapor, és a dir, la dife­ rència entre la pressió de vapor del dissolvent pur i la pressió de vapor de la dissolució, xs és la fracció molar del solut i p0 és la pressió de vapor del dissolvent. líquid fusió solidificació sòlid vaporització gas condensació O 4,58 mmHg punt triple sublimació B 0,01º Fig. 1.3. Diagrama dels canvis d’estat d’una substància pura en funció de la temperatura. 100º T (ºC) Fig. 1.4. Diagrama d’equilibri de fases de l’aigua. A una pressió inferior a la del punt triple, l’aigua pot passar d’estat sòlid a estat gasós sense passar per estat líquid, és a dir, pot sublimar. Les baixes temperatures en la lio­ filització eviten alteracions quí­ miques i pèrdues de components volàtils. Les baixes temperatures i la manca d’aigua eviten el desen­ volupament de microorganismes que podrien fer malbé els produc­ tes alimentaris i ocasionar proble­ mes sanitaris. A C T I V I TAT S 6> Esmenta un parell d’exemples d’aliments liofilitzats. 01_quimica_2batx_008-030.indd 13 7> Com obtindries llet concentrada (amb menys aigua) al laboratori sense que es malmetés? 04/03/13 10:37 14 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES j1.4 Canvis d’estat jA. Sòlid-líquid En els sòlids, les partícules —molècules, àtoms o ions, segons el tipus de sòlid— no es poden moure, només vibren al voltant d’una posició fixa. Això és així perquè la seva energia tèrmica no pot vèncer les forces d’atracció entre elles (fig. 1.5). Quan escalfem un sòlid es transmet energia a les seves partícules, la qual les fa vibrar més ràpidament, de manera que se separen una mica més les unes de les altres i augmenta una mica el volum del sòlid. Quasi tots els cossos sòlids es dilaten en escalfar-los. Fig. 1.5. Partícules d’un sòlid vibrant a l’entorn de posicions fixes. Quan s’arriba a la temperatura de fusió, Tf , l’agitació de les partícules és prou gran perquè s’allunyin de les posicions fixes al voltant de les quals vibren, i el cos fon. L’ordre cristal.lí del sòlid es trenca i les partícules es mouen i xoquen les unes amb les altres. Si el sòlid és amorf, o no és una substància pura, la temperatura de fusió, Tf, no es manté constant; és a dir, no hi ha un únic punt de fusió, sinó que es mou en un marge de valors. w -h ill. es La quantitat de calor necessària, a pressió atmosfèrica, perquè la unitat de massa passi de l’estat sòlid a l’estat líquid s’anomena calor latent de fusió, lf. La calor latent de fusió, lf, té el mateix valor que la calor latent de solidificació, ls, que correspon al procés de solidificació o pas d’estat líquid a estat sòlid. ra jB. Líquid-gas w w w .m cg En els líquids, les partícules es poden moure perquè tenen una energia cinètica més gran que en el sòlid. Quan els líquids s’evaporen, algunes de les partícules amb energia més alta acon­ segueixen separar-se de les del seu voltant i passar a vapor. Per fer-ho han d’agafar energia de l’entorn, i per això la temperatura del líquid baixa. Aquest fenomen el podem observar fàcil­ ment si ens posem acetona al palmell de la mà i deixem que s’evapori: la mà es refreda perquè la calor corporal ha servit per evaporar l’acetona. El trànsit de líquid a gas es pot realitzar per evaporació o per ebullició. En tots dos casos s’esdevé una vaporització. jL’evaporació és un fenomen superficial que es produeix a qualsevol temperatura. Només unes quantes partícules properes a la interfase líquid-gas es poden escapar. jEn l’ebullició tot el líquid assoleix una temperatura suficient perquè les partícules puguin Fig. 1.6. Diagrama dels canvis d’estat. La calor de vaporització ens dóna un valor aproximat de les forces d’enllaç entre les partícules d’un líquid. En passar de sòlid a líquid la substància només es desordena una mica, i es mantenen en bona part els enllaços entre partícules. En canvi, en passar de líquid a gas aquests enllaços s’han de trencar tots. Per això la calor de vaporit­ zació és molt més gran que la ca­ lor de fusió. 01_quimica_2batx_008-030.indd 14 passar a fase gas o vapor. Si la substància és pura, la temperatura d’ebullició, Te, es manté constant. La calor necessària, a pressió atmosfèrica, perquè la unitat de massa d’una substància es vaporitzi, s’anomena calor latent de vaporització, lv. La calor latent de vaporització és igual a la calor latent de condensació, lc, que correspon al procés de condensació o pas d’estat gasós o vapor a estat líquid. jPunt crític. Caracterització del procés de liquació d’un gas. En comprimir un gas, la pres­ sió augmenta, les molècules s’atansen i s’atrauen una mica (per forces de Van der Waals) en estar més properes. Així és possible que el gas es condensi, i passi de l’estat gasós al líquid. Però perquè un gas esdevingui líquid cal que estigui per sota de la temperatura crí­tica. Aquesta temperatura és característica de cada compost o element. Alguns punts crítics són: H2O 647,1 K i 217,8 MPa; CO2 304,2 K i 7,8 MPa. Pel damunt de la temperatura crítica, és impossible liquar un gas per molt que el comprimim. En aquestes condicions aquests fluids s’anomenen fluids supercrítics. S’utilitzen industrialment com a solvents. 04/03/13 10:37 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES jPunt crític d’un fluid. Imaginem un recipient tancat amb un líquid i el seu vapor. A mesu­ ra que pugem la temperatura, augmenta la densitat i la concentració del gas, alhora que baixa la densitat del líquid. Si anem escalfant arriba un moment a partir del qual no és perceptible la diferència entre líquid i gas. És el punt crític. 15 p (Fluid supercrític) F punt crític Líquid Sòlid jC. Sòlid-gas Els líquids purs a una temperatura determinada tenen una pressió de vapor característica. En els sòlids també existeix la pressió de vapor, si bé en una magnitud que sol ser molt inferior. Si les partícules del cristall vibren prou enèrgicament, poden vèncer les forces cristal.lines de cohesió que les enllacen i les partícules perifèriques poden arribar a passar a l’estat gasós. En aquest cas, diem que el sòlid sublima. Gas E punt triple D A B C T Fig. 1.7. Punt crític. es Cada sòlid té una pressió de vapor característica a una temperatura determinada. Per exemple, l’aigua sòlida a 0 °C té una pressió de vapor de 0,00603 atm (4,58 mmHg). Si escalfem aigua sòlida que estigui a una temperatura una mica inferior als 0 °C en un recipient que estigui a una pressió per sota de 0,00603 atm —creada mitjançant el buit—, l’aigua passa directament d’estat sòlid a estat gasós. Passa el mateix si el gel està en contacte amb un aire molt sec, sempre que el vapor d’aigua sigui el que tindria si estigués sol en el mateix volum, a la pressió de 0,00603 atm o menys. w -h ill. La pressió de vapor dels sòlids, com la dels líquids, creix amb la temperatura. cg ra Un altre exemple característic de sublimació és el del gel sec, que és CO2 sòlid que es fa servir per refrigerar aliments, el qual sublima sense fondre a pressió atmosfèrica, perquè la pressió del CO2 a l’atmosfera és més baixa que la pressió de vapor del sòlid (fig. 1.8). w w .m La quantitat de calor necessària per sublimar la unitat de massa en estat sòlid fins a l’estat gasós a pressió atmosfèrica s’anomena calor latent de sublimació. w Observeu la figura 1.4. Les corbes representen els valors simultanis de p i T en els quals dues fases d’aigua poden coexistir en equilibri. Per exemple, l’aigua sòlida coexisteix amb l’aigua en estat gasós (vapor) en tots els valors de p i T corresponents a la línia OB. Anàlogament, en els valors de p i T de la corba OC coexisteixen el glaç i l’aigua líquida. En les condicions de p i T corresponents a la línia OA coexisteixen l’aigua líquida i l’aigua gasosa. En el punt O, anomenat punt triple, poden coexistir les tres fases en equilibri. El punt triple de l’aigua correspon a una pressió de 0,00603 atm i a una temperatura de 0,01 °C. Les zones entre corbes corresponen a condicions de p i T en què només pot existir aigua en una sola fase. L’aigua a una temperatura d’1 °C i a una pressió de 2 mmHg estarà en forma de gas. Caldrà aplicar-hi una pressió de 8-10 mmHg o més per liquar (condensar) l’aigua. Si l’aigua estigués a 250 °C i 1 mmHg de pressió estaria en fase gas però no aconseguiríem la liquació per molt que comprimíssim, ja que no entraríem en la zona líquida. L’aigua es congelaria i passaria de gas a sòlid directament (sublimació regressiva). Fig. 1.8. El diòxid de carboni dins d’un extintor es troba en estat líquid i a una pressió elevada. A uns 25 °C està a unes 62 atm. En obrir-ne l’aixeta, el CO2 líquid es descomprimeix sobtadament, i en fer-ho necessita calor, que agafa majoritàriament d’ell mateix, refredant-se molt i sortint pre­ ferentment sòlid. Però a la pressió atmosfèrica el CO2 és gas, i per tant, aquell CO2 sòlid sublima de seguida. A C T I V I TAT S 8> Investiga per què: a) S’eixuga la roba mullada tant si fa vent com si fa calor. b) L’aigua dels càntirs i sellons de material porós es manté fresca si es col.loquen en un lloc on hi hagi corrent d’aire, sempre que es tracti d’aire sec. 01_quimica_2batx_008-030.indd 15 9> Sabent que el cotó té moltíssims grups OH en les seves molècules i que el niló no en té cap, esbrina per què costa molt més eixugar el cotó mullat que el niló. 10> Si tenim gel a 20,5 ºC i hi apliquem un buit inferior a 0,00603 atm (4,58 mmHg), què penses que passarà? 04/03/13 10:37 16 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES j1.5 Teoria cineticomolecular dels gasos La matèria sòlida es compon de partícules que vibren i no es traslladen. En els líquids, en canvi, les partícules ja es mouen una mica i canvien de posició. En els gasos, les partícules tenen llibertat total de moviment. El moviment que anima aques­ tes partícules depèn de la temperatura. Com més elevada és la temperatura, més energia tenen les partícules i més ràpidament vibren i es mouen. L’energia cinètica de les partícules depèn, doncs, de la temperatura. Sabem que l’energia cinètica és: 1 Ec 5 — m v2 2 en què m és la massa de la partícula i v és la velocitat. w -h ill. es Ara bé, no totes les partícules es mouen a la mateixa velocitat. Parlem, aleshores, d’una energia cinètica mitjana a una temperatura determinada. Per a totes les partícules d’un gas es compleix que l’energia cinètica mitjana de cada molècula a la temperatura T és: ra 2 3 Ec 5 — ? k ? T 2 cg en què k és la constant de Boltzmann, que val 1,38 ? 10223 J/K, i T la temperatura absoluta en kelvin. .m Aquesta equació ens indica que: w w jDos gasos diferents, a la mateixa temperatura absoluta, tenen la mateixa energia cinètica mitjana. w jL’energia interna d’un gas depèn del moviment de les seves molècules; per tant, només de­ pèn de la seva temperatura absoluta. Com que les partícules dels gasos es mouen anàrquicament en totes direccions, l’estudi detallat i rigo­ rós de la seva energia es fa des del punt de vista estadístic. Si relacionem les dues equacions anteriors ens adonem que, en augmentar la temperatura, també augmenta la velocitat de les partícules i la seva velocitat mitjana. Si la temperatura és 0 K, l’energia cinètica mitjana també és zero. Això vol dir que, a mesura que la temperatura baixa, les partícules es mouen menys. Prop dels 0 K, les partícules de sòlid pràcticament no vibren. També podem comprendre per què la pressió d’un gas augmenta en pujar la temperatura. En pujar la temperatura, l’energia cinètica de les partícules augmenta i, per tant, la seva velocitat creix; a més velocitat, hi haurà més xocs de les partícules amb les parets per unitat de temps, cosa que provoca una pressió més gran. jA. Deducció de la llei dels gasos ideals a partir de la mecànica L’equació d’estat: p ? V 5 n ? R ? T es pot deduir a partir de l’aplicació de la mecànica clàssica a les partícules d’un gas qual­ sevol. 01_quimica_2batx_008-030.indd 16 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 01 17 La teoria cineticomolecular parteix del desenvolupament d’uns postulats o principis ideals. Aquests postulats són: jUn gas està format per partícules en moviment constant, que topen constantment entre elles. Les col.lisions són perfectament elàstiques. jNo hi ha atracció ni repulsió entre les partícules (ja sabem que això no és del tot cert; tan sols és una aproximació). El fenomen de la pressió és degut a les col.lisions de les partícules amb les parets del recipient. Suposem N partícules, cadascuna de massa m, contingudes en un volum V de forma cúbica (fig. 1.9). Les partícules, en moure’s, tenen associada una quantitat de moviment, que segons la mecà­ nica és el producte de la massa per la velocitat: Fig. 1.9. Trajectòria d’una partícula que es dirigeix contra una paret. L 5 m ? v (cap a la dreta) w -h ill. es Tanmateix, la velocitat és una magnitud vectorial i, per tant, cal tenir en compte el sentit del moviment. Així, quan la partícula en qüestió es dirigeix cap a la paret de l’esquerra (A), la quantitat de moviment que té és: L 5 m ? (2v) (cap a l’esquerra) cg L 5 m ? v ra En què el signe (2) indica que va en sentit contrari al positiu de l’eix de les abscisses (cap a la dreta). En col.lidir amb la paret A, es produeix un rebot completament elàstic; ara la partícula s’allunya de la paret A i té una quantitat de moviment: w w .m Per tant, la variació de la quantitat de moviment en aquesta col.lisió és la diferència entre les quantitats de moviment final i inicial; és a dir: DL 5 m ? v 2 m ? (2v) 5 2 m ? v w El temps que hi ha entre dues col.lisions consecutives amb la paret A és: desplaçament 2 l Dt 5 ——————— 5 —— velocitat v en què l és el costat del cub elemental (desplaçament 5 2 l, ja que la partícula va i torna). També sabem que la força, F, és la variació de la quantitat de moviment per unitat de temps; és a dir: DL 2 m ? v 2 m ? v m ? v2 F 5 —— 5 ——— 5 ——— 5 ——— Dt Dt 2 l/v l Si la superfície de la cara elemental A del cub és S, obtindrem que en el xoc la pressió exer­cida per la partícula sobre aquesta cara és: m ? v2 m ? v2 F (m ? v2)/l ——— ——— p 5 — 5 ———— 5 5 S l 2 l 3 V en què V és el volum del cub elemental de l’estudi. Del conjunt de totes les partícules, podem suposar, des del punt de vista estadístic, que un terç de les partícules es mou en la direcció de l’eix de les X, un altre terç es mou en la de l’eix de les Y i, finalment, l’altre terç, en la de l’eix de les Z. Per tant, de tot el conjunt de les N partícules del cub elemental, només N/3 toparà amb la paret A. Com que hi ha partícules més ràpides que altres, la quantitat de moviment mitjana es correspondrà amb el que es v 2. coneix com a velocitat quadràtica mitjana de les partícules o 2 01_quimica_2batx_008-030.indd 17 04/03/13 10:37 18 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES m ? 2 v 2 N Per tant, podem escriure que la pressió general sobre la cara A val: p 5 ——— ? — V 3 1 Segons l’equació Ec 5 — m v2, en 2 una barreja de gasos, a la mateixa energia cinètica les molècules del gas més lleuger tindran una velo­ citat mitjana més alta. A més, no totes les molècules del mateix gas van a igual velocitat; per tant, cal parlar d’una velocitat i una ener­ gia cinètica mitjanes. Si NA és el nombre d’Avogadro, podem escriure qualsevol nombre N en funció de NA. És a dir: N 5 n ? NA en què n és la quantitat de matèria (en mols). Si considerem que les N partícules en qüestió tenen una energia cinètica mitjana de: 1 v2 Ec 5 — m 2 2 2 podem escriure l’equació de la pressió de la manera següent: p ? V 5 — ? n ? NA ? Ec en què p és la pressió de totes les partícules. 3 L’energia cinètica de qualsevol gas és directament proporcional a la temperatura absoluta; és a dir: Ec 5 K ? T en què K és una constant. es 2 Podem escriure, per tant: p ? V 5 — ? n ? NA ? K ? T en què NA és el nombre d’Avogadro. 3 2 2 El producte — ? NA ? K és una constant i correspon a la dels gasos ideals (R): R 5 — ? NA ? K 3 3 I, en conseqüència, l’equació dels gasos es pot escriure d’aquesta manera: w -h ill. p ? V 5 n ? R ? T cg ra Aquesta fórmula s’aplica en la resolució d’exercicis pràctics sobre gasos i cal treballar en les unitats adients. En el SI, la pressió s’expressa en Pa, el volum en m3, la constant dels gasos és R 5 8,31 J/(K?mol) i la temperatura s’expressa en K. També és molt freqüent utilitzar les uni­ tats següents: la pressió en atm, el volum en L, la constant dels gasos R 5 0,082 atm?L/(K?mol) i la temperatura en K. .m hLlei de Graham. Velocitat de difusió dels gasos w w w La interpretació de les velocitats de difusió dels gasos es pot fer a partir de la seva massa molecular. Així, la llei de Graham estableix que «el quocient entre les velocitats de difusió de dos gasos és inversament proporcional al quocient entre les arrels quadrades de les densitats respectives». És a dir, si d1 i d2 són les densitats i v1 i v2 les velocitats: fvvvvv d2 v1 — 5 —— v2 fvvvvv d1 Si expressem la densitat com la massa molar dividida entre el volum molar V, resulta: v1 —5 v2 M M vv fvv V @f V 2 —— 2 1 —— 1 I com que el volum molar de dos gasos sotmesos a les mateixes condicions de pressió i tempe­ ratura és el mateix, v1 5 v2, podem escriure: fvvvvv M2 v1 — 5 —— v2 fvvvvv M1 Així, doncs, podem afirmar que: «el quocient entre les velocitats de difusió de dos gasos sot­ mesos a les mateixes condicions de pressió i temperatura és inversament proporcional al quo­ cient entre les arrels quadrades de les seves masses molars». Comparem, per exemple, les velocitats de difusió del diòxid de carboni i l’oxigen. Les masses molars respectives són 44 g/mol i 32 g/mol. fvvvvvvvv MCO2 fvvvvv 44 vO2 5 ——— 5 ——— 5 1,17 Per tant: —— vCO2 fvvvvvvv MO2 fvvvvv 32 01_quimica_2batx_008-030.indd 18 04/03/13 10:37 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 19 L’oxigen, doncs, es difon a una velocitat 1,17 vegades major que la del CO2. Però si en lloc de comparar la velocitat de difusió de l’oxigen amb la del diòxid de carboni, la comparem amb la del monòxid de carboni (que té una massa molar de 28 g/mol), el resultat és un altre. Vegem-ho: fvvvvvvv MCO fvvvvv 28 vO2 —— 5 ——— 5 ——— 5 0,94 vCO fvvvvvvv MO2 fvvvvv 32 La velocitat de difusió de l’oxigen és 0,94 vegades la del monòxid de carboni. hElaboració del model de gas real per explicar les desviacions respecte al comportament de gas ideal En condicions de pressió i temperatura baixes, les molècules no estan properes entre elles i el gas es comporta aproximadament com ideal. Quan la pressió o la temperatura augmenten ens allunyem del comportament ideal. Per tal d’explicar perquè es produeix aquesta desviació cal revisar els principis en què es fonamenta la teoria cinètica dels gasos ideals: es jEls gasos estan formats per partícules (àtoms o molècules) que es mouen constantment. w -h ill. jLa grandària de les partícules és negligible comparada amb el volum del recipient. jLes forces d’atracció i repulsió de les partícules són negligibles perquè estan prou separades. jEls xocs de les partícules són perfectament elàstics. ra jL’energia cinètica de les molècules és directament proporcional a la temperatura absoluta. cg jA la mateixa temperatura, l’energia cinètica mitjana de les partícules es manté constant al .m llarg del temps. w w Però gairebé tots els gasos es desvien d’aquest comportament. Això ho podem entendre a partir dels principis que hem esmentat. Així: w jA altes pressions, la grandària de les molècules no és negligible respecte del recipient. jLes forces d’atracció entre les molècules no es poden negligir. Aquestes diferències es recullen en la fórmula de Van der Waals dels gasos reals: a n2 3p 1 —— 4 (V 2 n b) 5 n R T V H2 a 5 0,24 b 5 0,0266 N2 a 5 1,39 b 5 0,0391 on a i b són les constants de Van der Waals, determinades experimentalment. O2 a 5 1,36 b 5 0,0318 a està relacionada amb les forces intermoleculars. S’expressa en (L2 ? atm)/mol2. CH4 (metà) a 5 2,28 b 5 0,0428 b està relacionada amb el volum de les partícules del gas. S’expressa en L/mol. CO2 a 5 3,59 b 5 0,0427 2 Constants de Van der Waals d’alguns gasos determinades experimentalment (Taula 1.2). Taula 1.2 A C T I V I TAT S 3 1 11> A partir de les dues equacions 2 Ec 5 — ? k ? T i Ec 5 — m v2 dedueix si les mo 2 2 lècules de dos gasos de masses di­ferents tindran igual velocitat mitjana a la mateixa temperatura absoluta. Considera, per exemple, el N2 i el CO2. Dades: massa del nitrogen 5 28 uma; massa del diòxid de carboni 5 44 uma. 01_quimica_2batx_008-030.indd 19 04/03/13 10:37 01 20 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES j1.6 Calor intercanviada en els canvis d’estat A la taula 1.3 podem observar els valors d’algunes calors latents de fusió o solidificació. Cal destacar la gran quantitat de calor necessària per fondre l’aigua glaçada, sobretot si es com­ para amb alguns metalls. Perquè una substància en estat líquid passi a estat gasós, cal aplicar-hi una certa quantitat de calor, que també depèn de la massa i de la calor latent de vaporització, lv. Tf (K) A la taula 1.4, podem observar els valors d’algunes calors latents de vaporització o condensa­ ció. Cal destacar la gran quantitat de calor que necessita l’aigua per vaporitzar-se per compa­ ració a les altres substàncies. Aquest fet té una importància cabdal en el transport de calor, ja que l’aigua-vapor permet traslladar grans quantitats d’energia, cosa que amb un altre fluid no seria tan rendible econòmicament. lf (kJ/kg) Substància Només les substàncies pures tenen un valor de calor latent fix du­ rant un canvi d’estat. A més, si aquestes substàncies són sòlides, cal que estiguin en estat cristal.lí. Per exemple, els polímers orgànics encara que siguin purs no acostu­ men a ser cristal.lins, sinó sòlids amorfs o semicristal.lins. No tenen un punt de fusió definit, sinó que està inclòs dins un marge de va­ lors. Perquè una substància en estat sòlid passi a estat líquid, cal aplicar-hi una certa quantitat de calor, que depèn de la massa i de la calor latent de fusió, lf. Cal recordar que no tots els cossos sòlids, en ser escalfats, es fonen. Alguns, com la fusta o el paper, es descomponen o es cremen. D’altres, com ara els cautxús, les gomes, els polímers orgànics, els betums i els asfalts, no tenen un canvi d’estat definit. Aigua 330,7 273 Aigua Coure 175,8 1 356 Èter 380,9 308 Plom 23,0 600 Mercuri 284,6 633 1 813 Etanol 870,7 351,5 EXEMPLE 1 es 373 Taula 1.4. Calors latents de vaporització o condensació d’algunes substàncies a la pressió d’1 atm. cg ra w -h ill. 2 252,1 La calor de canvi d’estat d’una massa m de substància, es calcula, evidentment, amb les ex­ pressions següents: Qv 5 m lv Qf 5 m lf .m Taula 1.3. Calors latents de fusió o solidificació d’algunes substàncies a la pressió d’1 atm. Te (K) w w 200,9 lv (kJ/kg) en què m és la massa en kg, i lv i lf són les calors latents de canvi d’estat en kJ/kg. w Ferro Substància Calcula la quantitat de calor que cal aplicar a 5 kg d’aigua glaçada a 210 °C per dur-la a l’estat líquid i a una tempera­ tura de 60 ºC. La calor necessària per fondre el gel a 0 °C es calcula així: Dades: Ce (gel) 5 2,09 kJ?kg21?K21; Ce (aigua líquida) 5 4,18 kJ?kg21?K21; lf (glaç) 5 330,7 kJ?kg21 La calor necessària per dur l’aigua líquida de 0 °C a 60 °C es calcula amb aquesta expressió: Qf 5 m ? lf 5 5 kg ? 330,7 kJ?kg21 5 1 653,5 kJ Q2 5 m ? Ce ? DT 5 5 kg ? 4,18 kJ?kg21?K21 ? 60 K 5 5 1 254 kJ Resolució La calor necessària per dur l’aigua glaçada de 210 °C a 0 °C es calcula per mitjà de l’expressió: Per tant, la calor total necessària és: Q1 1 Qf 1 Q2 5 104,5 1 1 653,5 1 1 254 5 3 012 kJ Q1 5 m ? Ce ? DT 5 5 kg ? 2,09 kJ?kg21?K21 ? 10 K 5 104,5 kJ ACTIVITATS 12> a)Calcula la calor que cal aplicar, a pressió atmosfèri­ b) Calcula la calor que cal aplicar a 2 L de mercuri a 360 °C, per vaporitzar-lo. ca, a 3 kg de plom a 327 °C per fondre’l completa­ ment. Dades: densitat del mercuri: 13,6 kg/L. 01_quimica_2batx_008-030.indd 20 R: a) Qf 5 69 kJ; Qv 5 7 741,12 kJ 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 01 21 j1.7 Les activitats industrials i el medi ambient La indústria consumeix una gran quantitat de matèries primeres i energia per obtenir produc­ tes molt elaborats i de molta utilitat. En aquest procés, també s’obtenen subproductes de menys valor econòmic, que sovint es llencen, ja que no se’ls troba una aplicació prou rendible econòmicament. Aquests subproductes s’han de neutralitzar químicament abans de llençar-los i posteriorment s’han de portar a abocadors controlats. La tecnologia química permet elaborar productes reciclables nous. La inquietud ecològica ha obligat a revisar alguns aspectes de la producció química. Tota empresa química moderna ha de tenir en compte l’impacte ambiental de les seves activitats productives i ha de saber com avaluar aquest impacte. Actualment, totes les empreses químiques haurien de disposar d’instruments de gestió ambiental i saber com minimitzar, gestionar i regular la producció de residus. Finalment, l’Administració governamental hauria d’impulsar la promoció de l’ecodisseny i la fabricació d’ecoproductes. Alguns criteris molt importants que cal tenir en compte són: La corrosió i el tractament de me­ talls pesants perillosos, especial­ ment del mercuri, el plom, el cad­ mi i l’arsènic, són un altre camp en què la química intervé per mi­ llorar el medi ambient. jQue els reactius no pol.lueixin. jQue es minimitzin els productes de poc valor. w -h ill. es jQue els productes obtinguts siguin reciclables. jQue s’optimitzi el balanç energètic del procés. El gran consum energètic exigeix en l’aspec­ te ecològic: ra —Limitar i optimitzar el consum dels combustibles fòssils. La química pot ajudar a reduir els aspectes negatius que acompa­ nyen tota activitat industrial. .m cg —Limitar l’abocament d’efluents líquids calents als rius: la contaminació tèrmica fa min­ var el contingut d’oxigen de les aigües fluvials. w w w Tot seguit analitzarem els principals components contaminants segons que siguin gasos, líquids o sòlids. jA. Contaminants gasosos i de l’aire Cal controlar les emissions gasoses nocives, especialment els gasos nitrosos, NxOy, el monòxid de carboni, CO, els òxids de sofre, SO2 i SO3, i les macropartícules en suspensió —aglomerats de sòlids i líquids que contenen Al, Ca, Fe, Pb, Mg, Na, Be, Hg i asbest combinats amb 22 2 nitrats, NO2 3 , sulfats, SO4 , i clorurs, Cl . Fig. 1.10. Els tubs d’escapament dels automòbils tenen catalitzadors de platírodi (Pt-Rh) que eliminen els gasos nitrosos i els transformen en N2 i O2, innocus. La reacció és: NxOy f x/2 N2 1 y/2 O2 01_quimica_2batx_008-030.indd 21 04/03/13 10:37 22 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES La taula 1.5 mostra alguns exemples de contaminants gasosos i del seu origen o ús. Les emissions de gasos àcids com el SO2 de les centrals tèrmiques es poden minimitzar amb tractaments alcalins. Producte contaminant Origen/Ús Alcans Refineries de petroli Hidrocarburs del benzè (aromàtics) Evaporació de dissolvents industrials Diòxids de sofre (SO2 i SO3) Combustió de certs combustibles fòssils Fosa i obtenció de metalls Refineries de petroli Sulfur d’hidrogen (H2S) Refineries, indústria paperera i adobera Halometans: clorometà i bromometà Incineració de plàstics halogenats (PVC) Fumigacions Monòxid de carboni (CO) Elaboració d’acer Refinatge del petroli Eliminació de residus sòlids Hidrocarburs clorats Evaporació de dissolvents clorats es Freons (CF2Cl2 i CFCl3) (ja prohibits) Benzina amb plom Òxids de nitrogen (NxOy) w -h ill. Macropartícules Combustions Obtenció d’àcid nítric ra Taula 1.5. Contaminants gasosos i el seu origen o ús. w w .m cg Els freons són un exemple d’estabilitat: la poca reactivitat que tenen amb els agents atmos­ fèrics els permet migrar fins a les capes altes de l’estratosfera, on es difonen lentament i es descomponen donant clor atòmic, Cl•, a causa de les radiacions solars. El clor atòmic reac­ ciona immediatament amb l’ozó, O3, i el destrueix. L’ozó estratosfèric ens és imprescindible perquè és el filtre natural dels raigs ultraviolats solars. Per això fa anys que els freons estan prohibits. w Els productes gasosos tenen una mobilitat elevada. Imaginem-nos una barreja de gasos. Per saber quines molècules es mouen més de pressa en la barreja, si les de N2 o les de CO2, cal recórrer a la teoria cineticomolecular que, com hem vist, explica les desviacions respecte del comportament ideal dels gasos reals a baixes temperatures i altes pressions. Les macropartícules més petites són molt nocives: travessen les narius, es dipositen als al­ vèols pulmonars i provoquen malalties respiratòries serioses. Els òxids de sofre i de nitrogen són letals per a les plantes, i en presència d’humitat ataquen els revestiments dels edificis. jB. Contaminants de l’aigua Els abocaments industrials més nocius (fig. 1.11) són els que contenen ions de metalls pe­ sants com ara el plom, el zinc, el cadmi, el mercuri, el crom, el níquel o el coure. La matèria orgànica dissolta, l’alcalinitat o l’acidesa fortes, o l’alta temperatura també són pol.luents. La depuració de les aigües es pot fer de diverses maneres: jSeparació dels sòlids en suspensió col.loïdal: decantació, flotació, filtració i floculació per obtenir grups de coàguls de partícules que precipiten o suren més ràpidament. jBiodegradació de restes orgàniques. Les restes orgàniques acostumen a ser biodegrada­ bles i es poden descompondre biològicament. Es fan reaccionar aeròbicament (amb aire) o anaeròbicament (sense aire). En el primer cas es produeix CO2 com a subproducte, i en el segon cas, metà, CH4. Certa matèria orgànica és difícilment biodegradable i cal eliminar-la per altres mitjans. Si després de depurar l’aigua, encara té color, olor o gust, cal fer una adsorció amb carbó actiu, que reté moltes de les molècules contaminants. El carbó es pot 01_quimica_2batx_008-030.indd 22 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 01 23 regenerar posteriorment per reutilitzar-lo, mitjançant l’escalfament a alta temperatura sense oxigen. jEliminació de substàncies inorgàniques. Les substàncies inorgàniques es poden eliminar de diferents maneres: precipitació, bescanvi iònic, electrodiàlisi, etc. La precipitació —que és el sistema més usual i econòmic— implica l’ús d’un reactiu que formi un compost inso­ luble en el medi (que generalment és aquós). Un exemple de precipitació senzill és l’elimi­ nació del crom(iii) procedent de l’adobament de la pell. Els efluents líquids amb crom es tracten amb calç apagada (hidròxid de calci, Ca(OH)2) i es forma hidròxid de crom(iii), Cr(OH)3, força insoluble i que precipita. Posteriorment, aquest precipitat s’asseca parcial­ ment i, finalment, es du a un abocador controlat. En aquestes condicions, el crom de l’hidròxid de crom(iii) és innocu si no se’l modifica a un estat superior d’oxidació. jEls bacteris, els protozous i altres microorganismes patògens s’eliminen generalment per oxidació amb clor gasós. jCompostatge. En tot procés de depuració d’aigües s’obtenen fangs de productes sedimen­ tats o flotants, que, de vegades, estan carregats de productes nocius. Si aquests llots són de matèria orgànica biodegradable i no contenen metalls pesants (Pb, Hg, Cd, Cr, etc.) o elements i compostos nocius (As, productes clorats orgànics, etc.) en quantitat apreciable, se’n pot obtenir fertilitzant mitjançant el compostatge. es Les aigües residuals que es depuren solen ser col.loïdals. Fig. 1.11. Abocament industrial nociu. w -h ill. Les concentracions dels contaminants químics generalment són molt petites i es poden ex­ pressar de diverses maneres. Per exemple: jEn parts per milió o ppm: parts de contaminant per milió de parts de dissolució, que equi­ val a mil.ligrams de contaminant per quilogram de solució. cg saxons, una ppb és la mil.lèsima part d’una ppm. ra jEn parts per bilió o ppb: una ppb és la milionèsima part d’una ppm. En els països anglo­ .m jUnitats de terbolesa: mesuren la transparència de la solució col.loïdal. w w jUnitats de pH: mesuren el comportament àcid o bàsic de la solució. jDBO5, DBO7 (demanda biològica d’oxigen) i DQO (demanda química d’oxigen): s’utilitzen w quan els contaminants són productes orgànics degradables bioquímicament o químicament. DBO i DQO estan relacionades amb la quantitat d’oxigen necessària per oxidar la matèria orgànica mitjançant bacteris o oxidants químics. L’anàlisi de les aigües exigeix la preparació al laboratori de solucions de diferents reactius. EXEMPLE 2 Per analitzar la sílice, SiO2, d’una aigua destinada a turbines de vapor, cal preparar una dissolució aquosa de molibdat d’amoni de concentració 0,4 mg/L. Expressa la concentració d’aquesta dissolució en mol/L (M) i parts per milió (ppm). Resolució La fórmula del molibdat d’amoni és (NH4)2MoO4, i la seva massa molecular, 196 g/mol. Calculem la molaritat de la dissolució: 0,4 ? 1023 g (NH4)2MoO4 1 mol (NH4)2MoO4 ——————————— ? ———————— 5 2,04 ? 1026 mol/L 5 2,04 ? 1026 M 196 g (NH4)2MoO4 1 L (NH4)2MoO4 En una dissolució tan diluïda com aquesta, podem considerar que la densitat és pràcticament la de l’aigua, és a dir, 1 g/mL. En aquestes condicions, els mg/L coin­ cideixen numèricament amb les ppm: 0,4 mg/L 5 0,4 ppm 01_quimica_2batx_008-030.indd 23 04/03/13 10:37 24 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES EXEMPLE 3 En un laboratori tenim una dissolució aquosa d’àcid sulfúric de densitat 1,813 kg/L i del 91,3 % en massa. Calcula’n la molaritat. Resolució Les dades que coneixem de la dissolució ens informen que: La massa d’1 L de dissolució és 1,813 kg 5 1 813 g. 100 g de dissolució estan formats per 91,3 g d’àcid sulfúric i 8,7 g d’aigua. 1 813 g H2SO4(aq) 1 mol H2SO4 91,3 g H2SO4 ———————— ? ———————— ? —————— 5 16,89 mol/L 1 L H2SO4(aq) 98 g H2SO4 100 g H2SO4(aq) La dissolució d’àcid sulfúric és 16,89 M. Es tracta, per tant, d’una dissolució força concentrada. w -h ill. jC. Contaminants sòlids es L’eliminació dels residus sòlids so­ vint és complicada i segueix una classificació de perillositat. Hi ha abocadors de diferents tipus se­ gons el residu. Per exemple, els productes radioactius s’han d’abo­ car en llocs especials extremament protegits i controlats, mentre que els residus hospitalaris perillosos cal eliminar-los per cremació a alta temperatura. Tots els aboca­ dors oficials estan molt controlats. ra Els residus sòlids, des del punt de vista químic, els podem classificar segons el seu origen, urbà o industrial, o segons el que contenen: cg jRadioactius. jMiners: poden ser inerts, com ara terres (generalment amb un fort impacte visual), o peri­ w w llosos, si contenen un percentatge elevat de metalls nocius (recordeu la catàstrofe del parc nacional de Doñana a causa de l’arsènic). jProvinents de laboratoris químics i de recerca. w Si els residus són molt perillosos, de vegades se’ls inertitza per vitri­ ficació introduint-los en vidre fos, que posteriorment és solidificat en refredar-se. Aquest és un procedi­ ment car. El vidre és un material extremament inert i els productes perillosos que conté hi resten blo­ quejats. .m jExplosius. jLlots de residus de pintures, de colorants, de rentats i buidats industrials, brossa domèstica i industrial. jEmbalatges difícils de biodegradar, plàstics, elastòmers (cautxú), pells, ferralla, encenalls, runes i fangs de tractament d’aigües. A C T I V I TAT S 13> Les calderes són generadors de vapor industrials que poden tenir aigua a tem­ peratures de 200 ºC en estat líquid. Com és possible? 14> L’ozó és un contaminant important de l’aire que respirem. Quantitats molt petites són suficients perquè sigui el responsable de molts processos de degra­ dació per oxidació de biopolímers. Què volem dir quan parlem de parts per bilió d’ozó en una atmosfera contaminada? Explica-ho amb detall. 15> Els mol.luscs, entre altra fauna marina, són especialment sensibles a la presèn­ cia del mercuri. Les cloïsses, escopinyes, navalles, musclos i ostres no es des­ en­volupen només que hi hagi 1 mg de mercuri per 100 t d’aigua. Com expressa­ ries adequadament aquesta concentració de mercuri? 01_quimica_2batx_008-030.indd 24 R: [Hg] 5 10 ppb 04/03/13 10:37 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 25 Activitats finals 1> Classifica els materials següents com a elements, observarem que l’envàs taronja de la bombona es glaça per la part de fora. A què és degut aquest efecte? mescles, substàncies pures, compostos argent calç guix alcohol tinta cautxú natural llautó benzina estany bronze cristall de quars sucre sabó aspirina sal pintura detergent diamant 11> El CO2 sublima a temperatura ambient. Quan el CO2 sò­ lid sublima a 760 mmHg (pressió atmosfèrica), manté una temperatura de 195 K (278 °C). El seu punt triple es troba a 5,11 atm i a 256,4 °C. a) Si volem fondre el CO2 sòlid, quina és la pressió mínima necessària perquè passi a l’estat líquid? 2> Quin procés fa possible que el fet de ventar-se refres­ b) A quina temperatura mínima ho farà? (El diagrama de fases del CO2 té una forma anàloga al de l’aigua; vegeu la figura 1.13.) qui la cara? 3> Tant la condensació com la solidificació alliberen ca­ lor. Quin procés allibera més calor? Per què? es p (mmHg) w -h ill. 4> Observa la figura del punt triple de l’aigua. a) Et sembla que és possible que es mantingui en es­ tat líquid a una pressió de 2,5 mmHg? líquid ra b) I a una pressió de 6 mmHg? .m sió inferior a 0,00603 atm (4,58 mmHg)? cg 5> És possible teòricament tenir aigua líquida a una pres­ gas sòlid 6> En quines condicions ha d’estar l’aigua perquè es w w mantingui en estat líquid a una temperatura inferior a 0 °C? w 7> Com es pot aconseguir que un filferro ben prim, del qual pengen uns pesos grans, travessi una barra de glaç industrial gruixuda sense que la barra es trenqui? Explica per què. (Vegeu la figura 1.12.) 3880 punt triple 760 195 216,4 T (K) Fig. 1.13. Diagrama de fases del CO2. 12> És possible que les substàncies es trobin en estat sò­ lid, líquid i gasós alhora? 13> En les condicions de vida habitual, quina és aproxi­ madament la pressió de vapor del gel quan fon? (Ob­ serva detingudament el gràfic de la figura 1.4 del punt triple de l’aigua.) Fig. 1.12 8> Com extrauries l’aigua del suc d’una taronja sense ha­ ver-la d’esprémer ni trinxar? 9> Per què el butà que hi ha a l’interior de les bombones es troba principalment en estat líquid i quan crema està en estat gasós? 10> Si connectem a una bombona de butà un bufador pistola apte per escalfar industrialment i l’encenem, 01_quimica_2batx_008-030.indd 25 14> Un procediment per refrigerar l’aigua calenta en els processos industrials és mitjançant les torres de re­ frigeració. Aquestes torres consisteixen en uns recin­ tes per on baixa aigua i es fa circular sobre materials sòlids apilats, de manera que formi una pel.lícula fina. En sentit ascendent s’impulsa un corrent d’aire. A la part inferior es recull l’aigua que s’ha refredat. L’aire que surt per dalt té un alt contingut d’aigua en forma de gas. Explica per què es refreda l’aigua líquida. 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 15> Calcula la quantitat de calor necessària per dur 3 kg 19> L’alcohol etílic té una temperatura d’ebullició de d’aigua líquida a 80 °C fins a vapor d’aigua sobrees­ calfat a 110 °C a pressió atmosfèrica. 78,5 °C. Tenim 1,8 L d’aquest producte, de puresa del 96 % i densitat de 0,807 g/mL, a aquesta temperatura. a) Quin pictograma porten els recipients d’alcohol etílic? Dades: Ce (aigua líquida) 5 4,18 kJ?kg21?K21; Ce (vapor aigua) 5 1,92 kJ?kg21?K21; lv 5 2 252,1 kJ?kg21 b) Què podries fer si volguessis eliminar aquesta quantitat d’alcohol etílic? R: 7 064,7 kJ c) Calcula l’energia que es necessitaria per vaporitzar aquesta quantitat d’etanol. 16> La taula 1.6 recull algunes temperatures i pressions crítiques de liquació: Tcrítica pcrítica 31 °C 73 atm Oxigen 2119 °C 50 atm Nitrogen 2147 °C 34 atm Hidrogen 2240 °C 13 atm Taula 1.6 Dades: lv (etanol) 5 870,7 kJ/kg; lv (aigua) 5 2 252,1 kJ/kg; Ce (aigua) 5 4,18 kJ/kg?K R: c) 1 214,19 kJ; d) 139,59 kJ 20> Segons la teoria cineticomolecular dels gasos, és pos­ Algun dels gasos que apareixen a la taula es podria liquar a temperatura ambient, 20 °C? sible que dos gasos a la mateixa temperatura puguin tenir diferent energia cinètica mitjana segons la seva fórmula molecular? ra w -h ill. Diòxid de carboni d) Calcula l’energia que es necessitaria per escalfar i vaporitzar la quantitat d’aigua que hi ha en els 1,8 L d’etanol del 96 % de puresa. es 01 26 17> Una de les innovacions culinàries dels darrers temps Si per dissoldre l’agar-agar cal escalfar 1 200 g d’aigua des dels 18 °C fins a la temperatura d’ebullició, res­ pon les qüestions següents: w w w .m cg és la introducció de la gelatina calenta en l’elabora­ ció de plats. La gelatina calenta s’obté fent bullir filaments d’agar-agar fins que es dissolen. a) Calcula la quantitat de calor que necessita l’aigua per assolir el punt d’ebullició. b) Si en acabar el procés queden 1 050 g d’aigua, cal­ cula la quantitat d’energia que ha necessitat l’ai­ gua que s’ha evaporat. c) Podem considerar la gelatina calenta com a matè­ ria homogènia? I com a substància pura? Raona la resposta. R: a) 411,312 kJ; b) 337,815 kJ 18> Per reciclar els metalls cal seleccionar-los i fondre’ls després per poder reutilitzar-los. Si tenim 2,13 tones de ferro a 1 813 K, que és la tem­ peratura de fusió del metall, quina quantitat d’ener­ gia cal aplicar per fondre’l totalment? Dades: lf (ferro) 5 200,9 kJ/kg R: 427 917 kJ 01_quimica_2batx_008-030.indd 26 21> Si la velocitat quadràtica mitjana es pot avaluar a partir fvvvvvvv 3 R T de l’equació 2 v 5 ———, on R 5 8,314 J?mol21?K21, M T és la temperatura absoluta en kelvin i M és la massa molar en kg?mol21, calcula la velocitat quadràtica mitjana de les molècules d’heli, de massa molecular 4 g?mol21 a 273 K de temperatura. R: 2 v < 1 305 m?s21 22> Entre els diferents contaminants gasosos podem in­ cloure-hi els freons. a) Què són aquests compostos? b) Quina problemàtica mediambiental creaven? 23> Cada dia es liqüen grans quantitats d’aire. Quina es po­ dria considerar la temperatura crítica d’aquest procés? 24> L’anàlisi de l’aigua d’un riu ens indica la presència de 2 mg de Hg per cada tona analitzada. Si la normativa internacional permet una presència, com a màxim, de 0,05 ppm de mercuri, estem dins la normativa me­ diambiental internacional? 25> Per fer una anàlisi d’aigües, cal preparar 500 mL d’una dissolució d’àcid clorhídric 0,3 M. L’ampolla d’àcid clor­ hídric que tenim al laboratori ens indica que és del 36 % i de densitat 1 180 kg/m3. 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES a) Quants mL de HCl calen per fer la preparació? Respon què passarà: b) Com ho faries al laboratori? I) Sortirà directament gas. R: 12,89 mL II) Sortirà directament líquid. d’àcid ortosilícic (H4SiO4) per cada litre d’aigua. Sa­ bries expressar aquesta concentració en molaritat? IV)Sortirà un sòlid amb una miqueta de gas, i el sòlid sublimarà progressivament. R: 3,12 ? 1025 M 27> L’alumini és un element tòxic en determinades aigües. La quantitat d’alumini permesa és de 5 ? 1026 g/L. Ex­ pressa aquesta concentració en molaritat, tenint en compte que la molècula present en l’aigua és Al(OH)3. Raona-ho mitjançant el diagrama de fases del CO2. c) És possible liquar el CO2 a una temperatura infe­ rior a 216,6 K? Raona-ho. d) Tenim CO2 a 315 K (a ple sol d’estiu) i 100 kPa. Què et sembla que passarà si el comprimim moltíssim? Raona-ho. R: 1,85 ? 1027 M 28> Explica les semblances i diferències entre punt crític es 31> Una concentració de 3 mg per litre de solució equival a: w -h ill. i punt triple. El clor és un gas que té un punt crític a 144 °C. Tenim clor a 425 K i el volem liquar. Què hau­ rem de fer? 27 III)Sortirà directament líquid que es vaporitzarà al cap de poc. 26> En l’aigua de mar hi ha una proporció de 0,003 g 01 a) 0,3 %. 29> Saps explicar de manera qualitativa què li passa a b) 3 ppm. una solució d’aigua una mica salada quan la refredem molt? ra c) 30 ppm. cg 30> Observa el diagrama de fases de la Fig. 1.14. Tenim w w .m CO2 a temperatura ambient. El comprimim a poc a poc (quasi a temperatura constant) fins a 6 100 kPa (61 atm aproximadament). w p (kPa) 7385 e) Cap de les anteriors. R: b) 3 ppm. 32> Disposem d’un pot de coure de 0,300 kg de massa. Hi aboquem 0,400 kg d’aigua. El pot i l’aigua estan a 288 K. A continuació hi afegim 0,200 kg d’un altre líquid que està a 333 K. Finalment la temperatura del conjunt és de 293 K. Les calors específiques del coure i de l’aigua són, respectivament, 389 i 4 186 J/(kg?K). Calcula la calor específica del segon líquid. Punt crític Líquid Sòlid R: Ce 5 1 119,4 J/(kg?K) 33> Tenim dos recipients a 300 K. Un conté heli i l’altre 517,6 conté nitrogen. Les pressions d’un i altre són, res­ pectivament, 200 kPa i 300 kPa. Coneixem les equa­ cions que fan referència a l’energia cinètica de les molècules: 101,3 Gas 194,7 216,6 304,2 T (K) Fig. 1.14. Diagrama de fases del CO2. a) Què li passa? b) Un cop comprimit i a temperatura ambient el des­ comprimim sobtadament fins a la pressió atmosfè­ rica (101,3 kPa); ho fem de forma molt ràpida. En fer-ho la temperatura del CO2 baixa dràsticament. 01_quimica_2batx_008-030.indd 27 d) 0,3 ppb. 2 3 1 2 Ec 5 — ? k ? T i Ec 5 — m v 2 en què v és la velocitat 2 2 mitjana de les molècules i k és la constant universal de Boltzmann, que val 1,38 ? 10223 J/K. Considerem els dos gasos amb comportament ideal. L’heli té una massa atòmica de 4 uma i el nitrogen, diatòmic, té una massa molecular de 28. Indica quin dels dos gasos té les molècules amb una energia cinètica més alta. Raona-ho. 04/03/13 10:37 01 28 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES Prepara la selectivitat 1> A partir de la figura, on es mostra el diagrama de fases Dades: de l’aigua, contesteu raonadament les qüestions. Densitat de l’aigua (entre 10 °C i 45 °C) 5 1 kg L21. Capacitat calorífica específica de l’aigua (entre 10 °C i 45°C) 5 4,18 (J K21 g21). p (atm) Massa molecular relativa del metà 5 16,0 g/mol Punt crític 218 3> Mitjançant el procés d’electròlisi de l’aigua es poden Líquid Sòlid obtenir hidrogen i oxigen gasosos. 1 Gas 0,006 Punt triple b) Escriviu les equacions de les semireaccions que te­ nen lloc en cadascun dels elèctrodes. 624 4> [Curs 09-10] En fer l’electròlisi de clorur de liti fos, T (K) LiCl, s’obté Cl2 a l’ànode i Li al càtode. es 273,15 273,16 373 a) Indiqueu el material que necessitaríeu per dur a terme aquest procés al laboratori i feu un esquema del muntatge experimental. Diagrama de fases de l’aigua b) Quina polaritat tenen els elèctrodes? cg ra a) Quin és el significat del punt triple? A quina tem­ peratura congela l’aigua a 1 atm de pressió? Si aug­ mentem la pressió, la temperatura de congelació serà més alta o més baixa? a) Escriviu el procés que té lloc en cadascun dels elèc­ trodes i indiqueu quin és el procés d’oxidació i quin el de reducció. w -h ill. Fig. 1.15. Diagrama de fases de l’aigua. 5> [Curs 11-12] Els diagrames de fases són representa­ w w .m b) En quines condicions de pressió sublima l’aigua sòlida? A quina temperatura bull l’aigua a 1 atm de pressió? Si augmentem la pressió, la temperatura d’ebullició serà més alta o més baixa? w vida és el metà, component principal del gas natural, que és un bon combustible. A partir de les dades de la taula 1.7, responeu a les qüestions. Sòlid Entalpia de combustió (kJ?mol21) CH4(g) 1 2 O2(g) f CO2(g) 1 2 H2O(l) 2890,3 C(s) 1 O2(g) f CO2(g) 2393,5 H2(g) 1 1/2 O2(g) f H2O(l) 2285,8 Aigua Aigua p 2> [Curs 10-11] Un dels gasos més presents en la nostrap Reacció de combustió cions gràfiques de les condicions de pressió i tempera­ tura que fan que una substància estigui en estat sòlid, líquid o vapor. Els perfils d’aquests diagrames per a l’aigua i per al diòxid de carboni són els següents: Diòxid de carboni Diòxid de carboni p p Líquid Sòlid Líquid Sòlid Vapor Vapor T Líquid Sòlid Líquid Vapor T Vapor T Punt triple: T 5 273 K i p 5 0,611 kPa Punt triple: T 5 216 K i p 5 517,6 kPa Taula 1.7. Entalpies de combustió en condicions estàndard i a 298 K. Fig. 1.16a. Diagrama de fases de l’aigua. Fig. 1.16b. Diagrama de fases del diòxid de carboni. a) Imagineu que us voleu dutxar amb l’aigua a una temperatura de 45 °C. Tenint en compte que l’ai­ gua entra a l’escalfador a 10 °C i que en gastareu 30 L, digueu quina massa de metà cal cremar, a pressió constant, per escalfar-la. a) Què representen les línies que apareixen en un dia­ grama de fases? Expliqueu raonadament com varia la temperatura de fusió de les dues substàncies en augmentar la pressió. b) Escriviu la reacció corresponent a l’entalpia estàn­ dard de formació del metà, i calculeu-ne el valor a 298 K. 01_quimica_2batx_008-030.indd 28 T b) Justifiqueu el fet que, a pressió atmosfèrica (101,3 kPa), l’aigua pot passar de sòlid a líquid i de líquid a vapor, modificant la temperatura, mentre que amb el diòxid de carboni no passa el mateix. 04/03/13 10:37 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES 01 29 Pràctiques Les pràctiques proposades es poden fer a casa o al laboratori del centre. La cristal.lització de l’aigua salada (a casa) Objectiu Observar com es comporta una dissolució en baixar-ne la temperatura. Què els passa al dissolvent i al solut. Normes de seguretat El risc és mínim. No hi ha cap norma de seguretat es­ pecífica per realitzar aques­ ta pràctica. Material —Un got no gaire gran i de base ampla. —Aigua i sal de cuina. Procediment w -h ill. es —Un congelador de magatzem o bé una nevera combi, que tinguin tres o quatre estrelles de fred (cal assolir i encara millor si aconseguim temperatures inferiors a 222 °C). jEn un gotet poseu-hi aigua. Pot ser destil.lada de la planxa; si no, aigua de l’aixeta. ra Poseu-hi una culleradeta de sal. Remena i dissol la sal. cg jPoseu aquesta dissolució en un gotet de base ampla i deseu-lo al calaix del congela- .m dor. Procureu tancar amb cura el calaix. Si és una nevera tipus combi, assegureu-vos que està treballant a la màxima potència de fred, que acostuma a ser de 223 °C. Gestió de residus Els residus d’aquesta pràc­ tica no són tòxics. Es po­ den abocar pel desguàs. w Anàlisi de resultats w w jObserveu què ha passat al cap d’unes quantes hores. jObserveu que el got està tot glaçat amb gel (d’aigua sola) adherit a les parets. Si teniu una mica de sort (de vegades no surt bé), veureu que al centre hi ha uns cristallets diferents del glaç d’aigua. Aquests cristalls són de sal de cuina cristal.litzada, no pas d’aigua. Exactament són de NaCl 2 H2O. jQuan una dissolució es congela, el dissolvent i el solut solidifiquen per separat l'un de l’altre. L’aigua i la sal solidifiquen, però ho fan separadament. jCerca a la bibliografia a quina temperatura se solidifica una dissolució saturada d’aigua salada. 01_quimica_2batx_008-030.indd 29 04/03/13 10:37 30 01 CLASSIFICACIÓ DE LA MATÈRIA. LES SUBSTÀNCIES PURES L’electròlisi de l’aigua (al laboratori) Normes de seguretat Cal anar amb molt de comp­ te, ja que l’hidrogen és ex­ plosiu. Per tant, cal vetllar perquè no se’n produeixi gaire quantitat i perquè no hi hagi cap flama a prop. Objectiu Separar els elements d’un compost mitjançant l’electròlisi. L’aigua es compon d’hidrogen i oxigen. L’electricitat subministra l’energia suficient per separar aquests dos components. Material —Vas de precipitats de 500 mL —Una pila de 4,5 V o una font d’alimentació —Una mica de sal de cuina —Dos elèctrodes de carbó —Pinces de cocodril Procediment es Els residus d’aquesta pràc­ tica es poden abocar per la pica amb aigua abundant, perquè no són tòxics. —Cable conductor —Aigua destil.lada jAboqueu una mica d’aigua destil.lada al vas de precipitats. w -h ill. Gestió de residus jDissoleu-hi una mica de sal i remeneu-ho. jConnecteu un conductor a cada born de la pila. ra jIntroduïu els altres dos extrems dels conductors a la solució aquosa. cg jSi treballeu amb font d’alimentació, apliqueu-hi uns quatre volts i mig de tensió en cor­ w w w .m rent continu. Podeu graduar la intensitat segons la resistència que la solució ofereix a la conducció elèctrica. ànode O2 – e càtode H2 e– dissolució de NaCl Fig. 1.17. Electròlisi de l’aigua. Anàlisi de resultats jObserveu que es formen petites bombolles al voltant de cada elèctrode, que es van acu­ mulant dins dels tubs d’assaig. A l’elèctrode negatiu, càtode, es desprèn hidrogen gasós, i al born positiu, ànode, es forma oxigen. Com comprovaries si realment s’acumulen aquests gasos en els borns que s’han especificat? jPer què el volum d’hidrogen és el doble que el d’oxigen? jPer què s’afegeix sal a l’aigua destil.lada del vas de precipitats? 01_quimica_2batx_008-030.indd 30 04/03/13 10:37 Telf. contacto: 902 656 439 www.mghbooks.com w w w .m cg ra w -h ill. es McGraw-Hill te facilita disponer de tus eBooks y libros ¡No esperes más para tenerlos! tenerlos! Un sistema rápido y cómodo al recibirlo en tu tu domicilio Contacta con MGHbooks www.mghbooks.com DBM – MGHbooks: Distribuidor de ebook y venta tradicional McGraw-Hill y DBM Logistic colaboran gestionando la librería virtual www.mghbooks.com En esta página web puedes disponer de nuestro fondo actualmente activo