Estructura del material genético
Anuncio
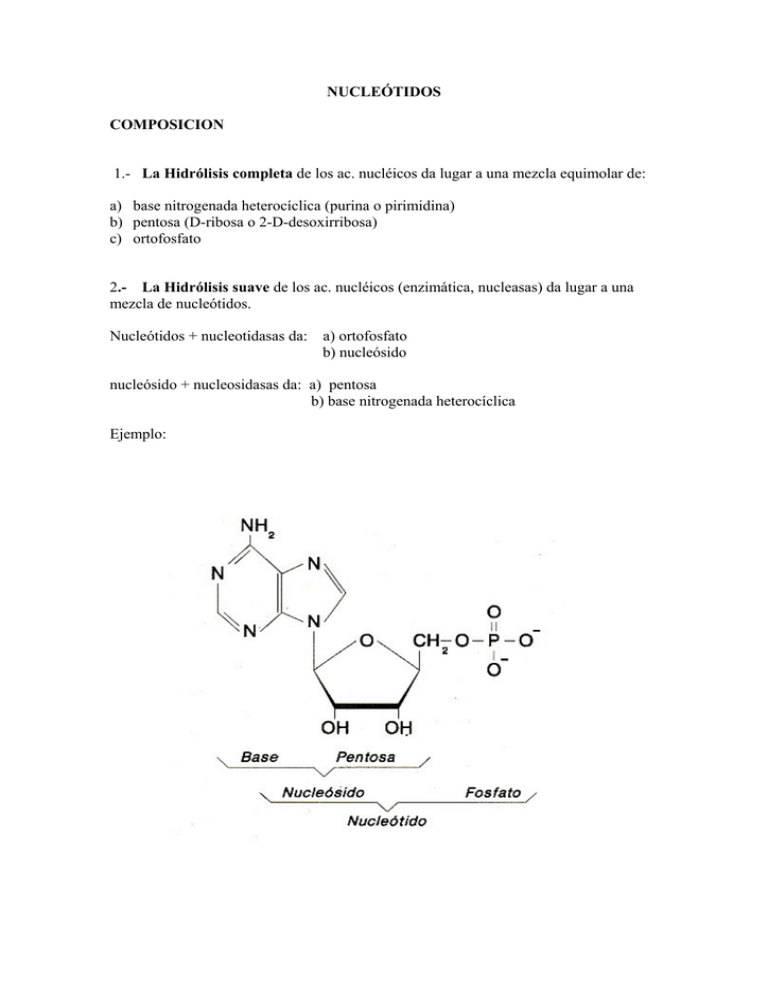
NUCLEÓTIDOS COMPOSICION 1.- La Hidrólisis completa de los ac. nucléicos da lugar a una mezcla equimolar de: a) base nitrogenada heterocíclica (purina o pirimidina) b) pentosa (D-ribosa o 2-D-desoxirribosa) c) ortofosfato 2.- La Hidrólisis suave de los ac. nucléicos (enzimática, nucleasas) da lugar a una mezcla de nucleótidos. Nucleótidos + nucleotidasas da: a) ortofosfato b) nucleósido nucleósido + nucleosidasas da: a) pentosa b) base nitrogenada heterocíclica Ejemplo: BASES NITROGENADAS DESCRIPCION Bases nitrogenádas heterocíclicas que pertenecen a dos tipos fundamentales: 1.- purinas 2.- pirimidinas ejemplo: 1.- Bases púricas: Adenina, Guanina (DNA y RNA) Hipoxantina, Xantina y ac. Urico (metabolismo). 2.- Bases pirimidínicas: Citosina (DNA y RNA), Timina (DNA) Uracilo (RNA); además ac. Orótico y dihidroorótico ( metabolismo). Abreviaturas ADENINA (A) GUANINA (G) HIPOXANTINA ( I ) CITOSINA (C) URACILO (U) TIMINA (T) OTRAS BASES 1.- Bases modificadas se encuentran preferentemente en el RNA y particularmente en el tRNA. a) metilaciones; metiladas o dimetiladas b) Isopentenil derivados c) Tioderivados; sobre todo en las pirimidinas 2.- Productos naturales: grupo importante con estructura de base púrica son las metilxantinas; cuya acción farmacológica más importante es la de inhibir la fosfodiesterasa de cAMP prolongando la acción de este segundo mensajero hormonal. 3.-Análogos sintéticos de bases; que se emplean como agentes antineoplásicos que actúan por mecanismos de competitividad, o bien como agentes mutagénicos. PROPIEDADES FISICO-QUIMICAS DE LAS BASES 1.- Disposición coplanar de los enlaces. Son planas porque los C tienen orbitales moleculares sp2 (tres orbitales moleculares en un plano y uno ρ perpendicular que sirve para formar el doble enlace). Lógicamente, es una estructura resonante. 2.- Poco solubles en agua. El carácter hidrófobo viene dado por la naturaleza aromática de los anillos purínicos y pirimidínicos. Por tanto, son insolubles en agua a pH fisiológico. 3.- Dipolos. Las bases tienen átomos muy electronegativos (N y O) dentro y fuera del anillo aromático, por lo que existe una distribución asimétrica de los electrones en la molécula y, por tanto, se forman dipolos que permiten formar puentes de hidrógeno. De todos los posibles, los más importantes son los que van a servir para formar los puentes de hidrógeno de Watson y Crick para formar el DNA bicatenario a pH7. A diferente pH, la estructura se debilita al cambiar la disposición electrónica de las bases: por protonación a pH ácido, o por desprotonación a pH básico. 4.- Carácter débilmente básico. Todas las bases nitrogenadas son bases débiles al ser desprotonables a pH entre 9 y 10, por lo que a pH intracelular carecen de carga eléctrica significativa. Aunque los grupos ceto (C=O) pueden tautomerizar a enol (C–OH), perder el proton y conferir cierta acidez. La Adenina al no tener ningún grupo ceto, es la más básica de todas. Caso extremo es el del ácido úrico, que, a pesar de ser una base nitrogenada, tiene carácter ácido debido a los tres grupos ceto que contiene. pKa de algunas bases nitrogenadas Base grupo pKa 1 Uracilo N 9.5 Timina N1 9.9 1 Guanina N 9.5 Guanina N7 3.2 3 Citosina N 4.5 Adenina N1 4.2 5.- Presentan tautomería. Watson y Crick postularon la tautomería de las bases para explicar que se puedan aparear de manera distinta a la que ellos proponían y generar mutaciones espontáneas. Hoy se sabe que dichas formas existen debido a la migración de los electrones por los dobles enlaces conjugados. Hay dos tipos de tautomería: Tautomería ceto-enólica (lactama-lactima) Interconvierte un grupo ceto (=O) y enol (—OH) extracíclicos cerca de un N cíclico. Se puede producir en la G, C, T y U. Las lactimas imprimen un fuerte carácter ácido a las bases. Tautomería imina-amina Interconvierte un amino (—NH) extracíclico en un imino (=NH) cerca de un N cíclico. Se puede dar en G, A y C. _ 6.-Presentan un espectro de absorción característico, con máximos de absorción diferentes según las bases, pero centrados todos ellos en torno a los 260 nm. 7.- Reacciones químicas de las bases a) Desaminación. Por ejemplo inducídas por el ac. nitroso ó hidroxilamina (citosina) adenina guanina y citosina. La desaminación produce los oxo-derivados: hipoxantina, xantina y uracilo. b) Alquilación. Agentes alquilantes: sulfato de metilo, que produce o-metil guanina; otros agentes alquilantes son la dimetil nitrosamina y la mostaza nitrogenada. LOS NUCLEOSIDOS. Estructura a) Base nitrogenada + pentosa N-glicósido (Nucleósido) b) Enlaces β entre: C1 de la pentosa y N1 de las pirimidinas ó el N9 de las purinas. c) La pentosa es invariablemente en forma furanósica y la conformación del enlace glicosídico puede ser tanto syn- como anti- (se refiere a la situación relativa de los anillos de base y pentosa; siendo syndel mismo lado y anti del lado contrario). β-N-glicosídico NOMENCLATURA 1- Purinas – nombre del radical de la base + el sufijo -osina 2- Pirimidinas - nombre del radical de la base + el sufijo -idina 3- Para la 2-D-desoxirribosa se antepone el prefijo desoxi + nombre del ribonucleósido 4- Los carbonos de la pentosa se numeran como 1’, 2’, 3’, 4’ y 5’ para distinguirlos de los átomos de la base. Propiedades químicas 1.- Aumento de la solubilidad con respecto a las bases. 2.- La presencia de la pentosa permite la cuantificación de los nucleósidos basados en reacciones de deshidratación del anillo furanósico. Así, los ribósidos pueden ser cuantificados por la reacción del orcinol; y los desoxirribósidos por la reacción de la difenilamina. Estas reacciones son aplicables también a los nucleótidos y a los ac. nucléicos. 3.- La estructura de nucleósido no modifica para nada las características de absorción de luz ultravioleta a 260 nm propias de las bases nitrogenadas. Otros nucleósidos: 1.- Nucleósidos anormales en ac. nucleicos normales. Seudouridina (ψ) se forma entre el uracilo y la ribosa mediante un enlade glucosídico especial entre el C1' y el C5. Forma parte del brazo TψC del tRNA. Inosina. Ribosa unida a hipoxantina. Interviene en el metabolismo de las purinas y aparece en algunos tRNAs 2.- Nucleósidos naturales. Por ejemplo la espongouridina y la espongotimidina presentes en las esponjas donde la pentosa es arabinosa. Asi mismo, los antibióticos cordicepina y puromicina. 3.- En terapéutica antineoplásica tambien se utilizan multitud de análogos estructurales de nucleósidos. Por ejemplo el citosin arabinósido. NUCLEÓTIDOS Generalidades y nomenclatura 1.- La esterificación de grupos –OH presentes en la pentosa de un nucleósido con ortofosfato, pirofosfato o polifosfatos da lugar a las estructuras llamadas nucleótidos. Los ribósidos: tienen tres posibilidades; los carbonos 2’, 3’ y 5’ dando lugar a 2’, 3’, y 5’ nucleótidos respectivamente. Los desoxirribósidos : tienen dos posibilidades; los carbonos 3’ y 5’ dando lugar a los 3’ y 5’ desoxirribonucleótidos. En ocasiones, el mismo grupo fostato aparece esterificando a dos carbonos distintos en la misma pentosa de un nucleósido se forman así los nucleótidos cíclicos. El nombre sistemático de los nucleótidos se forma con 1.- El nombre del nucleósido 2.- Seguido del carbono esterificado a fosfato 3.- Terminado en –monofosfato,-difosfato o –trifosfato en su caso. Abreviaturas Ribonucleótidos (1) El número del carbono esterificado por fosfato (2) La letra de la base (3) el número de fosfatos que esterifican. Por ejemplo 5’-AMP, 5’-ADP y 5’-ATP. desoxirribonucleótidos Se antepone a la abreviatura del ribonucleótido correspondiente una “d” minuscula por ej. 5’-dAMP. Existe así mismo una nomenclatura especial para los 5’-ribonucleósidos monofosfato, que consiste en añadir el sufijo ílico al nombre radical de la base, en el caso de las purinas, o del nucleósido en las pirimidinas. Así: Adenina ac. adenílico 5’-AMP Guanina ac. guanílico 5’-GMP Citidina ac. citidílico 5’-CMP Uridina ac. uridílico 5’-UMP etc. Propiedades fisico-químicas 1.- Todos poseen un fuerte carácter ácido a pH fisiológico presentando carga negativa Constantes de ionización de los ribonucleótidos expresadas en forma de valores de pKa 2.- Presentan un máximo de absorbancia en torno a los 260 mm debido a la base nitrogenada. 3.- La presencia de fosfato incrementa aún más la solubilidad respecto a los nucleósidos. 4.- Los nucleótidos se separan fácilmente por procedimientos cromatográficos. Anexos Pauta de protonación de un nucleótido a diferentes pHs Funciones biológicas 1.- Depósitos de energía libre. Ejemplo ATP y GTP: Fosfatos Proporciona el carácter eminentemente ácido del DNA y del RNA. Los 5 enlaces del ortofosfato están en resonancia, de manera que la distribución espacial es equivalente a una molécula tetraédrica con orbitales moleculares sp3. Cuando el fosfato se encuentra sustituido por algún radical, sólo tenemos el pK1 y el pK2. Cuando tenemos dos sustituyentes, nos queda sólo el pK1. Los difosfatos o pirofosfatos se presentan a pH fisiológico como un trianión, siendo estables en disolución a pH neutro o alcalino. Sin embargo, dentro de las células es muy inestable y accesible a las pirofosfatasas que lo descomponen en dos monofosfatos. Los trifosfatos siempre forman parte de un nucleósido, nunca están libres El enlace que une los dos átomos de fósforo a través de un átomo de oxígeno es un enlace anhídrido del tipo fosfoanhídrido (no confundir los enlaces fosfoanhidro —entre dos ácidos— con el enlace fosfoéster —entre alcohol y ácido— que es mucho menos energético). La hidrólisis de estos enlaces es altamente exergónica (∆Gº' = –31 kJ/mol). Parte de esta alta energía se debe a: 1.- La energía de resonancia de los anhidro de ácidos, como los polifosfatos, es considerablemente menor que las de sus productos de hidrólisis, lo que quiere decir que éstos son más estables que el anhídrido primitivo. 2.- El ATP y compuestos análogos existen como polianiónes. La repulsión electrostática entre las cargas negativas de los oxígenos tiende a desestabilizar la estructura del polifosfato. 3.- La solvatación diferencial entre los polifosfatos y sus productos de hidrólisis es otro factor que favorece la hidrólisis de los mismos. Procesos celulares que requieren energía libre ATP GTP Biosíntesis Síntesis de proteínas Transporte en contra de gradiente Procesos de traducción de señales Energía mecánica (contracción muscular) Bioluminiscencia, etc. 2.- La unión covalente de sustratos a nucleótidos representa en muchas ocasiones las formas metabólicamente activas de aquéllos. Ejemplos: Síntesis de glucógeno Sintesis de lípidos complejos Activación de los ac. grasos Activación de los aa en la sint. de proteínas Precursor: Uridin difosfato glucosa (UDPG) Precursor: Citidin difosfato colina (CDP-colina) Forma metabolicamente aciva: Acil-CoA Aminoacil-adenilato: aa-AMP 3.- Los nucleótidos operan como coenzimas en multitud de reacciones enzimáticas. Por ejemplo: NAD+ y NADP+, FMN y FAD 4.- Los nucleótidos cíclicos, como el cAMP y el cGMP operan como segundos mensajeros intracelulares de multitud de señales químicas (hormonas y neurotransmisores. Tipos de ácidos nucleicos: DNA y RNA 1) composición. A) región variable, bases nitrogenadas B) región constante, azúcar fosfato Nucleósidos, nucleótidos y polinucleótidos. Enlace fosfodiéster: Formación del enlace. Variación de energía libre a) simple deshidratación b) precursores de alta energía Energía libre estándar (∆G0) Reacciones 1) d NTP + H2O d NMP + PPi -31 Kj/mol 2) polinucleótido n + d NMP polinucleótido (n+ 1) + H2O +25 Kj/mol +) polinucleótido n + d NTP polinucleótido (n + 1) + PPi - 6 Kj/mol 3) PPi + H2O 2Pi - 33 Kj/mol Características de los polinucleótidos 1) Los polinucleótidos poseen un sentido o polaridad, el enlace fosfodiéster entre las unidades monoméricas se produce entre el carbono 3’ de un monómero y el carbono 5’ del siguiente; normalmente poseen un extremo 5’ fosforilado y el otro extremo un grupo hidroxilo 3’ libre. 2) Los polinucleótidos poseen una secuencia de bases característica, esta secuencia se denomina estructura primaria. Representación convencional de los polinucleótidos Polinucleótido Desoxinucleótidos Bases Azúcar Esta anotación indica: 1) la secuencia ACGTT 2) los enlaces fosfodiéster son entre hidroxilos 3’ y fosfatos 5’ 3) tiene un extremo 5’ fosforilado y un grupo hidroxilo 3’ libre 4) que la secuencia es de DNA por la presencia de las T Una notación más abreviada de la misma molécula es pApCpGpTpT si sólo nos interesa la secuencia de bases ACGTT Propiedades químicas de los polinucleótidos 1) los polinucleótidos absorben luz UV con un máximo entorno a los 260 nm Aplicaciones: a) índice A260/A280 b) proceso de desnaturalización 2) la presencia de las pentosas hace que den positivo a varias reacciones características de estas DNA---------------------- difenilamina RNA-----------------------orcinol 2-D-desoxirribosa--------reactivo de schiff 3) los colorantes del tipo de las acridinas son capaces de intercalarse entre los planos de las bases del DNA y RNA, dando lugar a complejos fluorescentes que pueden detectarse cuando se estimulan a la longitud de onda adecuada (bromuro de etidio) 4) el tratamiento con ácido fuerte hidroliza tanto el DNA como el RNA; sin embargo, el tratamiento con álcali solo hidroliza el RNA. La degradación alcalina produce una mezcla de 2’ y 3’ nucleótidos en dos reacciones consecutivas 1 KOH Alcali 2 5) Al tratar un polinucleótido de DNA con sulfato de metilo tiene lugar la metilación de las purinas (guanina en N7 y adenina en N3 en general). Si a continuación calentamos a pH neutro, se rompe el enlace glicosídico entre la desoxirribosa y la base modificada, quedando un hueco apurínico. El tratamiento afecta predominantemente a los nucleótidos de guanina. Si tras la metilación tratamos con ácido mineral diluído, el enlace glicosídico se rompe preferentemente por los nucleótidos de adenina.- En uno y otro caso, el tratamiento posterior con álcali rompe la cadena polinucleotídica en el lugar en que se eliminó la base. En el caso de las pirimidinas, el tratamiento con hidrazina da lugar a un ácido apirimidínico. El tratamiento posterior con piperidina rompe el enlace ribosa-fosfato en los lugares en los que se desprendió la pirimidina. Si el tratamiento se realiza en presencia de cloruro sódico, sólo se desprende la citosina. Tanto esta reacción como la anterior, pueden llevarse a cabo en condiciones bastante específicas para cada base. Estas reacciones son de gran interés ya que son el fundamento del método de secuenciación de Maxan-Gilbert Degradación enzimática de los polinucleótidos El enlace fosfodiester puede romperse de dos maneras Rotura tipo a entre el 3’-OH y el fosfato Rotura tipo b entre el fosfato y el 5’ mezcla de 5’-nucleótidos mezcla de 3’-nucleótidos Existen gran cantidad de enzimas capaces de degradar ac. nucléicos. Genéricamaente reciben el nombre de nucleasas, y su nombre químico correcto sería el de fosfodiesterasas. Todas ellas rompen hidroliticamente el enlace fosfodiester. Clasificación: 1) Exonucleasas. Ejercen su acción en los enlaces situados en los extremos de la cadena polinucleotídica y van progresando hacia el interior. 2) Endonucleasas. Rompen enlaces fosfodiester situados en el interior de la cadena polinucleotídica El DNA ES EL PORTADOR DE LA INFORMACIÓN GENÉTICA DYSCOVERY OF DNA: FRIEDRICH MIESCHER (1844-1895) "Miescher had originally intented to study lymphocytes, but he soon realized that it would be impossible to get enough of these cells. Encouraged by Hoppe-Seyler, he instead focussed on leucocytes, known to be the main cellular constituent of the laudable pus that could be obtained fresh every day from used bandages in the nearby hospital. The trick was to wash the cells without damaging them. To this end Friedrich tried various salt solutions, but the cells swelled and gave rise to a highly viscous porridge that was impossible to handle. In hindsight it is easy to see that this occurred because he extracted high-molecularweight DNA from damaged cells. Eventually he hit on a dilute solution of sodium sulfate as the best way to rinse well-preserved cells from the bandages. After filtration to get rid of tissue fibers, the cells were left to sediment to the bottom of the beaker; laboratory centrifuges were nonexistent in those days. When examined in the microscope, the leucocytes seemed intact and showed no sign of damage." "His first task was to isolate undamaged nuclei free of cytoplasm. This had never been accomplished before and only after long hours of hard work did Miescher come up with reasonable quantities of nuclei in good conditions. He tried several methods, but his final procedure was as follows. Miescher first treated the cells with warm alcohol to remove lipids, and then digested away the proteins of the cytoplasm with the proteolytic enzyme pepsin. What he used was not a pure preparation of crystalline pepsin, as would be used today; nothing comparable was available. Instead, he extracted pig's stomach with dilute hydrochloric acid, which gave him an active but highly impure enzyme that he used for his digestions. The pepsin treatment solubilized the cytoplasm and left the cell nuclei behind as greyish precipitate... He subjected his purified nuclei to the same alkaline extraction procedure he had previously used with the whole cells, and on acidification he again obtained a precipitate. Obviously this material must have come from the nucleus, and he therefore named it nuclein. Using elementary analysis, one of the few methods available to characterize an unknown compound. Miescher found that his new substance contained 14 % nitrogen, 3 % phosphorus, and 2 % sulfur. Its comparatively high phosphorus content and its resistance to digestion with pepsin suggested that the substance was not a protein. (At the same time, its appreciable content of sulfur immediately indicates to us today that his preparation did contain substantial amounts of proteins.)" 1) Células blancas (linfocitos y polimorfos nucleares) 2) Lísis alcalina, ácida ó enzimática 3) Obtención de núcleos 4) Extracción con álcali 5) Precipitar con ácido 6) Análisis químico elemental: 14 % N, 3 % P y 2 % S Frederick Griffith In 1928 an army medical officer named Frederick Griffith was trying to find a vaccine against streptococcus pneumoniae, but instead made a breakthrough in world of heredity. He did four experiments in which he injected strands of bacteria into mice, one strand that was harmless (R) and one that was harmful (S). 1) In his first experiment, he injected the live R bacteria cells into the mice and the mice lived. 2) In his second experiment, he injected the live S bacteria cells into the mice and mice died. 3) In his third experiment, he killed the harmful S cells with extreme heat, and then injected the dead S cells into the mice and the mice lived. 4) In his last experiment, he added live R cell (which are harmless) to the already dead heat-killed S cells, and then injected it into the mice, but the mice died! Griffith found from this experiment that even though he had killed the S cells, he hadn’t destroyed their hereditary material, which was the one part that caused the disease! When some more experiments had been done, it had been discovered that the harmless R cells, had used the information from the hereditary material of the dead S cells and became harmful; this he called, hereditary transformation. (Oh and by the way… he never did find the vaccine.) Transformación de los neumococos R por la acción de un extracto libre de células de neumococos S muertos por calor. “ In Vitro” Fraccionamiento del extracto celular de los neumococos S muertos por calor y búsqueda de la naturaleza química del “ Principio Transformador “, en las diferentes fracciones Conclusiones: 1) El principio transformador purificado con elevada actividad dió un análisis químico elemental que concordaba estrechamente con el calculado para el DNA. 2) Las propiedades ópticas, de ultracentrifugación, difusión y electroforésis del material purificado fueron semejantes a las del DNA. 3) No se perdió la actividad transformadora al realizar la extracción de proteínas o lípidos. 4) La tripsina y quimotripsina no afectan a la actividad transformadora. 5) La ribonucleasa (degrada el RNA) no tenía ninguna acción sobre el principio transformador. 6) En cambio la actividad transformadora fue perdiéndose por la acción desoxirribonucleasa. The Hershey and Chase experiment that supported DNA as the hereditary material The breakthrough in the quest to determine the hereditary material came from the work of Max Delbruck and Salvador Luria in the 1940s. Bacteriophage are a type of virus that attacks bacteria, the viruses that Delbruck and Luria worked with were those attacking Escherichia coli, a bacterium found in human intestines. Bacteriophages consist of protein coats covering DNA. Bacteriophages infect a cell by injecting DNA into the host cell. This viral DNA then "disappears" while taking over the bacterial machinery and beginning to make new virus instead of new bacteria. After 25 minutes the host cell bursts, releasing hundreds of new bacteriophage. Phages have DNA and protein, making them ideal to resolve the nature of the hereditary material In 1952, Alfred D. Hershey and Martha Chase conducted a series of experiments to determine whether protein or DNA was the hereditary material. By labeling the DNA and protein with different (and mutually exclusive) radioisotopes, they would be able to determine which chemical (DNA or protein) was getting into the bacteria. Such material must be the hereditary material (Griffith's transforming agent). Since DNA contains Phosphorous (P) but no Sulfur (S), they tagged the DNA with radioactive Phosphorous-32. Conversely, protein lacks P but does have S, thus it could be tagged with radioactive Sulfur-35. Hershey and Chase found that the radioactive S remained outside the cell while the radioactive P was found inside the cell, indicating that DNA was the physical carrier of heredity. T2 phage El RNA como material genético: Virus del mosaico del tabaco En 1956, Gierer y Schramm purificaron el ácido nucleico ( ssRNA + ) del virus del mosaico del tabaco (VMT), y demostraron que ARN viral purificado podía ser infeccioso si se tomaban las precauciones necesarias para protegerlo de ser inactivado por la acción de enzimas capaces de degradar ácido ribonucleico. Experimentos previos habían demostrado que las partículas de VMT podían ser disociadas en proteína y ARN, ambos componentes podían ser reasociados en el tubo de ensayo para formar partículas virales infectivas por completo y morfológicamente maduras. Basándose en esta observación, Frankel-Conrat y Singer procedieron a disociar dos cepas diferentes de VMT. El ARN obtenido de una cepa fue reasociado con la proteína obtenida de la otra cepa y viceversa, originando partículas híbridas, las cuales fueron usadas para infectar plantas de tabaco. En todos los casos, las plantas infectadas dieron origen a progenies virales que correspondían al tipo del ARN presente en el híbrido utilizado para la infección. El experimento de Frankel-Conrat y Singer que demostró que el ARN es el material genético del virus del mosaico del tabaco (VMT). Estudios comparados sobre la composición en bases del DNA Mediante procedimientos cromatográficos de partición Chargaff estudió la composición en bases del DNA de diferentes procedencias. Erwin Chargaff was a biochemist who first figured out the equation for the different bases. Here is what he concluded: The amount of (A)denine will always equal the amount of (T)hymine. The amount of (G)uanine will always equal the amount of (C)ytosine. Especie Hombre Levadura Mycobacteria Vaca A 0.29 0.30 0.12 o.26 G 0.18 0.18 0.28 0.24 C T 0.18 0.15 0.26 0.23 0.31 0.29 0.11 0.27 Las conclusiones más importantes fueron las siguientes : 1) En todos los DNAs estudiados, las proporciones de las bases varían según las especies estudiadas. 2) La composición en bases era constante para cada especie, y para diferentes tejidos dentro de la misma especie. 3) En todas las especies estudiadas, la proporción molar de purinas era igual a la proporción molar de pirimidinas; es decir, A + T = G + C ó que la relación purina/pirimidina es igual a 1. 4) En el DNA de todas las especies estudiadas, la proporción molar de adenina era igual a la proporción molar de timina A = T; y la proporción molar de guanina igual a la de citosina G = C. Diagrama de difracción de rayos X del DNA. La repetición (c) de la hélice es la distancia paralela al eje en la que la estructura se repite exactamente. La repetición contiene un número entero (m) de residuos del polimero. En la figura m = 4. El paso (p) de la hélice es la distancia paralela al eje de la hélice en la que ésta realiza una vuelta completa. Si hay un número entero de residuos por vuelta, el paso y la repetición son iguales. La elevación (h) de la hélice es la distancia paralela al eje, que va desde el nivel de un residuo hasta el siguiente, es decir: h = c/m. Si pensamos en una escalera de caracol como ejemplo de una hélice, la elevación es la altura de cada peldaño y el paso es la distancia desde el lugar en el que uno se encuentra hasta el lugar correspondiente situado directamente encima. Todas las manchas se encuentran en líneas perpendiculares al eje de la fibra; estas líneas se denominan líneas de capa. El espaciado entre estas líneas es inversamente proporcional a la repetición de la hélice, c; que en este caso es igual al paso. Obsérvese que el patrón cruzado se repite cada cuarta línea de capa. Este patrón de repetición nos indica que hay exactamente 4 residuos por vuelta de la hélice. Así pues, la elevación de la hélice es de c/4. Este es el tipo de prueba que llevó a Watson y Crick a deducir que el B-DNA era una hélice con 10 residuos por vuelta. With all she did to make Watson and Crick's discovery possible, Rosalind Franklin was essentially "a de facto collaborator," “‘I considered her a genius, and I don’t use that word lightly.’” Anatomy of Photo 51 This shadowy X-ray photograph speaks volumes about the shape of DNA. 3.4A 34Aº El modelo de Watson y Crick 1) El DNA B tiene una estructura de doble hélice dextrógira de 2nm de diametro y plectonémica ( para poder separar los dos filamentos debe desenrollarse primero), con un paso de rosca de 3.4 nm. Cada uno de los filamentos es un polinucleótido y estan dispuestos en forma antiparalela. 2) Los filamentos de la hélice están constituídos por los ejes ribosa-fosfato de los dos polinucleótidos, estando situados hacia el exterior, y con las cargas electronegativas del fosfato en contacto con el solvente. 3) El enlace beta-glicosídico está en conformación anti- y la desoxirribosa en forma furanósica; en esta forma se ha podido comprobar que de los cinco átomos que constituyen el anillo, cuatro son coplanares y uno se sale del plano; en el DNA el átomo que sobresale es el 2’ (posición llamada endo-2’). Los sustituyentes del fosfato se dirigen aproximadamente según los vértices de un tetraedro. 4) Las bases están en planos aproximadamente perpendiculares al eje mayor de la hélice, y situadas hacia el interior. La distancia entre planos contiguos de bases es de 0.34 nm, de manera que en cada vuelta de la doble hélice hay 10 pares de bases. Cada base es aproximadamente coplanar con la que está en el filamento opuesto, y están interaccionando entre sí a través de enlaces de hidrógeno. Esta interacción sólo puede darse si adenina interacciona con timina y guanina con citosina, o viceversa. 5) La estructura de la hélice está mantenida por los enlaces de hidrógeno entre las bases complementarias y una interacción de naturaleza hidrofóbica que se da entre planos contiguos de bases, llamada interacción de apilamiento. La carga electronegativa debida a los grupos fosfato, interacciona con iones magnesio, con agua, o con proteínas básicas (histonas). 6) Los enlaces N-glicosídicos de las bases coplanares con los azúcares no están en situación diametralmente opuesta. Esto hace que el espacio que queda entre los filamentos enrollados uno sobre otro constituya dos surcos de diferente tamaño, un surco estrecho y un surco ancho. A través de estos surcos las bases pueden entrar en contacto con el solvente o interaccionar con diversas moléculas. En el surco estrecho siempre se encuentra la función 2-oxo de las pirimidinas (C y T) y el N3 de las purinas. Patrones de dadores y aceptores de puentes de hidrógeno: a) surco menor; no (AT), on (TA), nho (GC) y ohn (CG) b) surco mayor; nho (AT), ohn (TA), noh(GC) y hon (CG) Pruebas experimentales del modelo de Watson y Crick 1) El modelo es perfectamente coherente con los datos cristalográficos. Desde su publicación hasta la fecha se han refinado las cifras sin variar sustancialmente la estructura del modelo original. Sin embargo, lo que se ha podido comprobar es una flexibilidad mucho mayor para las dimensiones del modelo. Estudios de Dikerson han demostrado que: a) la rotación de un par de bases sobre el anterior puede oscilar entre 28º y 42º ( en el modelo original era de 36º) b) las bases opuestas no son exactamente coplanares; cabe una cierta torsión entre sus planos respectivos. c) Los planos contiguos de bases no son exactamente paralelos. 2) El modelo predice una determinada densidad lineal para la molecula de DNA. Si cada 3.4 nm tenemos 10 pares de nucleótidos, la densidad lineal será de unos 6000 Dalton cada 3.4 nm. 3) El modelo postula la existencia de tres enlaces de hidrógeno en un par G-C y dos en un par A-T. Esto implica que el DNA rico en G + C debe ser más estable que el DNA rico en A + T. 4) A. Kornberg y colaboradores idearon una técnica para la medida de frecuencias del vecino más próximo en el DNA; los resultados obtenidos eran compatibles con una doble hélice de estructura complementaria y antiparalela. 5) El modelo nos sugiere un modelo de replicación semiconservativa del DNA. Implicaciones genéticas del modelo 1) el modelo de Watson y Crick es una estructura regular, aperiódica y lineal, lo que esta en concordancia con la idea que se tenía de cómo debía ser la molécula de la herencia. 2) el apareamiento de bases establece un mecanismo mediante el cual la doble hélice dispone de información para duplicarse a si misma. 3) La reactividad de las bases y la estructura general del DNA explica la acción de los mutágenos químicos y las mutaciones espontáneas. 4) Ademas de la autoduplicación, el material genético debe ser suceptible de recombinación, y sobre todo de dirigir la formación del fenotipo. Dodecámero de Dickerson cristalizado 5’-CGCGAATTCGCG- 3’ 3’-GCGCTTAAGCGC-5’ Estructura del B-DNA según los estudios de cristales moleculares. Obsérvense las distorsiones locales de la estructura idealizada. Estas y otras variaciones locales de la doble hélice dependen de la secuencia de bases, lo que implica que: -Las proteínas encuentren sus dianas -La hélice se puede torcer suavemente -La hélice se puede superenrollar con pequeños cambios en la estructura local. DNA circular. Otras estructuras posibles en el DNA: el DNA-A y el DNA Z El 2’OH del RNA encaja en una hélice de A-DNA con pares de bases inclinados pero no con una hélice de B-DNA Una de las formas analizadas primitivamente por Wilkins fue el DNA-A, con un grado de hidratación menor que el DNA-B y mucho menor peso molecular. El DNA-A es también una doble hélice, pero más ancha y corta que el DNA-B; base y pentosa están en situación anti-, pero el anillo furanósico está en posición endo-3’ (es decir, sobresale el carbono 3’ ), las bases presentan una inclinación de 19º sobre el eje de la hélice y se atenúa la diferencia entre los surcos mayor y menor. Esta estructura se presenta en los RNA de doble hélice; asi como en los híbridos DNA-RNA. El Z-DNA es una doble hélice levógira en la que los fosfatos del esqueleto están dispuestos en zig-zag En 1982, el análisis de tractos de DNA ricos en G + C demostró que el modelo de Watson y Crick no es el único presente en DNAs de fuentes naturales. Estos DNA ricos en G + C pueden presentar la estructura llamada DNA Z, descubierta por primera vez en un duplex formado por copolimeros GCGCGCGC. El DNA Z es asi mismo una doble hélice, pero el enrollamiento tiene lugar a izquierdas. El apareamiento de bases tiene lugar en la misma manera que en el modelo de Watson y Crick, pero los planos de las bases no son perpendiculares al eje de la hélice, presentando grados diversos de inclinación. El enlace beta glicosídico está alternativamente en conformación sin- (el de purina) y anti- (el de la pirimidina) esto hace que el eje pentosa-fosfato presente una disposición en zig-zag. Características estructurales de los A, B y Z-DNA ideales A B Z Sentido de la hélice Arrollada hacia la derecha Arrollada hacia la derecha Arrollada hacia la izquierda Diámetro 2,6 nm 2 nm 1.8 nm Pares de bases por vuelta de hélice 11 10 12 (6 dímeros) Giro de la hélice por par de bases 33º 36º 60º (por dimero) Paso de rosca de la hélice 2,8 nm 3.4 nm 4.5 nm Elevación de la hélice por par de bases 0,26 nm 0,34 nm 0,37 Inclinación del plano de las bases respecto al eje de la hélice 20º 6º 7º Surco mayor Estrecho y profundo Ancho y profundo Plano Surco menor Ancho y poco profundo Estrecho y profundo Estrecho y profundo Atomo desplazado en el azúcar C(3`)-endo C(2´)-endo C(2´)-endo para pirimidinas; C(3´)-endo para purinas Enlace glucosídico anti anti Anti para pirimidinas; sin para purinas Conformaciones de los ácidos nucleicos de cadena única. Presentan estructuras diversas dependiendo de la secuencia y condiciones del medio: A) Condiciones extremas: alta temperatura, agentes desnaturalizantes etc. Estructura de ovillo aleatorio de las cadenas simples desnaturalizadas. Existe flexibilidad de rotación de los residuos y una estructura inespecífica. B) Condiciones suaves: similares a las fisiológicas Estructura de bases apiladas adoptada por las cadenas sencillas no autocomplementarias en condiciones “nativas” las bases se apilan para llevar la cadena a una hélice, pero no hay enlaces de hidrógeno. C) Condiciones suaves: Presencia desecuencias autocomplementarias Estructura de horquilla formadas por secuencias autocomplementarias, la cadena se dobla sobre sí misma para formar una estructura de lazo. Triples hélices y H-DNA Las triples hélices se forman debido al apareamiento de bases de tipo Hoogsteen. De gran importancia en procesos como: replicación, transcripción, recombinación etc. A) Se descubrieron usando homopolímeros de ribonucleótidos: poli (U)-poli (A)-poli (U) B) Pueden darse también en homopolímeros de desoxirribonucleótidos: poli (T)-poli (A)-poli (T) poli (C+)*-poli (G)-poli (C) *(C+) citosina protonada en N3 Apareamientos de Hoogsteen Los nucleótidos que participan en los pares de bases de Watson y Crick pueden formar puentes de hidrógeno adicionales, sobre todo con los grupos funcionales que se encuentran en el surco mayor. Los átomos N7, O6 y N6 de las purinas que participan en los puentes de hidrógeno del DNA triples se conocen como posiciones de Hoogsteen, y el apareamiento que no sigue el patrón de Watson y Crick se denomina apareamiento de Hoogsteen. Estructura particularmente exótica, es el H-DNA, se encuentra en regiones de polipurina o de polipirimidina que incorporan una repetición especular. Ejemplo, un fragmento largo de residuos de T y C alternados. …….TCTCTCTCTCTCTC…. ……AGAGAGAGAGAGAG… Puede existir la estructura de doble hélice, o bien con una cadena doblada hacia atrás para formar una triple hélice (con los tripletes C+-G-C y T-A-T) con lo que queda la otra cadena (Pu) desapareada. Estructuras secundarias poco habituales del DNA Curvaturas, horquillas y cruces Se han encontrado otras variaciones estructurales dependientes de la secuencia Ejemplos: -Cuatro o más adeninas consecutivas en una de las hebras produce curvatura de la hélice. Seis adeninas consecutivas producen una curvatura de aproximadamente 18º -En moléculas de DNA de cadena sencilla la presencia de secuencias autocomplementarias permite que la cadena se pliegue sobre si misma y forme una hélice antiparalela de bases apareadas. -En ocasiones pueden formarse horquillas dobles formando una estructura cruciforme, para lo cual es necesario la presencia de una secuencia palindrómica. Palindromes y repeticiones especulares Desnaturalización del DNA: transición hélice-ovillo aleatorio La estructura secundaria en doble hélice es relativamente bastante estable en condiciones fisiológicas para el DNA; la pérdida de dicha estructura se conoce como desnaturalización. Consideraciones termodinámicas del proceso: 1- Factores que favorecen la forma de ovillo aleatorio a) Repulsión electrostática entre las cadenas debido a la carga negativa de los fosfatos, en parte amortiguada por contraiónes. b) La forma en ovillo posee mayor entropía, de acuerdo con: S = K ln W S = entropía; K = cte de Boltzmann (cte de los gases/nº de Avogadro) y W = nº de subestados de la misma energía. Conclusión: ∆ S > 0 y positiva e ∆ H < 0 y negativa Por tanto, ∆ G = ∆ H – T ∆ S negativa (desnaturalización). 2- Factores que favorecen la estructura en doble hélice a) Los puentes de hidrógeno entre las bases complementarias b) Apilamiento de bases Estos dos factores dan un incremento de entalpía positivo, que compensan el valor negativo en sentido contrario, favoreciendo la estructura en doble hélice. Por tanto, el resultado global del proceso es: ∆ H e ∆ S son positivos y el signo de ∆ G depende solamente de la temperatura Conclusión: A) Temperatura baja: T ∆ S < ∆ H ∆ G positiva → Hélice B) Temperatura alta: T ∆ S > ∆ H ∆ G negativa → Ovillo Espectro de absorción uv del DNA de E. coli nativo y desnaturalizado por calor. La desnaturalización no cambia la forma general de la curva de absorción sino que solo aumenta su intensidad Curva de fusión del DNA. La absorbancia relativa es la relación de la absorbancia (normalmente medida a 260 nm) a la temperatura indicada con respecto a la medida a 25º C. La temperatura de fusión Tm es la temperatura a la que se alcanza la mitad de la absorbancia máxima. Variación de la temperatura de fusión, Tm, de diferentes DNAs en función de su contenido G + C. Los DNAs fueron disueltos en una solución que contenía NaCl 0.15M y Na citrato 0.015M A un valor bajo de temperatura, ∆G es positivo y la desnaturalización del DNA no está favorecida. A medida que aumenta la temperatura, -T∆S supera a ∆H con lo que ∆G pasa a ser negativo y la desnaturalización es favorable. El punto medio de la curva señala la temperatura de “fusión”, Tm del DNA Organización del DNA en procariotas Superenrollamiento a) empaquetamiento b) Distribución de la tensión entre la torsión y el retorcimiento Vuelta de superhélice a) a la derecha ----- sobrenrollamiento (+) b) a la izquierda --sobrenrollamiento ( -) Organización del DNA en eucariotas Los cromosomas eucarióticos, constituidos por un complejo formado por DNA, RNA y proteínas llamado cromatina, son entidades dinámicas cuya apariencia varía de manera espectacular durante las fases del ciclo celular. Comparación entre la cromatina interfásica extendida y la cromatina del cromosoma mitótico. A) cromatina saliendo de un núcleo interfásico lisado. B) cromosoma metafásico (duplicado). Obsérvese la diferencia de escala. Micrografías electrónicas de cromatina extraída en las formas extendída y condensada. a) la cromatina aislada a baja fuerza iónica tiene un aspecto extendído de “collar de perlas”. Las perlas son nucleosomas (10 nm de diámetro) y el “cordón” es DNA conector. b) la cromatina aislada a fuerza iónica fisiológica (0.15M ClK) aparece como una fibra condensada de 30 nm de diámetro. EUCROMATINA Fuerza iónica baja (Se expresa) HETEROCROMATINA Fuerza iónica fisiológica (No se expresa) Los cromosomas humanos poseen entre 48 y 240 millones de pares de bases en sus DNAs, con una longitud entre 1.6 y 8.2 cm (0.34 nm/bp). Sin embargo, en metafase su estado más condensado estos cromosomas tienen una longitud entre 1.3 y 10 µm. El DNA cromosómico tiene, por tanto, una relación de empaquetamiento superior a 8000 veces. ¿Cómo alcanza el DNA de la cromatina un grado tan alto de condensación? Se consigue a tres niveles a) Nucleosomas b) Filamentos de 30 nm c) Bucles radiales NUCLEOSOMAS Histonas. Características: a) proteínas básicas de bajo peso molecular b) secuencias altamente conservada a lo largo de la evolución c) pueden estar modificadas en las cadenas laterales de sus residuos o en el N-término: (acetilaciones, o-fosforiladas y mono o di N-metiladas Tipos: Histonas de timo de ternera Masa (KD) % Arginina % Lisina Histona Nº restos H1 215 23.0 1 29 H2A H2B H3 H4 129 125 135 102 14.0 13.8 15.3 11.3 9 6 13 14 11 16 10 11 Función Se une al DNA de conexión y colabora en la estabilización de estructuras de orden superior 2 cadenas de cada una forman el núcleo central del nucleosoma Secuencia de aminoácidos de la histona H4 de timo de ternera: - Las histonas están conservadas a lo largo de la evolución. Ejemplo: en el guisante la H4 solo se diferencia de la de ternera en dos aminoácidos; la valina 60 es isoleucina y la lisina 77 es arginina - En rojo los 25 aa básicos - Subrayados los restos que pueden ser objeto de modificaciones postraduccionales: A) La serina 1 invariablemente es N-acetilada, ó o-fosforilada B) Los restos de lisina 5, 8,12 y 16 pueden ser N-acetilados, y la lisina 20 puede ser mono ó di Nmetilada. Estructura de las histonas A B C Organización estructural de las histonas del núcleo del nucleosoma. (A) Cada una de las histonas tiene una cola N-terminal que es objeto de diversas modificaciones y una región plegada. (B) (arriba) Estructura del pliegue de la histona, tres α-hélices unidas por dos bucles; (abajo) las histonas 2A y 2B forman un dímero mediante una interacción conocida como “encajada de manos”. Las histonas H3 y H4 forman un dímero mediante el mismo tipo de interacción. (C) Las histones H2A, H2B, H3 y H4 adoptan una estructura tridimensional similar. Organización estructural del nucleosoma El primer modelo de la estructura de un nucleosoma fue postulado por Roger Kornberg en 1974, apoyado en las siguientes evidencias: 1) La cromatina contiene aproximadamente el mismo número de moléculas de las histonas H2A, H2B, H3 y H4, y no más de la mitad de ese número de moléculas de la histona H1. 2) Los estudios de difracción de rayos X indican que las fibras de cromatina tienen una estructura regular que se repite aproximadamente cada 10 nm Microscopia electrónica de cromatina aislada de núcleos interfásicos.A) Filamento de 30 nm. B) desempaquetada ó descondensada después del aislamiento experimentalmente para observar los nucleosomas (fibras de 10 nm) 3) Una digestión breve de la cromatina con nucleasa micrococal (nucleasa inespecífica da patrones específicos) seguido de ultracentrifugación en gradiente de densidad de sacarosa y posterior electroforésis de las fracciones en gel muestra que cada n-mero de la particula contiene 200 bp o múltiplos del mismo. Gradiente de densidad de sacarosa. Microscopía electrónica de las fracciones Electroforésis de las fracciones del gradiente Antes del gradiente 1 4 2 3 2 3 1 4 4) Experimentos de cross-linker (dimetilsuberimidato), indican que las histonas H3 y H4 se asocian para formar el tetrámero (H3)2 (H4)2. 53.2 KD 26.6 KD 15.3 KD 11.3 KD Ensamblaje de un octámero de histonas. El dímero de las histonas H3-H4 y el H2A-H2B se forman a través de interacciones del tipo encajada de manos. Un tetrámero de H3-H4 forma el armazón sobre el cual se incorporan dos dímeros H2A-H2B para completar su ensamblaje. Puede apreciarse que las colas N-terminales de las histonas sobresalen de la estructura en forma de disco del núcleo. Todas estas observaciones permitieron a Kornnberg proponer que las particulas de la cromatina, llamadas nucleosomas, estan costituídas por el octámero (H2A, H2B, H3 y H4)2, asociado a 200 bp de DNA. La histona H1 se propuso que estaría asociada a la parte externa del nucleosoma (cromatosoma). Una digestión posterior corta parte del DNA de los cromatosomas mediante un proceso que libera la histona H1 (166 bp). Posterior hidrólisis da lugar a la llamada particula núcleo del nucleosoma , que consiste en una cadena de DNA de 146 bp asociada con el octámero de histonas. Estructura del nucleosoma Esquema de digestión: El DNA nucleosomal de 166 pb/0.34 nm/bp, tiene una relación de empaquetamiento de 10 (56 nm de longitud se pliegan dando una estructura altamente superenrollada de 5.6 nm, 1.7 vueltas de superhélice levógira) DNA =200pb =166pb =146pb El ensamblaje del nucleosoma está mediado por otros factores La nucleoplasmina ( proteína ácida) participa en el ensamblaje del nucleosoma actuando como una chaperona molecular que asocia las histonas y el DNA de manera controlada, evitando así su agregación no específica debído a sus fuertes interacciones electrostáticas FILAMENTOS DE 30 nm El filamento del nucleosoma de 10 nm presente a baja fuerza iónica que contiene H1, se pliega en una conformación en zigzag (filamentos de 30 nm) a medida que la fuerza iónica del medio sube. Su aspecto sugiere que los nucleosomas interaccionan mediante contactos entre sus moléculas de H1. A concentración salina fisiológica, la cromatina forma un filamento de 30nm de espesor. Modelo de como la histona H1 puede cambiar la trayectoria del DNA y su salida del nucleosoma Klug propuso que el filamento de 30 nm se formaba por enrollamiento del filamento de 10 nm formando un solenoide con 6 nucleosomas / vuelta y un paso de rosca de 11 nm. El solenoide está estabilizado por las moléculas de H1 y probablemente por la participación de las colas de las histonas que forman el núcleo. La relación de empaquetamiento es de 40 (6 nucleosomas, cada uno con 200 bp, con un total de 11 nm.). Vista a lo largo del eje de la croomatina condensada dispuesta en solenoide que muestra la localización interior de una histona H1 asociada con cada nucleosoma Modelo solenoidal propuesto para la cromatina, que contiene seis nucleosomas por cada vuelta de hélice. La doble hélice del DNA está enrollada alrededor de cada octámero de histonas. Remodelación de la cromatina ↔ Complejos de remodelación Características: -Existen distintos tipos -Complejos multiméricos, > de 10 cadenas -hidrolizan ATP -Debilitan las interacciones histonas-DNA (nucleosomas remodelados) -Cambian de posición (el nucleosoma cambia de posición) Mecanismo Ciclo Función: Irregularidades en la fibra de 30 nm mediante proteínas unidas a secuencias específicas de DNA. Las interrupciones pueden relacionarse con regiones del DNA en las que faltan nucleosomas o, más probablemente, con regiones que tienen nucleosomas alterados o remodelados. Modificaciones covalentes de las colas de las histonas Las colas N-terminales de las cuatro histonas del núcleo del nucleosoma tienen una secuencia altamente conservada y juegan un papel crucial en la regulación de la estructura de la cromatina. Modificaciones de las histonas -postraduccionales -post-ensamblaje del nucleosoma: a) no afectan la estabilidad del nucleosoma b) afectan la estabilidad del filamento de 30 nm y otras estructuras superiores c) gran capacidad para atraer especificamente a determinadas proteínas. Las cuales: -modifican el grado de empaquetamiento de la cromatina -facilitan el acceso al DNA BUCLES RADIALES Los cromosomas metafásicos desprovistos de histonas muestran un esqueleto central de proteína fibrosa rodeado por un extenso halo de DNA. Las cadenas de DNA forman bucles que entran y salen del esqueleto prácticamente en el mismo punto.La mayoría de estos bucles tiene una longitud entre 15 y 30 um (que corresponden a 45-90 kb), con lo que al empaquetarse como filamentos de 30 nm tendrían una longitud de 0.6 um. Micrografías electrónicas de cortes transversales de cromosomas, sugieren que las fibras de cromatina de los cromosomas metafásicos estan dispuestas de forma radial. Si los bucles que se observan corresponden a esas fibras radiales, cada uno debería contribuir con 0.3 um al diámetro del cromosoma ( una fibra debe doblarse sobre si misma para formar un bucle). Teniendo en cuenta los 0.4 um de anchura del esqueleto, este modelo predice 1.0 um para el diámetro del cromosoma metafásico, concordando con lo observado. Un cromosoma humano de 140 millones de bp, tendría por lo tanto 2000 de estos bucles radiales de 70 kb. El esqueleto de dicho cromosoma, de 0.4 um de diámetro, tiene una superficie lo suficientemente grande, a lo largo de sus 6 um de longitud, como para unir ese número de bucles radiales. Por tanto, el modelo de bucle radial explica la relación de empaquetamiento del DNA observada en los cromosomas metafásicos. Organización del material genético eucariótico: Resumen Modelo de empaquetamiento de la cromatina y el armazón de los cromosomas en metafase. En los cromosomas en interfase, largas porciones de cromatina de 30 nm forman asas hacia el exterior de los armazones extendidos. En los cromosomas en metafase, el armazón se pliega para formar una hélice y se empaqueta aun más para formar una estructura muy compacta, cuya geometría exacta aun no se conoce. Microfotografía electrónica de un cromosoma en metafase sin histonas, por tratamiento con un detergente suave. Se distingue un armazón de proteína no histona (estructura oscura), del que se extienden largas asas de DNA.







