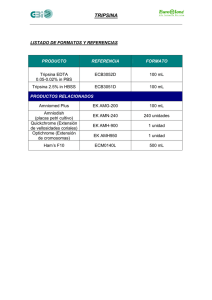
1. Fijación en formol lO% en PBS ( tampón fosfato salino) pH 7,2. 2.
Anuncio

PROCESAMIENTO DE CORTES PARA INMUNOHISTOQUIMICA (OPTICO) 1. Fijación en formol lO% en PBS ( tampón fosfato salino) pH 7,2. 2. Cortes de 6µm. Baño a 40oC 3. Pegar los cortes al porta con poli-L-lisina o Silano. 4. Dejar secar toda la noche a 37 oC. 5. Desparafinar : Xileno 30'. 6. Rehidratar - alcohol 100o – 96º - 90º - 80º - 70º - agua destilada. 5' 5' 5’ 5’ 5’ 5’ 7. Inhibición de peroxidasa endógena: H2O2 3% en H2O destilada 5'. 8. Lavar en PBS pH 7,4 3’. 9. Digestión dependiendo del antisuero 1io. 10. Lavar en PBS, dependiendo del antisuero 1io 10'. 11. Suero porcino (normal) diluido 1/20 en PBS pH 7,4 más albumina 1% 20'. 12. Quitar el sobrenadante del suero normal y añadir el antisuero 1io, dejar 90’. 13. Lavar en PBS pH 7,4 5'. 14. 1er Puente: biotinilado anti-mouse 30'. dilución 1/400, en PBS pH 7,4 más albumina al 1% 15. Lavar en PBS 5', quitar exceso de PBS pero dejar el tejido húmedo. 16. 2o Puente: extravidina peroxidasa al 1/800 en PBS pH 7,4 más albumina al 1% 30'. 17. Lavar en PBS 5'. 18. Revelado con DAB (diamino-bencidina); el tiempo varía según el tejido. 19. Lavar en PBS 5'. 20. Pasar por agua destilada 5'. 21. Contrastar con hematoxilina de Harris, meter y sacar rápidamente. Lavar en agua destilada 10'. 22. Deshidratación, alcohol 70o - 80º - 90o – 96º - 100o – xileno - xileno 5' 5' 5' 5’ 5’ 10’ 10’ 23. Montar. REACTIVOS * Suero normal dilución 1/20. 100µl en 2 ml de PBS más albúmina. * Antisuero 1io 1/200. * 1er Puente: suero biotinilado 1/400. * 2o Puente: 1/800. * Peroxidasa endógena al 3% 3ml H202 en 100ml de agua destilada. Si se hace digestión con tripsina: tripsina a 0,1 mg en 100ml Cl2Ca (pH 7,8). * Revelado con DAB: DAB 5mg en 10 ml de PBS pH 7,4 y en el último momento añadir 2 gotas de peroxidasa al 3%. PBS pH 7,4 para hacer 3 l. Se conserva a tª ambiente: - KH2PO4 600mg. - K2HPO4- 3H20 4,5g. - NaCl 23,2 g. Digestión: disolver 0,1 mg tripsina en 100ml de Cl2Ca al 1% pH 7,8 ( con ClH 0,1 N ó 0,2 N).