MUESTRAS DEL TRACTO RESPIRATORIO SUPERIOR
Anuncio

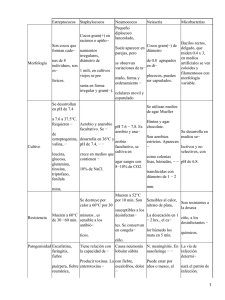
MUESTRAS DEL TRACTO RESPIRATORIO SUPERIOR 1.0 INTRODUCCIÓN Las vías respiratorias altas se extienden desde los orificios nasales hacia la laringe y comprende la nasofaringe y la orofaringe,a, los senos paranasales, trompa de Eustaquio y el oído medio. Las infecciones del tracto respiratorio superior más frecuentes son: laringitis, faringitis, epiglotitis, sinusitis, otitis externa y media, difteria, tos ferina, angina de Vincent y candidiasis oral. Es fundamental conocer la flora comensal para la interpretación de los resultados de laboratorio. 2.0 FLORA NORMAL DEL TRACTO RESPIRATORIO SUPERIOR -Streptococcus spp (alfa, beta, no hemolíticos) -Neisseria spp. -Haemophilus spp. -Corynebacterium spp. -Staphylococcus spp -Micrococcus spp. -Veillonella spp. -Peptostreptococcus spp. -Actynomyces spp. -Mycoplasma spp. -Bacteroides spp. -Fusobacterium spp. -Candida spp. 3.0 FARINGITIS La principal causa de faringitis es por Streptococcus pyogenes (grupo A). Otras bacterias que se incluyen son: Streptococcus grupo C, G, y Arcanobacterium (Corynebacterium) haemolyticum. El examen de rutina de laboratorio debe incluir métodos para el diagnóstico de Streptococcus grupo A que sean sensibles ya que un número bajo de esta bacteria puede indicar no solo colonización sino representar una infección, además es importante detectarlo por la reemergencia de la fiebre reumática aguda y la posibilidad de un shock tóxico like. El estudio de Neisseria meningitidis generalmente se hace con propósitos epidemiológicos. El estudio de faringitis gonocócica debe ser solicitada en forma específica por el médico. Corynebacterium diphtheriae se debe buscar sólo cuando se solicita expresamente. FLUJOGRAMA Nº 1 : SECRECION FARINGEA DIFTERIA ( C. diphteriae) FARINGITIS ( S. GRUPO A ) FARINGITIS GONOCOCICA TORULA (2) TORULA SILICA GEL AMIES STUART TRANSPORTE NUTRITIVO TORULA AMIES STUART O SILICA GEL LABORATORIO REFERENCIA PAS AGAR SANGRE TELURITO* AGAR TINSDALE PAS ANGINA DE VINCENT TORULA THAYER - MARTIN GRAM 35 ºC CO 2 x 72 HORAS INCUBAR 35ºC x 18-24-48 HORAS* INCUBAR 35-37 ºC 18-24 HORAS OBS. COLONIAS OBS. COLONIAS T. GRAM OBS. β-HEMOLISIS T. GRAM DIAG. PRESUNTIVO: PRUEBAS BIOQUIMICAS DIAG. DEFINITIVO DIAG. DEFINITIVO T. GRAM -UTILIZAC.DE CARBOHIDRATOS T. OXIDASA -DET. DE B- LACTAMASA CATALASA ( - ) (-) LABORATORIO DE REFERENCIA INCUBAR 18-24 HRS DIAG. PRESUNTIVO: -SUSCEPTIBILIDAD BACITRACINA 0,04µ NHDM DIAG. DEFINITIVO: SEROLOGIA -PYR PAS: Placa agar sangre NHDM:No hubo desarrollo microbiano FLUJOGRAMA Nº2 : SECRECION NASOFARINGEA Bordetella pertusssis IFD ASPIRADO NASOFARINGEO N. meningitidis (PORTADORES ) Haemophilus influenzae SEMBRAR AL LADO DEL PACIENTE NASOFARIANGEA ASPIRACION CULTIVO: SEMBRAR INMEDIATAMENTE AL LADO DEL PACIENTE REGAN-LOWE 35 ºC SEMBRAR AL LADO DEL PACIENTE THAYER MARTIN AMIES STURAT CHOCOLATE SUPLEMENTADO 35ºC CO2 24-48 HRS. INCUBAR 35ºC CO2 OBS. COLONIAS 18-24 HRS ( HUMEDAD ) HASTA 7 DIAS OBS. COLONIAS T. DE GRAM T. DE GRAM OXIDASA ACCION SOBRE CARBOHIDRATOS GRAM FACTORES X y V OXIDASA B LACTAMASA SEROLOGIA DIAG. DEFINITIVO DIAG. DEFINITIVO INMUNOFLUORESCENCIA SEROLOGIA ENVIO AL LAB. DE REFERENCIA PARA CONFIRMACIÓN ENVIO AL LAB. DE REFERENCIA PARA CONFIRMACIÓN IDENTIFICACIÓN DEFINITIVA: SEROLOGÍA TABLA 1: OTRAS MUESTRAS TRACTO RESPIRATORIO SUPERIOR S.PARANASAL SEC.OTICA MUCOSA ES BUCAL DIAGNÓSTICO Sinusitis Otitis Otitis Candidiasis MUESTRA TIPO MUESTRA Punción media externa Timpanocente Tórula sis AGENTE ETIOLÓGICO S. pneumoniae H. influenzae Anaerobios Neisseria B. catarrhalis S. aureus S. pneumoniae S. aureus H. influenzae B.catarrhalis Bacilos GAnaerobios oral Tórula P. aeruginosa Candida Otras albicans bacterias aerobias T.Gram * T.Gram * T.Gram * T.Gram * Sabureaud PAS PAS PAS 30ºC hasta 5 ACHO (CO2) ACHO (CO2) M.Conkey 35ºC-48 hrs días Cult. Cult. Anaerobios Anaerobios 35ºC-48 hrs 35ºC-48 hrs PAS: Placa agar sangre cordero 5%, ACHO: Placa agar chocolate, * Anexo 1 (Tinciones). PROCEDIMIENTO 4.0 TOMA DE MUESTRA 4.1. SECRECIÓN FARÍNGEA 4.1.1 Cultivo corriente a.- Deprimir la lengua con bajalengua. b.- Frotar con una tórula la pared posterior de la faringe y las amígdalas tocando cualquier exudado. c.- Evitar tocar la lengua, úvula y pared de la boca. 4.1.2 Cultivo para Corynebacterium diphtheriae a.- Deprimir la lengua con bajalengua. Si se advierte la presencia de pseudomembrana, tomar dos muestras con tórula del borde de la misma presionándola sin romper. b.- Poner ambas tórulas en un tubo estéril. Si el transporte de las muestras al laboratorio es superior a cuatro horas, se recomienda enviarlas en un tubo con silica gel. Una de ellas debe ser usada para la tinción de Gram. En caso de sospecha de difteria cutánea, tomar muestra de la zona de la piel afectada además de una muestra faríngea. c.- Hacer tinción de Gram. Si se observan bacilos grampositivo de morfología característica, el laboratorio debe entregar un informe preliminar que diga “bacilos grampositivos difteromorfos." 4.1.3 Cultivo para Neisseria meningitidis Tomar la muestra con tórula por detrás de la úvula en la porción nasal de la faringe. 4.2. ASPIRADO NASOFARÍNGEO a.- Lavarse cuidadosamente las manos y luego colocarse guantes estériles. b.- Romper el sobre que contiene el kit de aspiración y conectar el final del tubo con diámetro menor a una sonda de aspiración. c.- Conectar el otro extremo de diámetro mayor a la bomba de vacío. d.- Introducir la sonda, sin aspirar, por una fosa nasal hasta la nasofaringe y retirarla aspirando. e.- Repetir el procedimiento en la otra fosa nasal. f.- Aspirar el suero fisiológico a través del tubo colector para arrastrar toda la secreción. g.- Homogeneizar la muestra agitando el tubo con la mano. h.- Colocar la tapa al tubo que contiene la muestra. i.- Procesar según flujograma Nº 2. 4.3 LARINGITIS a.- Laringitis aguda habitualmente es de etiología viral. b.- Los cultivos bacterianos raramente son orientadores excepto para descartar difteria o infección estreptocócica basándose en la clínica. 4.4 EPIGLOTITIS a.- Causada habitualmente por Haemophilus influenzae tipo b, ocurre principalmente en niños de 2 a 6 años. b.- El diagnóstico de esta infección debe ser hecho clínicamente ya que está contraindicado tomar muestra de la epiglotis, pues puede provocar una oclusión de la vía aérea. c.- Si se hace un procedimiento en la vía aérea, en ese momento se puede tomar muestra. d.- En muchos casos hay una bacteriemia y esto puede apoyar el diagnóstico. 4.5 SINUSITIS a.- Sinusitis bacteriana frecuentemente es de origen endógeno, causada por organismos que están normalmente en el tracto respiratorio superior. Agentes más comunes se muestran en la Tabla 1. b.- La única muestra apropiada para el laboratorio es el aspirado mediante jeringa de la cavidad sinusal. Se debe hacer cultivo aerobio y anaerobio. c.- Rechazar líquidos de lavado o tórulas de fosas nasales o nasofaringe, ya que éstas contendrán mucha flora normal y será muy difícil diferenciar el agente causal. 4.6 OTITIS MEDIA a.- Es una infección común en niños. Agentes más comunes se muestran en la Tabla 1. b.- La muestra del oído medio se toma mediante tímpanocentesis por un especialista, y se debe cultivar para aerobios y anaerobios. Si hay descarga en el canal externo se debe hacer cultivo sólo para aerobios. 4.7 OTITIS EXTERNA Para tímpano intacto, limpiar el conducto auditivo externo con solución jabonosa, y recolectar la secreción con aspiración con jeringa. Para tímpano roto, colectar la secreción con tórula flexible usando espéculo. a.- Pseudomonas aeruginosa es la causa más frecuente de otitis externa u “otitis del nadador” aún cuando hay otras bacterias aerobias que pueden causarla, por lo tanto sólo se debe hacer cultivo aerobio. b.- En estos cultivos pude haber contaminantes de la piel los cuales no deben ser tomados en cuenta. 4.8 OTRAS PATOLOGÍAS 4.8.1 CANDIDIASIS ORAL a.- La infección por levaduras de la mucosa bucal, lengua y orofaringe, habitualmente es producida por Candida albicans y es común en recién nacidos y adultos inmunosuprimidos (Ej.VIH-SIDA). b.- El diagnóstico se hace fácilmente por observación directa de la muestra en KOH al 10% o tinción de Gram (Anexo Tinciones). La muestra se toma con dos tórulas, una para directo y la otra muestra para cultivo. 4.8.2 ANGINA DE VINCENT a.- Borrelia vincentii y Fusobacterium spp, están asociados con esta infección que se caracteriza por la ulceración de la faringe o encías. Es infrecuente en niños, pero sí se presenta en adultos que tienen una mala higiene bucal, stress o una enfermedad sistémica grave. b.- El diagnóstico de laboratorio se hace mediante tinción de un extendido directo obtenido mediante lo descrito en el punto 4.1.b, con fucsina diluida 1:10 en agua, o con violeta de genciana. La presencia de muchas espiroquetas y fusiformes además de polimorfonucleares confirma la infección. 5.0 DETECCIÓN DE PORTADORES 5.1 DETECCIÓN DE PORTADORES DE Staphylococcus aureus a.- Tomar muestra de fosas nasales, faringe, axila y periné y sembrarlas en medio selectivo como agar sangre, feniletilalcohol o agar sal manitol que permita recuperar poca cantidad de S aureus. b.- Incubar, aislar e identificar S. aureus de acuerdo a los procedimientos de rutina. c.- Guardar las cepas aisladas por si solicitan estudios posteriores. d.- En el informe sólo se indica presencia o ausencia de S. aureus en cada muestra. 5.2 DETECCIÓN DE PORTADORES DE Neisseria meningitidis a.- Tomar muestra de la garganta y nasofaringe, con tórula por detrás de la úvula en la porción nasal de la faringe. Habitualmente en la muestra de nasofaringe se obtiene mayor número de organismos. Sembrar en un medio selectivo como Thayer Martin. b.- Emplear los procedimientos habituales para toma de muestra, transporte, incubación, aislamiento e identificación de N. meningitidis. (ver capítulo correspondiente). c.- Guardar las cepas de N. meningitidis por si solicitan estudios posteriores. d.- Informar sólo la presencia o ausencia de N. meningitidis y el grupo serológico. 6.0 INTERPRETACIÓN DE RESULTADOS a.- En una secreción faríngea corriente se debe informar la presencia o ausencia de Streptococcus β hemolítico. b.- En caso de búsqueda de faringitis gonocócica, se debe informar como “Hubo o no desarrollo de Neisseria gonorrhoeae”. Si hay sobre desarrollo de flora normal o cultivo invadido por levaduras, solicitar nueva muestra. c.- La investigación dirigida a otros patógenos específicos, debe ser informando como presencia o ausencia de los mismos 7.0 REFERENCIAS 1. Ballows A, Shadomy H. J. eds. Manual of Clinical Microbiology. 5th de. Washington D.C.ASM, 1991. 2. Isenberg H. Clinical Microbiology Procedures Handbook. Vol 1, 1993. 3. Murray, Baron, Pfaller, Tenover, Yolken. Manual of Clinical Microbiology. 6th de.Washington D.C.ASM, 1995. 4. Murray, Baron, Pfaller, Tenover, Yolken. Manual of Clinical Microbiology. 7th ed. Washington D.C. ASM, 1999. 5. Vandepitte, K. Engback, P. Piot y C. C. Henck Basic Laboratory Procedures in Clinical Bacteriology. WHO 1991. MUESTRAS DEL TRACTO RESPIRATORIO INFERIOR 1.0 GENERALIDADES Las infecciones del tracto respiratorio inferior, es decir las que comprometen: tráquea, bronquios, bronquiolos, alvéolos y/o parénquima pulmonar, constituyen en Chile la primera causa de mortalidad infantil tardía y una de las primeras causas de muerte por infección nosocomial. El diagnóstico etiológico de estas infecciones no es fácil debido a que la muestra clínica necesariamente pasa a través de la orofaringe, lugar donde se puede contaminar con numerosas especies bacterianas, salvo aquellas muestras que se obtienen directamente desde el sitio de la lesión. 2.0 TIPOS DE MUESTRAS -Expectoración -Aspirado traqueal -Lavado bronquial -Boncoscopía (cepillado bronquial, lavado broncoalveolar) -Biopsia bronquial -Biopsia pulmonar 3.0 PROCEDIMIENTO 3.1 EXAMEN MICROSCÓPICO Preparar un extendido de la muestra y hacer tinción de Gram (Anexo Tinciones) para evaluar si hay contaminación orofaríngea, indicada por la presencia de células escamosas; si la secreción es del tracto respiratorio inferior, indicada por la presencia de leucocitos ( las muestras obtenidas de pacientes transplantados de Médula Osea u otro pacientes inmunosuprimido puede no contener leucocitos) y la presencia del patógeno probable indicado por el organismo predominante asociado con leucocitos. 3.2 INTERPRETACIÓN DE LA TINCIÓN DE GRAM a.- Cuantificar el número de células escamosas examinando 10 campos con objetivo 10x. b.- Interpretar la calidad de la muestra de acuerdo a Tabla 1. c.- Informar: si hay presencia de un microorganismo predominante, si no hay microorganismos predominantes o si hay ausencia de microorganismos. d- Use los resultados de la tinción de Gram para guiarse en la interpretación de las placas de cultivo. TABLA 1: CLASIFICACIÓN DE LA MUESTRA DE EXPECTORACIÓN POR TINCIÓN DE GRAM GRUPO Nº de células por campo Leucocitos Células Epiteliales 6 < 25 < 25 5 > 25 < 10 4 > 25 10 – 25 3 > 25 > 25 2 10 – 25 > 25 1 < 10 > 25 Se recomienda no cultivar los Grupo 1,2,3 3.3 FLUJOGRAMA PARA EL EXAMEN DE MUESTRAS DEL TRACTO RESPIRATORIO INFERIOR SEGÚN OBSERVACIÓN DE TINCIÓN DE GRAM Cantidad de células epiteliales (C.E.)y polimorfonucleares(PMN) MUESTRAS DE LB, CP, BB,LBA;BP (*) (sin importar cantidad C.E 10-25 de células epiteliales) PMN>25 por campo ESPUTO C.E > 25 por campo PMN 10-25 por campo MUESTRA NO APTA PARA CULTIVO (solicitar nueva muestra). CULTIVAR E INVESTIGAR Streptococcus α hemolítico: investigar S.pneumoniae Streptococcus β hemolítico: investigar Streptococcus Grupo A bacilos gramnegativos Staphylococcus levaduras hongos Micobacterias Nocardia. Estudiar solo si es predominante: Haemophilus Moraxella (*) LB = Lavado bronquial CB = Cepillado bronquial BB = Biopsia bronquial LBA= Lavado broncoalveolar AP = Aspirado pulmonar LBA y CB sembrar en forma cuantitativa y establecer niveles de corte. 3.4 SIEMBRA DE LAS MUESTRAS a.- Sembrar muestras en agar sangre, agar chocolate suplementado, agar Mac Conkey (opcional). b.- Incubar agar sangre y agar chocolate a 35ªC en atmósfera con 5-7% de CO2. Agar Mac Conkey y tioglicolato ( solo en muestras no contaminadas con flora oral) en atmósfera normal. c.- Examinar las placas a las 24 hrs. de incubación, si no hay desarrollo visible, incubar por 24 hrs. adicionales. El tioglicolato incubarlo hasta 5 días antes de descartar. d.- Si hay desarrollo, hacer identificación del microorganismo patógeno. 3.5 CEPILLADO BRONQUIAL Y LAVADO BRONQUIOALVEOLAR Lavado Bronquial y Cepillado Bronquial son muestras tomadas por broncoscopía, el cual es un método seguro para obtener secreciones directamente de los bronquios y alvéolos, pero debe ser realizado por personal entrenado, es un método caro de obtención de muestras, que se contamina con flora de la porción superior del aparato respiratorio y no exento de complicaciones. Por lo anterior es poco realista utilizar este método de rutina en todo paciente con infección de las vías respiratorias inferiores y debe reservarse para casos seleccionados, tales como pacientes con patología crónica o refractaria o aquellos casos de pacientes inmunocomprometidos en los cuales el diagnóstico etiológico no pueda establecerse con muestras de expectoración. Los cultivos obtenidos por broncoscopía para agentes bacterianos habituales causantes de neumonias son considerados comparables, pero no mejor que los cultivos obtenidos de expectoración obtenida con criterios citológicos aceptables. 3.51 Toma de Muestra La broncoscopía se realiza con el paciente sentado o recostado y el instrumento se pasa a través de las fosas nasales o por vía oral. Se aplica antestesia local por nebulización o aplicación tópica con xilocaína u otro equivalente. Los anestésicos tópicos tienen propiedades antibacterianas, pero los estudios disponibles muestran que esto no afecta el recobrar microorganismos si la muestra es procesada dentro de dos horas de obtenida. 3.52 Procesamiento Las muestras para estudios microbiológicos son consideradas en dos categorías: a) Categoría N° 1: Incluye estudios para detectar microorganismos que no tienen problemas de interpretación, a pesar de contaminación con flora de la vía aérea superior. Esto inlcuye agentes micóticos oportunistas, parásitos, Legionella spp. y Mycobacterias. Para lavado bronquioalveolar: Se instilan 20 ml de suero fisiológico, luego se aspiran a 50-100 mm de Hg para recolectar el líquido de lavado. El procedimiento se repite 5 veces con un total de 100 ml de suero instilado, del cual se recupera alrededor de 40-70 ml. Aproximadamente 15 ml se necesitan para cultivo de bacterias aerobias, Legionella spp., Nocardia spp., hongos, mycobacterias y virus. Para estudio de bacterias habituales, las muestras de LBA son enviadas al laboratorio en cantidad mínima de 1 ml de solución salina estéril. Mezclar con vortex para resuspender previo a la siembra y sembrar en PAS, ACHO, Mac Conkey y tioglicolato usando un asa calibrada de 0.01 ml o pipeta de 10 Ul. Incubar a 35° C con 5-7% CO2 hasta por 48 horas. El tioglicolato incubar hasta 5 días. Recuentos de bacterias de >104 son considerados significativos. b) Categoría N° 2: Esta incluye el estudio de microorganismos que pueden ser parte de la flora oral. Los cultivos de rutina se le pueden realizar de manera similar a la expectoración, y estos también tienen el problema de contaminación con flora bucal. No se deben realizar estudios para bacterias anaerobias. Se pueden lograr mejor rendimiento utilizando un cepillo protegido, el cual es dirigido directamente hacia la zona en que hay secreción purulenta, el cual cuando es retirado es puesto en un tubo que contiene 1 ml de ringer lactato estéril, el cual es mezclado con un vórtex. Se inocula 0.01 ml en PAS; ACHO, Mac Conkey y tioglicolato, permite el estudio para bacterias anaerobias. Incubar durante 48 horas. El tioglicolato incubar hasta 5 días. Recuentos de colonias de >103 son considerados significativos, dado que estos representan alrededor de 106/ml de la solución original. 3.5 Informe Semicuantitativo - Si no hay crecimiento: -Si hay crecimiento de 1-2 colonias: -Si hay crecimiento de 3-10 colonias: -Si hay crecimiento mayor a 10 colonias -Si hay colonias presentes: en un área 1° y 2° de inoculación. No hubo desarrollo microbiano. Muy escaso desarrollo microbiano. Escaso desarrollo microbiano. Moderado desarrollo microbiano. Abundante desarrollo microbiano. Si un organismo es observado en la tinción de Gram del caldo (caldo no sub cultivado o sin desarrollo en el sub cultivo), informar microorganismo observado solamente por tinción del caldo). Si un microorganismo está solo presente en el sub cultivo del caldo informar microorganismo aislado de caldo solamente. 3.54 Informe Cuantitativo -N° de colonias (<10)= <103 -N° de colonias (10-100)=103-104 -N° de colonias (100-1000)=104-105 -N° de colonias(>1000)=>105 3.6 Cultivo cuantitativo de aspirados Ventilación Mecánica endotraqueales en paciente en La neumonia asociada a ventilación mecánica se define como la neumonia en un paciente en ventilación mecánica luego de 48 horas. Durante años se utilizó para su diagnóstico los criterios de Johanson et al de 1972, el cual incluye criterios no específicos, por lo que se recomienda el uso de criterios microbiológicos cuantitativos para el diagnóstico de Neumonia Asociada a Ventilación Mecánica (NAVM). El uso del cultivo cuantitativo del aspirado endotraqueal tiene una sensibilidad y especificidad diagnósticas comparables a las estrategias diagnósticas basadas en estudios fibrobroncoscópicos y tiene la ventaja de la universalidad de su aplicación, bajo costo independencia de equipos humanos y técnicos restringidos. Se recomienda informar los recuentos microbiológicos de todas las especies bacterianas potencialmente patógenas y que su lectura sea interpretada utilizando al menos dos puntos de corte ( <103 y > 106 ufc/ml). Este enfoque permite dar mayor flexibilidad al grupo tratante sobre interpretación de la etiología polimicrobiana presente en algunos casos y sobre la decisión de dirigir el estudio hacia causas potenciales y/o suspender el tratamiento antibiótico cuando el recuento sea muy bajo. No se recomienda su solicitud cuando se ha realizado un cambio en la terapia antimicrobiana en la últimas 72 horas, por cuanto el estudio cuantitativo puede verse afectado. Esta dirigido hacia algunas etiologías bacterianas. No existe experiencia significativa sobre estudios diagnósticos invasivos y no invasivos en el reconocimiento de la NAVM en pediatría. El cultivo cuantitativo del aspirado endotraqueal puede ser aplicado, aunque su lectura sólo puede ser realizada por extrapolación, utilizando los puntos de corte descritos para los adultos. 3.61 Indicaciones de cultivo de AET Se recomienda realizar cultivo cuantitativo de AET a todo paciente con sospecha de NAVM, conectado en un tiempo mayor de 48 horas y que presente criterios clínicos y radiológicos y en el que no se haya realizado un cambio en el tratamiento antimicrobiano en las últimas 72 horas. 3.62 Toma de Muestra Se debe tomar una muestra en forma estéril, utilizando sonda de aspiración introducida por el tubo endotraqueal (TET), conectado en el otro extemo a un colector o trampa estéril. Debe ser realizado por un profesional entrenado. La muestra no se debe diluir y debe ser enviada de inmediato al laboratorio. 3.62 Procesamiento -Diluir la muestra a la mitad con suero fisiológico estéril(dilución1:2). -Homogeneizar con perlas de vidrio y agitador durante 2 minutos. -Extraer 100 Ul y diluir en 9,9 ml de suero fisiológico y agitar ( dilución 1:100). -Rotular una placa de agar sangre y Mac conkey como A y el otro set como B. -Sembrar 100 Ul (0,1 ml) en el set de placas A ( dilución final 1:2000). -Sembrar 10 Ul (0,01 ml ) en el set de placas B ( Dilución final 1:20.000). -Incubar a 35° C en atmósfera aeróbica hasta 72 horas. La muestra puede también ser sembrada en ACHO para la detección de Haemophilus influenzae en caso de NAVM de inicio precoz. La tinción de Gram de este tipo de muestras tiene un rendimiento limitado, ya que no permite predecir que tipo de microorganismos tendrá un recuento significativo. 3.63 Informe de Laboratorio La emisión del informe debe incluir un detalle de cada microorganismo aislado, con su recuento y antibiograma correspondiente. La presentación de los potenciales agentes identificados es necesaria debido a que cerca de un tercio de los casos tienen aislamientos polimicrobianos. - Set Placas A: 1 colonia: equivale a 2000 ufc/ml (2x103). 5 colonias: equivale a 10.000 ufc/ml (1x104). 50 colonias equivale a 100.000 ufc/ml ( 1x105). -Set de placas B: 1 colonia: equivale a 20.000 ufc/ml (2x104). 5 colonias : equivale a 100.000 ufc/ml ( 1x105). 50 colonias equivale: 1.000.000 (>1x106). 4.0 INTERPRETACIÓN DE LOS CULTIVOS El desarrollo de un microorganismo potencialmente patógeno en forma predominante, asociado a una buena calidad de muestra tiene valor diagnóstico cuando el cuadro clínico es compatible. 5.0 REFERENCIAS 1. Ballows A, Shadomy H. J. eds. Manual of Clinical Microbiology. 5th de. Washington D.C.ASM, 1991. 2. Cumitech 7A. Diagnóstico de Laboratorio de Infecciones del tracto respiratorio bajo.Septiembre,1987 3. Isenberg.H. Clinical Microbiology Procedures Handbook. Vol 1, 1993. 4. Murray, Baron, Pfaller, Tenover, Yolken. Manual of Clinical Microbiology. 6th de. Washington D.C.ASM, 1995. 5. Murray, Baron, Pfaller, Tenover, Yolken. Manual of Clinical Microbiology. 7th ed. Washington D.C. ASM, 1999. 6. Vandepitte, K. Engback, P. Piot y C. C. Henck Basic Laboratory Procedures in Clinical Bacteriology. WHO 1991. 7. Documento "Consenso diagnóstico de la Neumonia Asociada a Ventilación Mecánica". Sochinf 8. Clinical Micobiology procedures Handbook. Isemberg H. Volumen N° 1. 1.15. 9. Ventilator- Associated Pneumonia or Not? Contemporay Diangosis. Mayhall Glen. Emerging Iinfectious Diseases. Vol 7;, N° 2 Marzo- Abril 2001.