Propiedades Coligativas
Anuncio

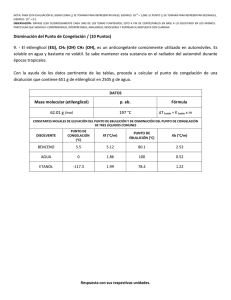
Propiedades Coligativas RT ln x En la ecuación El segundo término es negativo, lo cuál indica que el potencial químico del disolvente en solución es menor en una cantidad -RT ln x o Propiedades Coligativas 1. 2. 3. 4. Varias propiedades de la solución relacionadas entre sí, tienen su origen en el valor bajo del potencial químico. Disminución de la presión de vapor Disminución de la temperatura de Congelación Aumento de la temperatura de ebullición Presión Osmótica Propiedades Coligativas Propiedades Coligativas Como todas están relacionadas por su origen común, se denominan propiedades coligativas. Todas estas propiedades tienen una característica: No dependen de la Naturaleza del soluto presente, sino del número de moléculas de soluto en relación con el número total de moléculas presentes. Propiedades Coligativas El soluto tiene las siguientes propiedades: • • El soluto es no volátil El soluto no precipita en la fase sólida Propiedades Coligativas Por lo tanto en cada una de las fases se tendrán los siguientes componentes • • • En el vapor: solvente En el líquido: solvente + soluto En el sólido: solvente Disminución de la Presión de Vapor o Disminucion de la Presion de Vapor p p p p p x1 p 1 x1 p o o o o x2 1 x1 p p x2 p o o presentes varios solutos Si estan p p ( x2 x3 ) p o o Disminución de la Temperatura de Congelación Consideraremos una solución en equilibrio con el disolvente sólido puro. Al equilibrio tendremos: (T , p, x) solido (T , p) En el primer término, T es de equilibrio de congelación de la solución. Si p=cte. T depende de x. Disminución de la Temperatura de Congelación Si la solución es ideal, entonces: (T , p, x) RT ln x Sustituyendo (T , p) RT ln x solido (T , p) Disminución de la Temperatura de Congelación Si la solución es ideal, entonces: (T , p) solido (T , p) ln x RT Como μ° es el potencial químico del líquido puro, (T , p ) so lid o (T , p ) G fu s Donde ΔGfus es la energía de Gibbs molar de Fusión del disolvente puro a T. Disminución de la Temperatura de Congelación La ecuación se transforma: ln x G fus RT Para saber como depende T de x, hallamos (dT/dx)p. Derivando la ecuación respecto a x, p=cte. 1 1 (G fus / T ) T x R T p x p Disminución de la Temperatura de Congelación Teniendo la igualdad [d(DG/T)/dT]p= DH/T2 1 H fus x RT 2 T x p DHfus es el calor de fusión del disolvente puro a la temperatura T. Arreglando y asumiendo que DHfus es cte. En el intervalo T0 a T: H fus dx 1 x T RT 2 dT 0 x T H fus 1 1 ln x R T T0 : Para T congelacion 1 1 R ln x T T0 H fus Disminución de la Temperatura de Congelación La relación entre T de congelación y la composición x de una solución se puede simplificar si la solución es diluida. Colocando la fracción mol en función de la molalidad total y la masa molar del disolvente 1 x 1 Mm Tomando logaritmos y derivando se obtiene: ln x ln(1 Mm) Mdm d ln x 1 Mm 2 RT sustituyendo en : dT d ln x H fus 2 MRT dm dT H fus (1 Mm) Disminución de la Temperatura de Congelación Si la solución es muy diluida, m se aproxima a cero y T a T0 transformando la ecuación en: MRT0 T Kf m p ,m 0 H fus 2 Donde Kf es la constante de disminución de T de congelación Disminución de la Temperatura de Congelación La disminución de T de congelación es f=T0 – T, df =-dT f Kf m p ,m 0 Si m es pequeño: f Kfm Disminución de la Temperatura de Congelación Si w2 kg de un soluto de masa molar desconocida. M2 se disuelven en w kg de disolvente, la molalidad será m=w2/wM2 M2 K f w2 f w Disminución de la Temperatura de Congelación Solubilidad 2 (T , p, x2 ) 2( solido ) (T , p ) es ideal: Si la solucion 2o (T , p) RT ln x2 2( solido ) (T , p ) H fus 1 1 ln x2 R T T0 aplicando H fus T0 S fus obtenemos S fus T0 ln x2 1 R T Aumento de la T de ebullición Considérese una solución en equilibrio con el vapor del disolvente puro: Condición de equilibrio: (T , p, x) vap (T , p) Aumento de la T de ebullición Si la solución es ideal: (T , p) RT ln x vap (T , p) Despejando x vap (T , p) ln x RT Aumento de la T de ebullición La energía de Gibbs molar de vaporización es: G va p va p (T , p ) (T , p ) fin a lm en te ln x G va p RT Aumento de la T de ebullición Escribiendo las ecuaciones finales directamente: H vap 1 1 ln x R T T0 o bien 1 1 R ln x T T0 H vap Aumento de la T de ebullición Para la constante de aumento de la temperatura de ebullición: MRT0 T Kb m p , m 0 H vap 2 b T T0 db dT Cuando m es pequeña b Kb m Aumento de la T de ebullición El aumento de la temperatura de ebullición se emplea para determinar el peso molecular de un soluto RMT0 Kb Svap Aumento de la T de ebullición Presión Osmótica Presión Osmótica (T , p , x) o (T , p ) (T , p ) RT ln x (T , p ) o A partir de la ecuacion fundamental d V dp o p (T , p ) (T , p) o o V p sustituyendo p V o dp RT ln x 0 p integrando V RT ln x 0 o o dp o del soluto Colocando en funcion ln x ln(1 x2 ) es diluida x 2 1 Si la solucion n2 n2 ln(1 x2 ) x2 n n2 n diluida Ya que n 2 n en la solucion n 2 RT = o nV por regla de adicion V nV o n2 RT van´t Hoff ecuacion ; cRT V Determinación de la Masa Molar w2 RT M2 V IMPORTANCIA DE LAS PROPIEDADES COLIGATIVAS • • • • • • Separar los componentes de una solución por un método llamado destilación fraccionada. Formular y crear mezclas frigoríficas y anticongelantes. Determinar masas molares de solutos desconocidos. Formular sueros o soluciones fisiológicas que no provoquen desequilibrio hidrosalino en los organismos animales o que permitan corregir una anomalía del mismo. Formular caldos de cultivos adecuados para microorganismos específicos. Formular soluciones de nutrientes especiales para regadíos de vegetales en general.