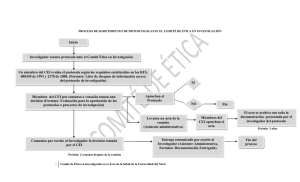
RR EE QQ UU II SS II TT OO SS PP RR EE SS EE NN TT AA CC II
Anuncio

Comitè d’Ètica de la Investigació Crta. De Canyet, s/n - 08916 Badalona Tel. 93-497.89.56 Fax 93-497.89.74 E-mail: [email protected] Web: www.ceicgermanstrias.cat R R Q U O R N A Ó N H U G U D O O A U O R A Ó N A REEEQ QU UIIISSSIIITTTO OSSSPPPR REEESSSEEEN NTTTA ACCCIIIÓ ÓN NCCCEEEIIIH HU UG GTTTiiiPPP:::EEESSSTTTU UD DIIIO OSSSPPPO OSSSTTTA AU UTTTO OR RIIIZZZA ACCCIIIÓ ÓN N(((EEEPPPA A))) Debe enviar un correo a [email protected] incluyendo la siguiente documentación: DOCUMENTACIÓN DEL PROMOTOR Carta de presentación del Promotor externo para realizar el estudio postautorización dirigida al Comité de Ética de la Investigación. Protocolo del estudio postautorización completo, estructurado según la legislación vigente y que incorpore código, versión y fecha en el encabezado o pie del documento. Resumen del protocolo, en castellano o catalán. Hoja de Información al Paciente y Consentimiento Informado, en catalán y/o castellano y en un lenguaje comprensible para el nivel intelectual esperado de los participantes. Debe incorporar código, versión y fecha en el encabezado o pie del documento. En su defecto, solicitud de exención de HIP/CI debidamente justificada. Cualquier otra documentación destinada a los posibles participantes en el estudio. Memoria económica en la que constarán las compensaciones económicas por la realización del estudio, desglosadas por partidas a percibir por el investigador principal, personal colaborador y servicios implicados. Si no existe compensación económica por la realización y/o participación en el estudio debe presentarse justificación al respecto. Ficha Técnica del medicamento en investigación. Clasificación del estudio postautorización-observacional por la AEMPS. Dictamen de aprobación de un CEIC acreditado*. Dictamen favorable de la Direcció General de Regulació, Planificació i Recursos Sanitaris la Generalitat de Catalunya para los EPA-SP*. * Sólo si procede DOCUMENTACIÓN DEL INVESTIGADOR PRINCIPAL Compromiso del investigador Principal e investigadores colaboradores. Solicitud de evaluación del estudio postautorización por parte del Investigador Principal con el visto bueno del jefe de Servicio. Listado hecho por el Investigador donde se delimiten las exploraciones y procedimientos complementarios, propios del proceso asistencial en el centro y los extraordinarios, condicionados por el estudio. Aceptación de otros servicios implicados en la realización del estudio. IIM MPPO ORRTTAAN NTTEE Para poner en marcha un EPA en nuestro centro es indispensable contar con la Conformidad de la Dirección del Centro, previa evaluación y dictamen favorable de este CEI. Para que el CEI acepte a trámite la solicitud se deberán cumplir las siguientes condiciones: Se debe solicitar la clasificación del EPA-observacional por la AEMPS (instrucciones para la solicitud de clasificación; formulario de solicitud). La documentación mínima que se debe enviar entre los días 1-5 será: protocolo, resumen, Hoja/s de Información al Paciente-Consentimiento/s informado/s, memoria económica y dictamen de aprobación de un CEIC acreditado (si procede). La fecha límite para el envío del resto de documentación será el día 15. En paralelo a la presentación de documentación al CEI debe cumplimentarse el Formulario de Solicitud de Factura por las tasas de evaluación del CEI y enviarse a la siguiente dirección: [email protected] Cuando se presente al CEI una solicitud inicial para la realización de un estudio en el ICO-Badalona, debe enviarse también una copia en paralelo a la siguiente dirección: [email protected] CLICAR AQUÍ PARA DESCARGAR LAS PLANTILLAS DE DOCUMENTACIÓN DEL INVESTIGADOR PRINCIPAL Y EL FORMULARIO DE SOLICITUD DE FACTURA