Titulación Titulación
Anuncio
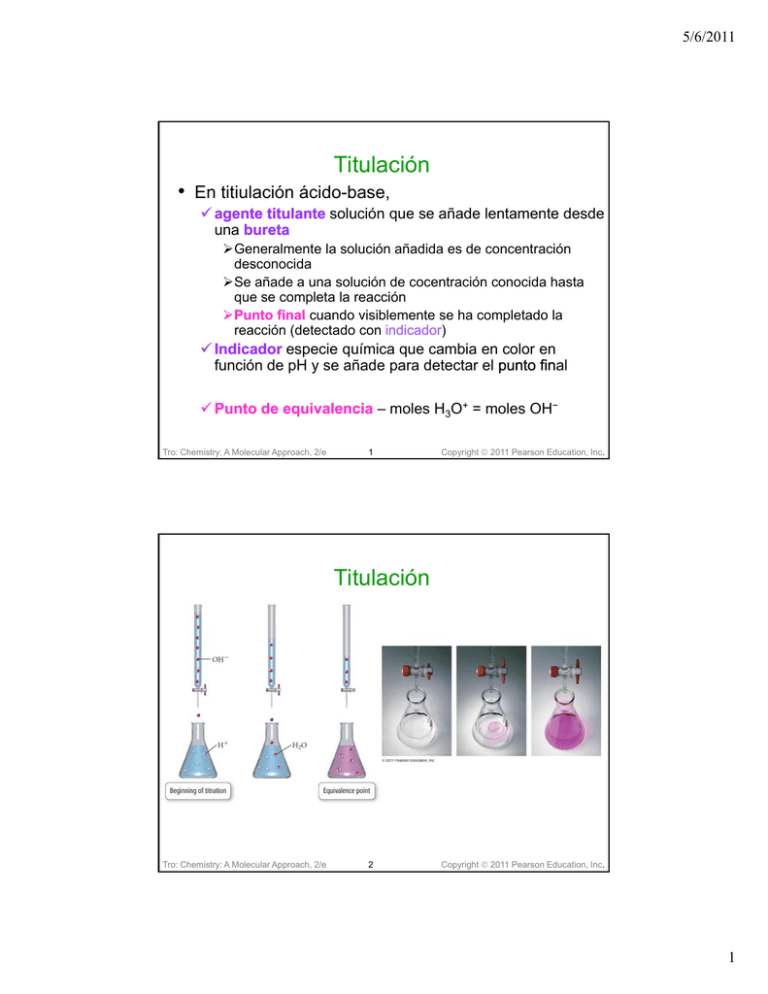
5/6/2011 Titulación • En titiulación ácido-base, agente titulante solución que se añade lentamente desde una bureta Generalmente la solución añadida es de concentración desconocida Se añade a una solución de cocentración conocida hasta que se completa la reacción Punto final cuando visiblemente se ha completado la reacción (detectado con indicador indicador) Indicador especie química que cambia en color en función de pH y se añade para detectar el punto fin final Punto de equivalencia – moles H3O+ = moles OH− Tro: Chemistry: A Molecular Approach, 2/e 1 Copyright 2011 Pearson Education, Inc. Titulación Tro: Chemistry: A Molecular Approach, 2/e 2 Copyright 2011 Pearson Education, Inc. 1 5/6/2011 Curva de Titulación • Gráfica de pH vs. cantidad de agente titulante El punto de inflección es el punto de equivalencia Puntos importantes en la curvas Antes del punto de equivalencia o La solución en el matraz cónico está en exceso, (pH pH observado es cercano al de la solución en el matraz) mat En el punto de equivalencia o El pH depende del pH de la sal en solución » Sal neutral, pH = 7 » Sal acídica,, pH p <7 » Sal básica, pH > 7 Después del punto de equivalencia o La solución de la bureta está en exceso dentro del matraz cónico (pH se aproxima al pH de la solución en la bureta) bureta Tro: Chemistry: A Molecular Approach, 2/e 3 Copyright 2011 Pearson Education, Inc. Cruva de Titulación: Base desconocida añadida a ácido fuerte Tro: Chemistry: A Molecular Approach, 2/e 4 Copyright 2011 Pearson Education, Inc. 2 5/6/2011 Titulación de 25 mL de 0.100 M HCl con 0.100 M NaOH Como la concentración de ambas soluciones son iguales y la estequiometría es de 1:1, el punto de equivalencia se ecuentra en volumen igual Antes pto. equivanlencia (exceso de ácido Tro: Chemistry: A Molecular Approach, 2/e 5 Después p del pto.equivalencia (base en exceso) Punto de Equivalencia Moles HCl = moles NaOH pH = 7.00 Copyright 2011 Pearson Education, Inc. Titulación de 25 mL de 0.100 M HCl con 0.100 M NaOH • HCl(ac) + NaOH(ac) NaCl(ac) + H2O(aq) neutralización Inicial Inicial:: moles H+ = moles HCl punto de equivalencia moles NaOH añadidos = molesiniciales HCl* 0.00 moles HCl y 0.00 moles NaOH (todo todo reacciona reacciona) Como NaCl es una sal neutral, neutral el pH en el punto de equivalencia es 7.00 7 00 Depués punto de equivalencia equivalencia:: pH NaOH en exceso * molesiniciales HCl 0.0250 L x 0.100 mol/L = 2.50 x 10−3 Tro: Chemistry: A Molecular Approach, 2/e 6 Copyright 2011 Pearson Education, Inc. 3 5/6/2011 Titulación de 25 mL de 0.100 M HCl con 0.100 M NaOH pHinicial = −log(0.100) = 1.00 HCl + NaOH NaCl + H2O M V Neutralización M HClVHCl NaOH NaOH 0.100 0.025 0.100 0.005 2.50 x10 5 x10 3 0 4 neutralización HCl ac NaOH ac NaCl ac H 2O 2.5 x10 3 inicial 0 5.0 x10 rx 2.0 x10 final 3 0 Moles HCl Cl− OH− Antes 0.00250 0 ≈0 Añadidos – 0.00200 después 0 4 5.0 x10 4 – 0.00050 0.00050 ≈0 Tro: Chemistry: A Molecular Approach, 2/e Copyright 2011 Pearson Education, Inc. 7 Titulación de 25 mL de 0.100 M HCl con 0.100 M NaOH • • • • HCl(ac) + NaOH(ac) NaCl(ac) + H2O(l) pHinicial = −log(0.100) = 1.00 Molesiniciales HCl = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 Antes del pto. equivalencia 5.0 mL NaOH añadidos 5.0 x 10−4 moles NaOH añadidos HCl molesiniciales 2.50x10 2 50x10-3 NaOH 0 5 0x10-4 5.0x10 moles -5.0x10-4 +5.0x10-4 -5.0x10-4 molesfinales 2.00x10-3 5.0x10-4 [C]nueva Tro: Chemistry: A Molecular Approach, 2/e NaCl 8 0.0667 0.017 0 0 Copyright 2011 Pearson Education, Inc. 4 5/6/2011 Titulación de 25 mL de 0.100 M HCl con 0.100 M NaOH • • • • HCl(ac) + NaOH(ac) NaCl(ac) + H2O(l) pHinicial = −log(0.100) = 1.00 Molesiniciales 0 0250 L x 0 0.100 100 mol/L = 2.50 2 50 x 10−3 i i i l HCl = 0.0250 En el punto de equivalencia 25.0 mL NaOH añadidos 2.5 x 10−3 moles NaOH añadidos HCl NaCl NaOH molesiniciales 2.50x10-3 0 2.50x10-3 moles -2.50x10-3 +2.50x10-3 -2.50x10-3 molesfinales [C]nueva Tro: Chemistry: A Molecular Approach, 2/e • • • • 9 0 2.50x10-3 0 0 0.050 0 Copyright 2011 Pearson Education, Inc. Titulación de 25 mL de 0.100 M HCl con 0.100 M NaOH HCl(ac) + NaOH(ac) NaCl(ac) + H2O(l) pHinicial = −log(0.100) = 1.00 Molesiniciales HCl = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 Después del punto de equivalencia 30.0 30 0 mL L NaOH N OH añadidos ñ did 3.0 x 10−3 moles NaOH añadidos HCl NaCl NaOH molesiniciales 2.50x10-3 0 3.00x10-3 moles -2.50x10-3 +2.50x10-3 -2.50x10-3 molesfinales [C]nueva Tro: Chemistry: A Molecular Approach, 2/e 10 0 2.50x10-3 5.0x10-4 0 0.045 0.0091 Copyright 2011 Pearson Education, Inc. 5 5/6/2011 Añadir 0.100 M NaOH a 0.100 M HCl + 5.0 mL NaOH 0.00200 moles HCl pH = 1.18 +10.0 mL NaOH 0.00150 mol HCl pH = 1.37 + 15.0 mL NaOH 0.00100 mol HCl pH H=1 1.60 60 + 20.0 mL NaOH 0.00050 mol HCl pH = 1.95 + 25.0 mL NaOH equivalence point pH = 7.00 + 30.0 mL NaOH 0.00050 mol NaOH pH = 11.96 + 35.0 mL NaOH 0 00100 mol NaOH 0.00100 pH = 12.22 + 40.0 mL NaOH 0.00150 mol NaOH pH = 12.36 + 50.0 mL NaOH 0.00250 mol NaOH pH = 12.52 +25.0 mL 0.100 M HCl 0.00250 mol HCl pH = 1.00 Tro: Chemistry: A Molecular Approach, 2/e • • • • 11 Copyright 2011 Pearson Education, Inc. Práctica – Calcule el pH de la solcuión que resulta cuando se añden 10.0 mL de 0.15 M NaOH a 50.0 mL de 0.25 M HNO3 HNO3(ac) + NaOH(ac) NaNO3(ac) + H2O(l) pHInicial = −log(0.250) = 0.60 molIniciales HNO3= 0.0500 L x 0.25 mol/L=1.25 x 10−22 Antes del punto de equivalencia 10.0 mL NaOH añadidos HNO3 NaNO3 NaOH molesiniciales 1.25x10-2 0 1.5x10-3 moles −1.5x10-3 +1.5x10-3 −1.5x10-3 molesfinales [C]nueva Tro: Chemistry: A Molecular Approach, 2/e 12 1.1x10-3 1.5x10-3 0 0.018 0.025 0 Copyright 2011 Pearson Education, Inc. 6 5/6/2011 Práctica – Calcule la cantidad de una solución de 0.15 M NaOH que debe añaidr a 50.0 mL de 0.25 M HNO3 para alcanzar punto de equivalencia • • • • HNO3(ac) + NaOH(ac) NaNO3(ac) + H2O(l) pH HInicial = −log(0.250) l (0 250) = 0 0.60 60 Molesiniciales HNO3= 0.0500 L x 0.25 mol/L=1.25 x 10−2 moles En el punto de equivalencia: moles of NaOH = 1.25 x 10−2 Tro: Chemistry: A Molecular Approach, 2/e 13 Copyright 2011 Pearson Education, Inc. Práctica – Calcule el pH de la solución que resulta cuando 100.0 mL de 0.15 M NaOH se añaden a 50.0 mL de 0.25 M HNO3 • • • • HNO3(ac) + NaOH(ac) NaNO3(ac) + H2O(l) pHInicial = −log(0.250) = 0.60 Molesiniciales HNO3= 0.0500 L x 0.25 mol/L=1.25 x 10−2 D Después é del d l pto t equivalencia i l i +100.0 mL NaOH molesiniciales moles HNO3 NaNO3 NaOH 1.25E-2 0 1.5E-2 −1.25E-2 +1.25E-2 −1.25E-2 molesfinales 0 1.25E-2 0.0025 [C]nueva 0 0.0833 0.017 Copyright 2011 Pearson Education, Inc. 7 5/6/2011 Titulación de base fuerte con ácido fuerte • Si el ácido está en la bureta y se descarga a una base en el matraz cónico, la curva de titulación será la parecida a la figura. Tro: Chemistry: A Molecular Approach, 2/e 15 Copyright 2011 Pearson Education, Inc. Titulación de ácido débil con base fuerte • La curva será diferente en la región del punto de equivalencia en y la región de exceso de ácido. El p pH: inicial se determina usando la Ka del ácido débil en la región del exceso de ácido se determina como se determina para los amortiguadores. en la región del punto de equivalencia se determina usando el Kb de la base conjugada del ácido débil después d é del d l punto t de d equivalencia i l i está tá dominado d i d por ell exceso de la La basicidad de el anióbase fuerten (base conjugada) es descartable Tro: Chemistry: A Molecular Approach, 2/e 16 Copyright 2011 Pearson Education, Inc. 8 5/6/2011 Titulación de 25 mL de 0.100 M HCHO2 con 0.100 M NaOH • HCHO2(ac) + NaOH(ac) NaCHO2(ac) + H2O(ac) Rx. Neutralización • pHinicial HCHO2(ac) + H2O(l) CHO2−(ac) + H3O+(ac) [HCHO2] [CHO2−] [H3O+] Inicial 0.100 0.000 ≈0 Cambio −x +x +x equilibrio 0.100 − x x x Ka = 1.8 x 10−4 Copyright 2011 Pearson Education, Inc. 17 Tro: Chemistry: A Molecular Approach, 2/e Titulación de 25 mL de 0.100 M HCHO2 con 0.100 M NaOH • MolesIniciales HCHO2 = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 • HCHO2(ac) + NaOH(ac) NaCHO2 (ac) + H2O(ac) • Antes pto. equivalencia 5.0 mL NaOH añadidos neutralización HCHO2 ac NaOH ac NaCHO2 ac H 2 O 2.5 x10 3 inicial 0 0 5 .0 x10 4 rx 2.0 x10 3 final 0 moles: HA A− OH− antes t 2 50 10-33 2.50x10 0 0 añadidos – – 5.0x10-4 después 2.00x10-3 5.0x10-4 ≈0 Tro: Chemistry: A Molecular Approach, 2/e 18 5 .0 x10 4 Copyright 2011 Pearson Education, Inc. 9 5/6/2011 Titulación de 25 mL de 0.100 M HCHO2 con 0.100 M NaOH • HCHO2(aq) + NaOH(aq) NaCHO2 (aq) + H2O(aq) • Molesiniciales HCHO2 = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 • En pto. de equivalencia 25.0 mL NaOH añadidos Moles: HA A− OH− antes 2.50x10-3 0 0 añadidos – – 2.50x10-3 después 0 2.50x10-3 ≈0 − CHO2−(ac ac)) ac)) + H2O(l) HCHO2( 2(ac ac)) + OH (ac [HCHO2] [CHO2−] [OH−] Inicial 0 0.0500 ≈0 Cambio +x −x +x equilibrio x 5.00x10-2-x x Kb = 5.6 x 10−11 Copyright 2011 Pearson Education, Inc. Titulación de 25 mL de 0.100 M HCHO2 con 0.100 M NaOH • HCHO2(aq) + NaOH(aq) NaCHO2 (aq) + H2O(aq) • Molesiniciales HCHO2 = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 • En pto. de equivalencia 25.0 mL NaOH añadidos − CHO2−(ac ac)) + H2O(l) HCHO2( 2(ac ac)) + OH (ac ac)) [HCHO2] [CHO2−] [OH−] Inicial 0 0.0500 ≈0 Cambio +x −x +x equilibrio x 5.00x10-2-x x Copyright 2011 Pearson Education, Inc. 10 5/6/2011 Titulación de 25 mL de 0.100 M HCHO2 con 0.100 M NaOH • HCHO2(aq) + NaOH(aq) NaCHO2 (aq) + H2O(aq) • Molesiniciales HCHO2 = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 • Después del pto. de equivalencia 30.0 mL NaOH añadidos 3.0 x 10−3 moles NaOH añadidos moles: HA A− NaOH antes 2.50x10-3 0 3.0x10-3 cambio −2.5x10-3 +2.5x10-3 −2.5x10-3 final 0 2.5x10-3 5.0x10-4 molaridad,nueva 0 0.045 0.0091 21 Copyright 2011 Pearson Education, Inc. Adición de NaOH a HCHO2 Tro: Chemistry: A Molecular Approach, 2/e 22 +30.0 mL25.0 NaOH added mLNaOH NaOH 5.0 mL 10.0 initial mol HCHO 2 solution 0.00050 NaOH xs2 equivalence point 0.00200 0.00150 mol HCHO 35.0 mL NaOH 0.00250 mol HCHO pHadded = 11.96 0.00250 3.14mol CHO2− 2 pH = 3.56 0.00100 pH = 2.37 − mol NaOH xs [CHO 2 ]init = 0.0500 M pH = 12.22 − [OH ]eq = 1.7 x 10−6 pH H=8 8.23 23 + 12.5 mL NaOH 0.00125 mol HCHO2 pH = 3.74 = pKa ½ pto. Equ. + 40.0 mL NaOH 0.00150 mol NaOH xs pH = 12.36 + 15.0 mL NaOH 0 00100 moll HCHO2 0.00100 pH = 3.92 + 20.0 mL NaOH 0.00050 mol HCHO2 pH = 4.34 +50.0 mL NaOH 0.00250 mol NaOH xs pH = 12.52 Copyright 2011 Pearson Education, Inc. 11 5/6/2011 Titulación de ácido débil con base fuerte • pH inicial = ácido débil • Antes del punto de equivalencia la solución es una solución amortiguadora Se calculan los moles HAinit y los moles A−init usando la estequiometría de la reacción El pH se calcula usando Henderson-Hasselbalch (basado en HAinit y A−init) • A mitad del punto de equivalencia pH = pKa Tro: Chemistry: A Molecular Approach, 2/e 23 Copyright 2011 Pearson Education, Inc. Titulación de ácido débil con base fuerte • En el punto de equivalencia los moles de HA = moles de Base añadida L solución La l ió resultante lt t tiene ti moles l A− = moles l Ha H originales [A−]init = moles A−/litros totales • Después del punto de equivalencia, el OH está en exceso [OH−] = moles MOH exceso/liltros totales [H3O+][OH−]=1 x 10−14 Tro: Chemistry: A Molecular Approach, 2/e 24 Copyright 2011 Pearson Education, Inc. 12 5/6/2011 Ejemplo 16.7a: Una muestra de 40.0 mL de 0.100 M HNO2 se titula con 0.200 M KOH. Calcule el volumen de KOH en el punto de equivalencia. HNO2 + KOH NO2 + H2O Neutralización M KOHVKOH M HNO2VHNO2 0.200 VKOH 0.100 40.0 1:1 0.100 40.0 20.0 mL VKOH 0.200 Copyright 2011 Pearson Education, Inc. 25 Tro: Chemistry: A Molecular Approach, 2/e Ejemplo 16.7b: Una muestra de 40.0 mL de 0.100 M HNO2 se titula con 0.200 M KOH. Calcule el pH después de añadir 5.00 mL KOH. HNO2 + KOH NO2 + H2O Neutralización M HNO2VHNO2 0.100 0.040 4 00 x103 4.00 M KOHVKOH 0.200 0.005 1.00 x10 0 3 neutralización HNO2 ac KOH ac KNO2 ac H 2O 4.0 x10 3 inicial 0 1.0 x10 3 rx 3.0 x10 3 final 0 Moles HNO2 NO2− OH− Antes 0.00400 0 ≈0 Añadidos – 0.00300 después 0 1.0 x10 3 – 0.00100 0.00100 ≈0 Tro: Chemistry: A Molecular Approach, 2/e 26 Copyright 2011 Pearson Education, Inc. 13 5/6/2011 Ejemplo 16.7b: Una muestra de 40.0 mL de 0.100 M HNO2 se titula con 0.200 M KOH. Calcule el pH después de añadir 5.00 mL KOH. Tabla 15.5 Ka = 4.6 x 10−4 HNO2 + H2O NO2 + H3O+ 0.00100 0.00300 27 Tro: Chemistry: A Molecular Approach, 2/e Copyright 2011 Pearson Education, Inc. Ejemplo 16.7b: Una muestra de 40.0 mL de 0.100 M HNO2 se titula con 0.200 M KOH. Calcule el pH a mitad del punto de equivalencia. HNO2 + KOH NO2 + H2O 0.00400 0.00200 ½ pto pto. de equivalencia, equivalencia moles KOH = ½ moles HNO2 0.00200 0.00200 HNO2 + H2O NO2 + H3O+ Moles HNO2 NO2− OH− Antes 0.00400 0 ≈0 Añadidos – 0.00200 después pH = pKa – 0.00200 0.00200 ≈0 Tro: Chemistry: A Molecular Approach, 2/e 28 Copyright 2011 Pearson Education, Inc. 14 5/6/2011 Base débil con ácido fuerte Material suplementario Copyright 2011 Pearson Education, Inc. Práctica – Titulación de 25.0 mL de 0.10 M NH3 (pKb = 4.75) con 0.10 M HCl. Calcule el pH de la solución después de añadir 5.0 mL de HCl. • NH3(ac) + HCl(ac) NH4Cl(ac) • Molesiniciales NH3 = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 • Antes del pto de equivalencia: 5.0 mL de HCl añadidos NH4+(aq) + H2O(l) NH4+(aq) + H2O(l) pKb = 4.75 pKa = 14.00 − 4.75 = 9.25 moles NH3 NH4Cl HCl antes 2.50x10-3 0 5.0x10-4 cambio −5.0x10-4 −5.0x10-4 −5.0x10-4 finles 2.00x10-3 5.0x10-4 0 0.0667 0.017 0 [C]nueva Tro: Chemistry: A Molecular Approach, 2/e 30 Copyright 2011 Pearson Education, Inc. 15 5/6/2011 Práctica – Titulación de 25.0 mL de 0.10 M NH3 (pKb = 4.75) con 0.10 M HCl. Calcule el pH de la solución en el pto de equivalencia • En el pto de equivalencia lo moles NH3 = moles HCl = 2.50 x 10−3 moles NH3 NH4Cl HCl antes 2.50x10-3 0 5.0x10-4 cambio −2.5x10-3 −2.5x10-3 −2.5x10-3 finles 0 2.5x10-3 0 [C]nueva 0 0.050 0 [NH3] 25.0 mL HCl añadido NH4+(ac) + H2O(l) NH3(ac) + H3O+(ac) [NH4+] [H3O+] initial 0 0.050 ≈0 change +x −x +x equilibriu m x 0.050−x x Tro: Chemistry: A Molecular Approach, 2/e 31 Copyright 2011 Pearson Education, Inc. Práctica – Titulación de 25.0 mL de 0.10 M NH3 (pKb = 4.75) con 0.10 M HCl. Calcule el pH de la solución después de añadir 30 mL de HCl • NH3(ac) + HCl(ac) NH4Cl(ac) • Molesiniciales NH3 = 0.0250 L x 0.100 mol/L = 2.50 x 10−3 • Después del pto de equivalencia: 30.0 mL de HCl añadidos moles NH3 NH4Cl HCl antes 2.50x10-3 0 3.0x10-3 cambio −2.5x10-3 +2.5x10-3 −2.5x10-3 finles 0 2.5x10-3 5.010-4 [C]nueva 0 0.045 0.0091 Cuando mezcla ácido fuerte, HCl, con ácido débil, NH4+, solo considere el fuerte Tro: Chemistry: A Molecular Approach, 2/e 32 Copyright 2011 Pearson Education, Inc. 16 5/6/2011 Monitoreo del pH durante una Titulación • Medida de conductividad por [H3O+] usando un sensor que mida H3O+ específicamente • El punto final de una titulación se alcanza en el punto de equivalencia – en el punto de inflección de la curva Si sabe la cantidad necesaria para llegar al punto final, se monitorea con un indicador Tro: Chemistry: A Molecular Approach, 2/e 33 Copyright 2011 Pearson Education, Inc. Monitoreo de pH durante una titulación Tro: Chemistry: A Molecular Approach, 2/e 34 Copyright 2011 Pearson Education, Inc. 17 5/6/2011 Indicadores • Muchos tintes cambian de color dependiendo el pH de la solución Son ácidos débiles con equilbrio q HInd(ac) + H2O(l) Ind(ac) + H3O+(ac) El color de la solución depende de la conentración relativa de Ind:HInd Cuando Ind:HInd ≈ 1, el color será una mezcla de los colores de Ind y HInd Cuando Ind:HInd > 10,, el color será el color de Ind Cuando Ind:HInd < 0.1, el color será de HInd Tro: Chemistry: A Molecular Approach, 2/e 35 Copyright 2011 Pearson Education, Inc. Fenoftaleína Tro: Chemistry: A Molecular Approach, 2/e 36 Copyright 2011 Pearson Education, Inc. 18 5/6/2011 Rojo de Metilo (CH3)2N H C H C C H C H C C N H3O+ H C (CH3)2N OH- N H C N N H C C C H H C H C C CH NaOOC H C C C H N H C N C C H CH C C H NaOOC Tro: Chemistry: A Molecular Approach, 2/e 37 Copyright 2011 Pearson Education, Inc. Monitoreo de Titulación con indicador pKa de HInd ≈ pH en el punto de equivalencia Indicadores ácido-base Tro: Chemistry: A Molecular Approach, 2/e 38 Copyright 2011 Pearson Education, Inc. 19 5/6/2011 Equilibrio de Solubilidad • Todos los compuestos iónicos se disuelven en agua en cierto grado Aquellos con solubilidad bien baja se clasifican como insolubles • Se aplica el concepto de equilbrio a las sales y se usa la constante de equilbrio q para medir la p solubilidad relativa en agua Tro: Chemistry: A Molecular Approach, 2/e 39 Copyright 2011 Pearson Education, Inc. Producto de Solubilidad • La constante de equilbrio para la disociación de una • • sal en sus iones en medio acuoso se llama constante de producto de solubilidad, solubilidad Ksp Para sólido iónico MnXm, la reacción de disociación es: MnXm(s) nMm+(aq) + mXn−(aq) El producto de solubilidad es: Ksp = [[Mm+]n[[Xn−]m Ejemplo: la disociación de la reacción de PbCl2 es PbCl2(s) Pb2+(aq) + 2 Cl−(aq) La constante de equilibrio es Ksp = [Pb2+][Cl−]2 Tro: Chemistry: A Molecular Approach, 2/e 40 Copyright 2011 Pearson Education, Inc. 20 5/6/2011 Tro: Chemistry: A Molecular Approach, 2/e 41 Copyright 2011 Pearson Education, Inc. Solubilidad Molar • Solubilidad es la cantidad de soluto que se disuelve en una cantidad dada de solución A una ttemperatrua t dada d d • La solubilidad molar es el número de moles de soluto que se disuelven en un litro de solución Es la molaridad del soluto disuelto en una solución saturada Para la reacción general MnXm(s) nMm+(ac) + mXn−(ac) Tro: Chemistry: A Molecular Approach, 2/e 42 Copyright 2011 Pearson Education, Inc. 21 5/6/2011 Ejemplo 16.8: Calcule la solubilidad molar de PbCl2 en agua pura a 25 C, Kps = 1.17 x 10-5 P b C l 2 s P b 2 ac 2 C l a c 2x 2s x s 2 K ps P b 2 C l s 2 s 4 s 3 [Pb2+] Inicial 2 [Cl−] 0 0 Cambio +S +2S Equilibrio S 2S Copyright 2011 Pearson Education, Inc. 43 Tro: Chemistry: A Molecular Approach, 2/e Práctica – Determine el Ksp de PbBr2 si la solubilidad molar en agua a 25 C es 1.05 x 10−2 M P b B r2 s P b 2 a c 2 B r ac 2x 2s x s 2 K ps P b 2 B r s 2 s 4 s 3 Inicial [Pb2+] [Br−] 0 0 10−2) Cambio +(1.05 x equilibrio (1.05 x 10−2) 2 +2(1.05 x 10−2) (2.10 x 10−2) Tro: Chemistry: A Molecular Approach, 2/e 44 Copyright 2011 Pearson Education, Inc. 22 5/6/2011 Práctica – Determine el Ksp de PbBr2 si la solubilidad molar en agua a 25 C es 1.05 x 10−2 M P b B r2 s P b 2 a c 2 B r a c 2 K p s P b 2 B r s 2 s 4 s 3 2 K p s 4 s 3 4 1 . 0 5 x1 0 2 4 . 6 3 x1 0 6 3 K p s s 2 s 1 . 0 5 x1 0 2 2 1 . 0 5 x1 0 2 2 2 K p s 1 . 0 5 x1 0 2 2 . 1 0 x1 0 2 4 . 6 3 x1 0 6 2 Tro: Chemistry: A Molecular Approach, 2/e 45 Copyright 2011 Pearson Education, Inc. Ksp y Solubilidad Relativa • Tomar en consideración la estequiometría El efecto de ión común sobre la solubilidad • Añadir una sal soluble que contenga uno de los iones de la sal insoluble disminuye la solubilidad de la insoluble Ejemplo NaCl añadido a PbCl2 disminuye la solubilidad de PbCl2 (Le Chatelier) PbCl2(s) Pb2+(aq) + 2 Cl−(aq) Añadir Cl− desplaza el equilibrio hacia la izquierda Tro: Chemistry: A Molecular Approach, 2/e 46 Copyright 2011 Pearson Education, Inc. 23 5/6/2011 Ejemplo 16.10: Calcule la solubilidad molar de CaF2 en 0.100 M NaF a 25 C [Ca2+] [F−] Inicial 0 0.100 cambio +S +2S equilibrio S 0.100 + 2S s C a F2 2 Ca a c 2F a c 0 .1 0 .1 2 s s K ps C a F 2 2 s 0 . 1 2s 2 s 0 . 1 2 1 . 4 6 x 1 0 1 0 s 0 . 1 K ps 2 1 .4 6 x1 0 0 . 1 2 10 s 1 .4 6 x1 0 Tro: Chemistry: A Molecular Approach, 2/e 8 Copyright 2011 Pearson Education, Inc. 47 Práctica – Determine la concentración de los iones de Ag+ en agua de mar que tiene [Cl−] igual 0.55 M AgCl(s) Ag+(aq) + Cl−(aq) S 0.55 + S Ksp = [Ag+][Cl−] Inicial [Ag+] [Cl−] 0 0.55 Cambio +S +S equilibrio S 0.55 + S Tro: Chemistry: A Molecular Approach, 2/e 48 Ksp = [Ag [A +][Cl−] Ksp = (S)(0.55 + S) Ksp = (S)(0.55) Copyright 2011 Pearson Education, Inc. 24 5/6/2011 El Efecto de pH en la Solubilidad • Para hidróxidos iónicos insolubles, a mayor pH, menor la solubilidad Menor pH, mayor la solubilidad Mayor pH = [OH−] aumenta • M(OH)n(s) Mn+(aq) + nOH−(aq) Los sólidos iónicos insolubles que contiene aniones de ácidos débiles, a menor pH, mayor la solubilidad M2(CO3)n(s) 2 Mn+(ac) + nCO32−(ac) H3O+(ac) + CO32− (ac) HCO3− (ac) + H2O(l) Tro: Chemistry: A Molecular Approach, 2/e 49 Copyright 2011 Pearson Education, Inc. Precipitación • Ocurre cuando la concentración de los iones • excede la solubilidad del compuesto iónico C Comparación ió d de Q,de Q d lla solución l ió con ell Ksp, se puede determinar si ocurre precipitación Q = Ksp, solución saturada, no hay precipitación Q < Ksp, solución insaturada, no hay precipitación Q > Ksp, solution está más allá de saturación, se precipita • Algunas soluciones con Q > Ksp no precipitan a menos que se perturben – se llaman solución sobresaturada Tro: Chemistry: A Molecular Approach, 2/e 50 Copyright 2011 Pearson Education, Inc. 25 5/6/2011 Solución sobresaturada se precipita si se añade un cristal semilla Ocure precipitación si Q > Ksp Tro: Chemistry: A Molecular Approach, 2/e 51 Copyright 2011 Pearson Education, Inc. Ejemplo 16.12: ¿Se formará precipitado cuando se mezclan Pb(NO3)2(ac) con NaBr(ac) si la concentración al mezclar es 0.0150 M y 0.0350 M respectivamente? Pb(NO3)2(aq) + 2 NaBr(aq) → PbBr2(s) + 2 NaNO3(aq) NaBr = 0.0350 M Na+ = 0.0350 M, Br− = 0.0350 M Pb(NO3)2 = 0.0150 0 0150 M Pb2+ = 0.0150 M, NO3− = 2(0.0150 M) Ksp of PbBr2 = 4.67 x 10–6 PbBr2(s) Pb2+(ac) + 2 Br−(ac) Q < Ksp, no precipitación Tro: Chemistry: A Molecular Approach, 2/e 52 Copyright 2011 Pearson Education, Inc. 26 5/6/2011 Práctica – Se formará precipitado cuando Ca(NO3)2(ac) se mezcla con NaOH(ac) si las concentraciones después de mezclar son iguales a 0.0175 M para ambas especies? Ca(NO3)2(ac) + 2 NaOH(ac) → Ca(OH)2(s) + 2 NaNO3(ac) Ca(NO3)2 = 0.0175 0 0175 M 2+ Ca = 0.0175 M, NO3− = 2(0.0175 M) NaOH N OH = 0.0175 0 0175 M + Na = 0.0175 M, OH− = 0.0175 M Ksp of Ca(OH)2 = 4.68 x 10–6 Ca(OH)2(s) Ca2+(ac) + 2 OH−(ac) Q > Ksp, se precipita Tro: Chemistry: A Molecular Approach, 2/e 53 Copyright 2011 Pearson Education, Inc. 27





