FÍSICA II Guía De Problemas Nº4: Energía
Anuncio

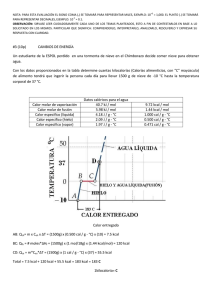
Lic. María Raquel Aeberhard Universidad Nacional del Nordeste Facultad de Ingeniería Departamento de Físico-Química/Cátedra Física II FÍSICA II Guía De Problemas Nº4: Energía 1 Lic. María Raquel Aeberhard PROBLEMAS RESUELTOS 1 – Hallar la energía requerida para calentar0,454 kg de aire desde 555 ºK hasta 1110,5 ºK. a presión constante, utilizando: a) el calor específico variable (obtenido de tablas) donde c p (6,3712 0,001595T )kcal / kmol º K , sabiendo que el peso molecular del aire es 28,96 kg/kmol, y b) el calor específico constante c p 0,24kcal / kg .º K . SOLUCIÓN Cuando un sistema de masa m absorbe calor, provocando en el mismo un incremento de temperatura dt, siendo Q el calor absorbido, se denomina calor específico a la siguiente Q m.dt De aquí Q m.c.dt (2) relación: c (1) De acuerdo a los datos del problema: M = 0,454 kg ; T1 = 555 ºK ; T2 = 1110.5 ºK ; P = cte c c p a) Primeramente se determina la energía requerida para calentar la masa m de aire cuyo peso molecular es 28,96 kg/kmol, cuando el calor específico, obtenido de tablas, viene dado por la expresión c p ( 6,3712 0,001595T ) kcal / kmol º K por lo tanto de (2): Q m PM T2 T1 (6,3712 0,001595T )kcal / kmol º K .dT 67,28kcal b) Se determina, a continuación, la energía requerida para calentar la masa m de aire siendo el calor específico del mismo c p 0,24kcal / kg .º K De la ecuación (2): Q m.c.t 0, 454kg .0, 24kcal / kg.º K (1110,5 555)º K 60,5kcal 2 - Se introduce un bloque de plomo de 300 g que está a 100ºC en 100 g de agua a 15 ºC contenida en un calorímetro de latón de 200 g de masa. Cuál es la temperatura final de la mezcla siendo los calores específicos correspondientes: c Pb 0,030cal / g .º C , c H 2O 1cal / g .º C y clatón 0,09cal / g .º C SOLUCIÓN Al introducir el plomo dentro del calorímetro, el calor cedido por el bloque, que está a mayor temperatura, es absorbido por el agua y el calorímetro de latón, ambos a la misma temperatura. Luego de cierto tiempo el sistema (bloque, calorímetro y agua) se encuentra en equilibrio térmico -tienen la misma temperatura final-. 2 Lic. María Raquel Aeberhard Esquema Problema 2 Por lo tanto: Qcedido Qabsorbido (1) Qcedido m Pb .c Pb .t Pb como Q m.c.t y donde t Pb t finalPb t inicialPb Qabsorbido m H 2O .c H 2O .t H 2O mlatón .clatón .t latón Por (1) : donde H 2O t latón t finalH 2O t inicialH 2O m Pb .c Pb .t Pb m H 2O .c H 2O .t H 2O mlatón .clatón .t latón Reemplazando los datos y despejando tfinal ( sabiendo que t finalPb t finalH 2 O t finallatón por encontrarse el sistema en equilibrio térmico): t 21º C 3 – Un salón de clases tiene 6,1 m x 4,57 m x 3,66 m. Calcular a) Cuánto calor se requiere para elevar la temperatura del aire contenido en el salón desde 15,6 ºC hasta 21,1 ºC a presión constante - densidad del aire a 15.6 ºC = 1.12 kg/m3. b) Cuánto carbón, cuyo calor de combustión es de 6650 kcal/kg, tendrán que quemarse para proporcionar el calor necesario. Considerar que la eficiencia del horno es de 25%. SOLUCIÓN Según los datos del problema las dimensiones del salón de clases son las siguientes: 6,1 m , 4,57 m y 3,66 el volumen será V salón 102m 3 a) Se determina la cantidad de calor necesario para elevar la temperatura del salón desde 15.6 ºC hasta 21.1 ºC a presión constante sabiendo que la densidad del aire es 1,12kg / m 3 : Q m.c p .t (V . ).c p .t y reemplazando valores: 3 Lic. María Raquel Aeberhard Q (102m 3 .1,12kg / m 3 ).0,24kcal / kg.º K .5,5º K 150,8kcal Tener en cuenta que t (º C ) T (º K ) b) Se determina a continuación la cantidad de carbón que se debe quemar para proporcionar la cantidad de calor necesario, sabiendo que la eficiencia del horno es de 25% y el carbón de combustión del carbón de 6650 kcal/kg: Si la eficiencia del horno es de 25% entonces la cantidad de calor real necesario para elevar la temperatura del salón será: Q 150,8kcal 603,2kcal 0,25 De aquí que la cantidad de carbón que se deben quemar para proporcionar 607,2 kcal serán: cantidaddecarbón 603,2kcal 0,091kg 6650kcal / kg Es decir que se deben quemar 91g de carbón para proporcionar 603,2 kcal y, como las pérdidas son del 75%, se obtendrán realmente 150.8 kcal para incrementar la temperatura del salón 5.5 ºK . EJERCICIOS PROPUESTOS TEMA 4: PRIMER PRINCIPIO DE LA TERMODINÁMICA - ENERGÍA 1. Calcular mediante los siguientes datos las capacidades caloríficas de un átomo gramo de Al, Cu, Pb, y Hg y comparar los resultados con los valores predichos por Dulong y Petit. Los calores específicos correspondientes son: Al = 0,217 cal / gr. °C ; Cu = 0,093 cal / gr. °C ; Pb = 0,031 cal / gr. °C ; Hg = 0,033 cal / gr. °C. Los pesos atómicos son Al = 26,97 gr./at ; Cu = 63,54 gr./at ; Pb = 207,61 gr./at y Hg = 200,61 gr./at. Valor Predicho por Dulong y Petit: 6,4 cal/at°C. 2. Una masa de hierro de 30 gr. es calentada a P=cte desde 25 °C hasta 150 °C. Calcular, expresando el resultado en joule, la cantidad de calor necesario para aumentar la temperatura, sabiendo que el calor específico medio del hierro es cp = 0,1092 cal / gr. °C. 3. Calcular: a) cuánto calor se requiere para elevar la temperatura de 800 gr. de cobre, calor específico c = 0,093 cal / gr.°C, desde 20 °C a 80 °C y b) la capacidad calorífica media del cobre en tales condiciones. 4. Una pieza de fundición que pesa 50 kg es sacada de un horno a una temperatura de 500 °C e introducida en un tanque que contiene 400 kg de aceite a 25 °C. La temperatura final es de 38 °C y el calor específico del aceite 0,5 kcal. / kg °C. Calcular el calor específico 4 Lic. María Raquel Aeberhard de la fundición despreciando la capacidad calorífica del tanque y todas las pérdidas caloríficas. 5. Se agregaron 1000 gr. de agua hirviendo a temperatura de 100 °C a una tetera de aluminio a 20 °C, después de lo cual la temperatura de ambos sistemas fue de 86 °C. Calcular: a) cuánto calor absorbió el aluminio, b) la masa de la tetera. Despreciar las pérdidas de calor al medio ambiente. cAl = 0,212 cal / gr ºC. 6. Qué cantidad de calor expresada en calorías y en BTU se requiere para elevar la temperatura de 150 lts de agua contenida en un depósito, desde la temperatura de 15 °C hasta 60 °C. Si el agua es calentada por la combustión de gas de alumbrado cuyo poder calorífico es de 5600 kcal./m3 , cuántos m3 de gas tendrán que quemarse si las pérdidas son de un 20 %. Si el agua se calentara mediante un calentador eléctrico, cuántos kwh serían necesarios suponiendo que su rendimiento es igual al 100%. (1BTU = 252 cal) 7. La instalación de calefacción de una casa quema 10 Tn de carbón. Si las pérdidas totales son del 15 %, cuántas kcal se utilizaron realmente para calentar la casa?. Calcular también las dimensiones que tendría un depósito de agua que almacenara la energía calorífica suponiendo que el agua se calienta a 50 °C en el verano y se enfría hasta 25 °C en el invierno. Calor de combustión del carbón 6500 kcal./ kg. 5