- Ninguna Categoria
Diapositiva 1 - Alumno U.Bolivariana
Anuncio
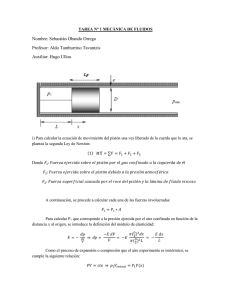
OPERACIONES UNITARIAS I Ing. Alicia Pérez Olivares. 1 BREVE DESCRIPCIÓN DEL CURSO: Asignatura conducente a entregar a los alumnos los conocimientos y fundamentos de la operaciones unitarias que se observan en las industrias, su modelamiento, control y diseño de equipamiento. OBJETIVOS GENERALES DE LA ASIGNATURA: Al finalizar la asignatura, el alumno estará en condiciones de conocer y comprender los principios y fundamentos de las operaciones unitarias industriales, considerando los fenómenos de transporte de fluidos, transferencia de calor y balances de materia y energía, en sistemas con y sin cambios químicos. METODOLOGIA DE EVALUACIÓN: Por definir. 2 UNIDADES: 1.- Escurrimiento de fluidos. 2.-Transferencia de calor. 3. Transporte y mezclado de sólidos. 4.- Balances de Materia y Energía en sistemas de procesos 5.- Sistemas Reaccionantes BIBLIOGRAFIA: •Mecánica de fluidos / / Frank M. White ; México : : McGraw-Hill,, 1988. •Operaciones unitarias en ingeniería química / Warren L. McCabe, Julian C. Smith, Peter Harriott ; Madrid : McGraw-Hill, 1991. •Procesos de transporte y operaciones unitarias / / Christie J. Geankoplis ; México : Continental,, 1998. •Termodinámica técnica fundamental / M. W. Zemansky, H. C. VanNess ; Madrid : Aguilar, 1972 3 MÓDULO I ESCURRIMIENTO DE FLUIDOS 4 1.- Principios Básicos ¿Qué es un Fluido? Cuando se observa algo que tiene la capacidad de moverse en cualquier medio sin conservar su forma original, entonces puede llamarse fluido. Estado de la materia que no tiene volumen definido debido a su poca cohesión intermolecular, por lo tanto este se adapta a la forma del recipiente que lo contiene, y además son poco resistibles a fuerzas tangenciales o cortantes, es decir cualquier fuerza grande o pequeña que se le aplique a un fluido, este enseguida se pondrá en movimiento. De los estados de la materia se consideran fluidos los líquidos y los gases. 5 Propiedades de los fluidos Los fluidos poseen propiedades que los definen, como presión (P), temperatura (T), densidad (ρ), volumen (V), peso (P) viscosidad (µ) etc. Los valores de las propiedades son los que definen en que estado se encuentra un sistema. Propiedades Intensivas y Extensivas Intensivas: Son funciones de masa Ej.: Volumen, Peso. Extensivas: Son funciones de punto, independiente de la masa. Ej.: Presión, Temperatura. 6 Densidad La densidad de un cuerpo es la relación que existe entre la masa del mismo dividida por su unidad de volumen. Densidad (ρ) = masa / volumen Unidades S.I: [Kg/m3 ] Densidad del Agua: a 1 [atm] ρH2O= 1[g/cm3] = 1000 [Kg/m3] T: 4ºC ρH2O= 1000 – (T-4)/180 [Kg/m3] T: ºC, Para cualquier temperatura 7 Densidad del Mercurio: ρ Hg= 13.600 [Kg/m3] Densidad del Aire: ρ aire = 1,293 [Kg/m3] Densidad Relativa La densidad relativa de un cuerpo es un número adimensional establecido por la relación entre el peso de un cuerpo y el peso de un volumen igual de una sustancia que se toma como referencia. D.R= ρ Sustancia / ρ H2O (estándar) Líquidos D.R= ρ Sustancia / ρ aire (estándar) Gases 8 Peso Específico El peso específico de una sustancia se puede definir como la relación entre el peso de la sustancia por su unidad de volumen. Peso específico (γ) = peso / volumen [N/m3] (γ)= P/ V = m * g / V = ρ* g g = aceleración de la gravedad = 9.81 [m/s2] 9 En el Sistema Técnico se mide en kilogramos–fuerza por metro cúbico: [Kgf/m3] Como el kilogramo fuerza representa el peso de un kilogramo en la Tierra, el valor numérico de esta magnitud, expresada en [Kgf/m3], es el mismo que el de la densidad, expresada en [Kg/m3]. 10 Problema 1 Si la densidad de un líquido es de 835 [Kg/m3], determinar su peso específico y su densidad relativa. (γ)= ρ* g = 835 [Kg/m3] * 9.81 [m/s2] = 8191,35 [N/m3] 1 N = [Kg*m/s2] (Newton) D.R= ρ Sustancia / ρ H2O (estándar) = 835 [Kg/m3] / 1000 [Kg/m3] = 0,835 11 Tensión Superficial Indica la cantidad de trabajo que debe realizarse para llevar una molécula del interior de un líquido hasta la superficie. Capilaridad Se define como la capacidad que tiene una columna de un líquido para ascender y descender en un medio poroso. La capilaridad está influenciada por la tensión superficial y depende de las magnitudes relativas entre las fuerzas de cohesión, las fuerzas de adhesión del líquido y las paredes del medio. Cuando se trabaja en medios porosos con diámetros menores de 10 mm, es importante a considerar. 12 2.- Gases ideales Se dice que una sustancia en estado gaseoso se comporta como un gas ideal cuando obedece con exactitud a las leyes de los gases que se detallan a continuación: Ley de Boyle A temperatura constante, el volumen (V) que ocupa una masa definida de gas es inversamente proporcional a la presión aplicada (P). V α 1/P → V* P =Cte Cantidad de Gas (n) y Temperatura constante. P1*V1=P2*V2 13 Ley de Charles A presión constante, el volumen (V) que ocupa una masa dada de gas es directamente proporcional a su temperatura absoluta (T). VαT → V= cte * T (n,P ctes) V1 / T1 = V2 / T2 Las temperaturas han de expresarse en Kelvin 14 Ley de Gay-Lussac Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante. Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar. Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor: P / T = cte P1 / T1 = P2 / T2 15 Ley de Avogadro A la misma temperatura y presión, volúmenes iguales de gases contienen el mismo número de moléculas (n: Nº de moles) Vα n → V=Cte* n (P,T ctes) V1 / n1 = V2 / n2 A partir de combinar estas leyes de los gases ideales, se obtiene la ecuación de los gases ideales. 16 Ley de los Gases Ideales La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es: P*V= n*R*T V=n *Ѵ P* Ѵ=R*T Ѵ=1 / ρ P / ρ = R*T ρ=P / (R*T) Donde: P = Presión absoluta (medida en atmósferas) [atm] V = Volumen [L] n = Moles de Gas [mol] R = Constante universal de los gases ideales (R = 0,082 atm·L/(mol·K)) T = Temperatura absoluta [K] TºK= TºC + 273,15 ºC Ѵ= Volumen específico molar [m3/Kg*mol] 17 Procedimiento alternativo En caso de que la cantidad de sustancia fuese dada en masa en lugar de moles, a veces es útil una forma alternativa de la ley. El número de moles (n) es igual a la masa (m) dividido por la masa molar (M) n= m /M Donde queda P* V= m*R*T / M m/V = ρ -> P= m*R*T / (V* M) -> P= ρ*R*T / M 18 Problema 2 Un gas con peso molecular 44 [g/mol] esta a una presión de 0,9 [MPa] y a una temperatura de 20[º C]. Determine su densidad. Se tiene M= 44 [g/mol] ; P= 0,9 [MPa] ; T = 20 [º C] ; ρ = x P*V= n*R*T ; n= m /M ; Remplazando P*V = (m/M) *R*T P= m *R*T / (V*M) en donde m/V = ρ , remplazando ρ = P*M / R*T Observación: P en [atm] por lo tanto 0,9 [MPa] = x [atm] 1 [atm] = 100 [KPa] → 0,9 [MPa] = 9 [atm] 19 Desarrollo: ρ = P*M / R*T ρ = 9 [atm] * 44 [g/mol] / (0,082 [atm·L/(mol·K)]* (273+20) [K]) ρ = 16,48 [g/L] = 16,48 [Kg/m3] 20 Observación : La ecuación de los gases ideales nos permite calcular una de las variables del gas (P,V,T ó n) a partir de conocer las tres restantes. Cuando un gas sufre una trasformación sus variables P, V ó T, y siempre y cuando se mantenga la misma cantidad de gas (n), existe una ecuación resultante de la ecuación de los gases ideales que permite relacionar las variables del gas ( P, V y T) del estado inicial y final de la trasformación. P1*V1 / T1 = P2*V2 / T2 21 3.- Estática de Fluidos La estática de fluidos es el estudio de fluidos en los que no hay movimiento relativo entre sus partículas. Si no hay movimiento relativo, no existen esfuerzos cortantes, el único esfuerzo que existe es un esfuerzo normal, la presión, por lo que ésta es de primordial importancia en la estática de fluidos. Concepto de Presión La presión promedio se calcula al dividir la fuerza normal que empuja contra un área plana entre dicha área. P= F/A S.I se mide [N/m2] = [Pa] Patm = = 1 [atm] = 1,013* 105 [Pa] ≈ 100 KPa 22 De manera particular la presión puede expresarse como presión manométrica y presión absoluta. Estos conceptos de la presión se encuentran referidos a un nivel de presión determinado (nivel de referencia de la presión), que en el caso de la presión absoluta es cero, que es la mínima presión alcanzable cuando se tiene el vacio absoluto. Las presiones manométricas se encuentran referidas a la presión atmosférica. Pman = Pabs - Patm (para presiones superiores a la Patm) Pvac = Patm – Pabs (para presiones inferiores a la Patm) Donde Pman= Presión manométrica Pvac= Presión de vacío Pabs= Presión absoluta Patm= Presión atmosférica 23 Fluidos Compresibles e Incompresibles Llamaremos fluido compresible a aquel cuya densidad en un recipiente depende de la profundidad a que nos encontremos. Fluido incompresible es aquel cuya densidad es constante, independiente de la profundidad. (H2O prácticamente incompresible) Los gases son en general muy compresibles, en cambio, la mayoría de los líquidos tienen una compresibilidad muy baja. Por ejemplo, una presión de 500 kPa provoca un cambio de densidad en el agua a temperatura ambiente de solamente 0.024%, en cambio esta misma presión aplicada al aire provoca un cambio de densidad de 250%. Por esto normalmente al estudio de los flujos compresibles se le conoce como dinámica de gases 24 Clasificación Los flujos compresibles pueden ser clasificados de varias maneras, la más común usa el número de Mach (M) como parámetro para clasificarlo. M = V/a Donde V es la velocidad del flujo y a es la velocidad del sonido en el fluido. Prácticamente incompresible: M < 0.3 en cualquier parte del flujo. Las variaciones de densidad debidas al cambio de presión pueden ser despreciadas. El gas es compresible pero la densidad puede ser considerada constante. Flujo subsónico: M > 0.3 en alguna parte del flujo pero no excede 1 en ninguna parte. No hay ondas de choque en el flujo. 25 Flujo transónico: 0.8 ≤ M ≤ 1.2. Hay ondas de choque que conducen a un rápido incremento de la fricción y éstas separan regiones subsónicas de hipersónicas dentro del flujo. Debido a que normalmente no se pueden distinguir las partes viscosas y no viscosas este flujo es difícil de analizar. Flujo supersónico: 1.2 < M ≤ 5. Normalmente hay ondas de choque pero ya no hay regiones subsónicas. El análisis de este flujo es menos complicado. Flujo hipersónico: M > 5. Los flujos a velocidades muy grandes causan un calentamiento considerablemente grande en las capas cercanas a la frontera del flujo, causando disociación de moléculas y otros efectos químicos. 26 Variación de la presión con la altura en un fluido incompresible. En un fluido cualquiera en reposo, la presión depende de la profundidad. Esta variación de presión se debe a la fuerza gravitatoria que experimentan las partículas del fluido, o dicho de otra manera, al peso del que se encuentra por encima. La diferencia de presiones entre dos puntos a distintos niveles en un líquido viene dada por: P2 –P1 = γ (h2-h1) [N/m2] ó [Kg/m2] 27 Donde P= Presión [Pa] γ= Peso especifico [N/m3] ó [Kg/m3] h= altura [m] P2 –P1 = γ (h2-h1) -> P2 –P1 = ρ*g (h2-h1) Puntos importantes como consecuencia •Dos puntos del fluido a la misma profundidad tienen la misma presión. •La presión NO depende de la forma del recipiente. 28 Problema 3 Un dispositivo de exploración de las profundidades del mar tiene una ventana de área 0,10 [m2]. ¿Qué fuerza es ejercida sobre ella por el agua de mar (densidad 1.030 [Kg/m3]) a la profundidad de 5.000 [m]? 29 Datos: Área= 0,1 [m2] ρ= 1.030 [Kg/m3] Δh = 5.000 [m] Patm = 100 KPa F2= x Desarrollo P=F/A → P2 = F2 / A2 P2 –P1 = ρ*g (h2-h1) F2 = A2 * P2 P2 –Patm = ρ*g* Δh P2= ρ*g* Δh + Patm 30 P2 = 1.030 [Kg/m3] * 9,8 [m/s2]* 5.000 [m] + 100.000 [Pa] P2 = 50.470.000 [Kg/m*s2] + 100.000 [Kg/m*s2] P2 = 50.570.000 [Kg/m*s2] 1[Pa] = [N/m2] F2 = A2 * P2 F2 = 0,1 [m2] * 50.570.000 [Kg/m*s2] F2 = 5.057.000 [N] = 5,05*106 [N] 31 Variación de la presión con la altura en un flujo compresible A partir de: Si el fluido es un gas ideal en reposo a temperatura constante, se tiene P / ρ = P0 / ρ0 Ecuación para la variación de presión en un gas isotérmico en función de la elevación. P= P0 * exp [ - (z – zo) / (Po/ g*ρo) ] P = P0 * exp-(z– zo)g/RT Valores para la Estratosfera, en donde se supone una Tº constante. 32 Ecuación para la variación de presión de un gas al presentarse gradiente de temperatura. Se tiene: La temperatura (T) a una altura z está dada por: T = T0 – α * (z – z0) Donde T0 es la temperatura a un nivel de referencia z0. La presión (P) a una altura z está dada por: P = P0*[(T0 – α *(z – z0))/T0]g/α*R Donde P0 es una presión conocida a una altura z0 a una temperatura T0 y α es un gradiente de temperatura. Ecuación de valores para la Troposfera donde existe variación 33de temperatura. Problema 4 Suponiendo que prevalecen las condiciones isotérmicas en la atmósfera, calcúlese la presión y densidad de una elevación de 2.000 [m] si P= 105 [Pa] abs y ρ = 1,24 [Kg/m3] al nivel del mar. Datos P= x ; ρ = x ; z = 2.000 [m] ; Po = 105 [Pa] abs ; ρo = 1,24 [Kg/m3] ; zo= 0 [m] Se tiene P= P0 * exp [ - (z – zo) / (Po/ g*ρo) ] ; P / ρ = P0 / ρ0 [ - (z – zo) / (Po/ g*ρo) ] = [ - (2.000 [m] - 0 [m]) / (105 [Pa]/ 9,8 [m/s2] * 1,24 [Kg/m3] ) ] = [ - 0,24304 ] exp (- 0,24304) = 0,78424 34 P= P0 * 0,78424 = 105 [Pa] * 0,78424 P = 78424,0 [Pa] P = 78,42 [KPa] ρ = P* ρ0 / Po = 78424,0 [Pa] * 1,24 [Kg/m 3] / 105 [Pa] ρ = 0,972 [Kg/m3] 35 Manometría Es la medición de presiones (o diferencia de presiones) por medio de los desplazamientos de las columnas fluidas. Los manómetros son tubos adaptados a depósitos, tuberías o canales con el propósito de medir presiones (fluidos en reposo o en movimiento). Tubos piezómetros Los piezómetros son dispositivos elementales para medir la presión. Consiste en un simple tubo el cual se conecta por un extremo inferior al recipiente que contiene el líquido cuya presión se desea conocer. 36 El liquido en el recipiente llena parcialmente el tubo hasta alcanzar cierto nivel B. La presión absoluta en A se reduce a la suma de columnas de presión sobre el plano horizontal que pasa por el punto A: PA = Po + γ * h En esta expresión γ es el peso específico del líquido y Po la presión atmosférica. La presión relativa es entonces: PRA = γ* h → h= PRA / γ 37 Para el caso en que la presión del líquido en el recipiente es menor que la atmosférica, el tubo piezómetro deberá disponerse en la siguiente forma: La presión en A se calcula así: Pc =Patm Pc’=PA’ + γ*h’ Como c y c’ pertenecen al mismo plano se debe satisfacer que Pc = Pc’ resultando entonces PA’ = Patm + γ*h’ Una vez determinada la presión en A’ se puede deducir la presión en otro punto del recipiente. Este dispositivo solo es aplicable para medición de bajas presiones, de lo contrario seria necesario disponer de tubos demasiado largos. 38 Manómetros Para medir presiones altas se emplean manómetros con líquidos de peso específico elevado a fin de evitar que la columna manométrica alcance una exagerada altura. Manómetros abiertos Presiones mayores que la atmosférica Sea el recipiente o tubo mostrado en la figura, lleno con un líquido sometido a presión, al cual se ha conectado un manómetro de mercurio. La columna de mercurio ocupa la zona BCD del tubo y actúa sobre su extremo D de la presión atmosférica. 39 La presión en A, objeto de la medición, se obtiene estableciendo la presión en B y C. PB= PA + γ* h1 Pc= Patm + γ Hg* h Como PB = Pc (están en el mismo plano horizontal) PA + γ* h1= Patm + γ Hg* h PA = Patm + γ Hg* h - γ* h1 Siendo γ el peso especifico del líquido del recipiente que llena parcialmente el tubo manométrico entre A y B. 40 Presiones menores que la atmosférica Pc =γ * h1 + PA + γ Hg* h PD= Patm Pc= PD PA = Patm - γ Hg* h - γ * h1 41 Manómetros diferenciales Están destinados, como lo indica su nombre, a determinar diferencias de presión. Para establecer la diferencia de presiones que hay entre A y E, se procede en forma similar a la seguida en los casos anteriores. Un procedimiento simplificado sigue los siguientes pasos: •Comenzando con un extremo, anotar la presión en ese punto empleando unidades adecuadas. •Utilizando las mismas unidades, se suma a este valor el cambio de presión que se entrega de un menisco al siguiente (positivo si el segundo menisco se encuentra a menor elevación, negativo si se trata de una elevación mayor). •Proceder de esta manera hasta alcanzar el otro extremo del manómetro e igualar la expresión obtenida a la presión en éste ultimo punto, se conozca o no. •Despejar la presión o la diferencia de presiones desconocida de la 42 ecuación así obtenida. Para el caso del manómetro de la figura se tendrá que: PA+ γ1*h1 + γm*h2-γ2*h3 = PE La diferencia de presiones en columna de agua resulta PA - PE / γH20 = ( γ2*h3 - γ1*h1 - γm*h2 ) / γH20 = S2* h2 – S1* h1 – Sm* h2 Siendo S1 Gravedad especifica del líquido en el recipiente A. S2 Gravedad especifica del líquido en el recipiente E. Sm Gravedad especifica del líquido manométrico. 43 Manómetro diferencial compuesto Cuando la diferencia de presión es apreciable se puede usar un manómetro con diferentes líquidos, como se muestra en la figura. Para calcular de presión PA - PB se puede mostrar que PA + γ1*H1 - γM1*h2 + γM2*h3 - γM3*h4 – γ2*h5 = PB PA – PB = γM1*h2 + γM3*h4 + γ2*h5 - γ1*H1 - γM2*h3 PA –PE / γH20 = Sm1* h1 + Sm3*h4 + S2*h5 - S1*h1 – Sm2*h3 44 EJERCICIOS 45 1.- Una cantidad de gas ocupa un volumen de 80 cm3 a una presión de 750 mm Hg. ¿Qué volumen ocupará a una presión de 1,2 atm.si la temperatura no cambia? 2.- El volumen inicial de una cierta cantidad de gas es de 200 cm3 a la temperatura de 20ºC. Calcula el volumen a 90ºC si la presión permanece constante. 3.- Una cierta cantidad de gas se encuentra a la presión de 790 mm Hg cuando la temperatura es de 25ºC. Calcula la presión que alcanzará si la temperatura sube hasta los 200ºC. 46 4.-Se tiene una masa de oxigeno, que ocupa un volumen de 200 [L] a la temperatura de 97 ºC y presion de 100,8 [KPa], se requiere saber a que Tº ocupara un volumen de 150 litros si la presion es de 103, [KPa] 5.- Las sales de nitatrato (NO3-) al calentarse producen nitritos (NO2-) y oxígeno (O2), una muestra de nitrato de potasio se calienta de manera que el gas O2 producido se recolecta en un matraz de 750 mL. La presión de este gas en el matraz es de 2,8 atmósferas y la temperatura medida es de 53,6 °C. ¿Cuántas moles de O2 se han producido? 47 5.- Cual es la presión a 1 m a 10 m de profundidad desde la superficie del mar ? Suponga que la ρ = 1,03 * 10^3 Kg/m3 como densidad y que la presión atmosférica en la superficie es de 10^5 Pa. Suponga además que a este nivel de presión la densidad no varia con la profundidad. 6.- Un experimentador desea determinar la densidad de una muestra de aceite que ha extraído de una planta. A un tubo de vidrio en Y abierto en ambos extremos llena un poco de agua con colorante (para la visibilidad). Después vierte sobre el agua una pequeña cantidad de la muestra de aceite en un lado del tubo y mide las alturas h1 y h2. Según como se muestra en la figura. ¿Cual es la densidad del aceite en términos de la densidad del agua y de h1 y de h2? 48
Anuncio
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados