Descubrimiento del Electrón = 1,759· 1011 C kg 1,602 · 10
Anuncio

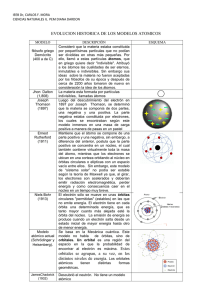
www.clasesalacarta.com 1 Tema 2: Estructura Atómica de la Materia Descubrimiento del Electrón Crookes (1.875).- rayos catódicos Viajan en línea recta Tienen carga eléctrica negativa Poseen masa Stoney (1.891).- electrones Thomson (1.897).- relación carga masa del electrón no depende del gas q electrón 11 C = 1,759· 10 m electrón kg Robert Millikan (1.909).- m electrón = 1,602 · 10 1,759 · 10 -19 11 C -31 = 9,11 · 10 kg C kg Descubrimiento del Protón Goldstein (1.886).- Rayos canales o positivos Viajan en línea recta Tienen carga eléctrica positiva Poseen masa Relación carga masa sí depende del gas Rutherford.- protones m protón = 1,602 · 10 9,573 · 10 -19 7 C -27 = 1,673 · 10 kg C kg Modelos Atómicos Dalton (1.800) 1. Los elementos químicos están construidos por partículas (átomos) que son indivisibles e inalterables. 2. Los átomos de un mismo elemento, tienen las mismas propiedades y masa. 3. Los átomos de distintos elementos, tienen distintas propiedades y distinta masa. 4. Los compuestos químicos se originan por la unión de átomos de diferentes elementos en una relación constante Fracasó cuando se comprobó que el átomo era divisible y que tenía naturaleza eléctrica (rayos catódicos y rayos canales) Thomson (1.904) 1. El átomo es divisible y está formado por partículas negativas (electrones) y positivas (protones) 2. Su estructura es una esfera maciza de electricidad positiva, en cuya superficie tiene incrustados los electrones en nº suficiente para que el conjunto resulte neutro No explica la experiencia de dispersión de partículas á á 2 Química _ 2º Bachillerato Rutherford (1.911) 1. El átomo tiene un gran espacio vacío 2. La totalidad de la carga positiva está concentrada en una región muy pequeña comparada con todo el átomo: núcleo 3. Los electrones giran en torno al núcleo en órbitas circulares, contrarrestando la fuerza de atracción eléctrica: corteza No explica: La estabilidad del átomo: el electrón en su movimiento debe emitir y perder energía, con lo que acabaría cayéndose sobre el núcleo Los espectros discontinuos que emiten los átomos, caracterizados por rayas luminosas de frecuencias determinadas Números Atómico (Z) y Másico (A) Másico Número Atómico: Z = nº protones = nº electrones (neutro) 22 Ne Atómico Número Másico: A = nº proteones + nº neutrones 10 Un elemento químico es aquella sustancia pura formada por átomos que tienen igual Z Isótopos.- Átomos que tienen el mismo nº de protones y se diferencian en el nº de neutrones. Por tanto, presentan el mismo Z y diferente A. Tienen masa diferente, ya que tienen distinto número de neutrones. Para nombrarlos se indica su nombre seguido de su número másico; Na-23, H-1, C-14. M= A1 · %1 + A2 · %2 + A3 · %3 + … 100 Elementos Isóbaros.- Distintos elementos con igual A Mecánica Cuántica Los orbitales son regiones donde es probable encontrar un electrón (nube electrónica) Radiación Electromagnética (luz) Onda Electromagnética c : velocidad de la luz: 3 · 10 c= λ·f λ: longitud de onda: m f: frecuencia: s-1 ; Periodo T = 8 m s Frecuencia ciclos Hz; seg 1 f Amplitud t (seg) 1 1 Nº de ondas ν = λ Velocidad de una onda v = λ = λ·f T 2 www.clasesalacarta.com 3 Tema 2: Estructura Atómica de la Materia Partículas (Fotones: Planck) Formula la Teoría Cuántica. Introduce el concepto de cuanto: mínima energía que se puede emitir o absorber (por átomo, molécula) en forma de radiación electromagnética Es capaz de explicar las emisiones de sólidos a cualquier λ, pero no la energía fija o cuantizada E: energía de los fotones E = h · f ⇒ h: constante de Planck 6,63·10 -34 J · seg f: frecuencia Einstein Mediante el efecto fotoeléctrico los electrones son expulsados desde la superficie de algunos metales que han sido expuestos, como mínimo, a la frecuencia umbral (característica de cada metal). No explica el comportamiento ondulatorio de la luz Luz partículas fotones E = h · f E = E0 + EC máx → h · f = me · v 2 h · f0 + h: cte Planck f: frecuencia f0 : frecuencia umbral me : masa del electrón v: velocidad de los electrones extraídos 2 3 2 Radiación Incidente E=h·f E < E0 NO emite electrones 1 E = E0 SÍ emite electrones E > E0 SÍ emite electrones E = E0 + EC Modelo de Bohr (1.913): Postulados 1. El electrón gira alrededor del núcleo en determinadas órbitas circulares permitidas (órbitas estacionarias) sin emitir energía radiante La fuerza de atracción electrostática (Coulomb), núcleo-electrón (fe) actúa de fuerza centrípeta (fC) haciendo posible el movimiento de giro del electrón alrededor del núcleo fe = fc → 2. q · q' r2 m · v2 fc = r fe = K → K qe · qp r2 = m · v2 r Sólo están permitidas aquellas órbitas cuyos radios son proporcionales a los cuadrados de los números enteros donde el electrón puede girar sin emitir energía -31 me · v · r = n R = n2 · 0,529 Å b: energía de estabilización de la 1ª órbita de Bohr 1 Energía → E = -b · 2 -18 -19 b = 2,18·10 J 1,6·10 J = 1 eV n Radio → Órbitas h → 2π me = 9,11 · 10 kg v = velocidad lineal r = radio n = nº cuántico principal h = cte de Planck á á 4 Química _ 2º Bachillerato 3. La energía liberada al saltar un electrón de una órbita a otra de menor energía se emite en forma de fotón o cuanto de luz, cuya frecuencia viene determinada por la ecuación de Planck E2 - E1 = h · f E n2 El máximo nº de electrones que puede ocupar cada capa viene dado por la expresión: Nº máx e- = 2 n2 (Excitado) + n1 (Fundamental) E No explica: Los espectros de átomos polielectrónicos El desdoblamiento de algunas líneas espectrales: efecto Zeeman Modelo de Sommerfeld (1.916) Modificaciones al modelo de Bohr, aplicando la teoría de la relatividad (Einstein): 1. Los electrones se mueven alrededor del núcleo en órbitas elípticas 2. Velocidades Relativas Modelo Cuántico Actual Hipótesis de Broglie Las ondas se comportan como partículas y éstas tienen propiedades ondulatorias (nivel submicroscópico: bajo valor de la cte h) h h λ= = p m·v p: momento lineal o cantidad de movimiento kg · m · s-1 m: masa v: velocidad lineal La λ hace referencia a las propiedades ondulatorias de las ondas y la h, p, m y v, hacen referencia a su comportamiento como partículas Principio de Incertidumbre de Heisenberg Es imposible saber a la vez la velocidad y la posición exacta de una partícula h Δx · Δp ≥ 2π ∆x: incertidumbre en la posición → ∆p: incertidumbre en el movimiento ↑∆x: ↓∆p ↓∆x: ↑∆p En contra de Bohr: las órbitas estacionarias supone determinar con exactitud la posición (R) y la E C (momento) de un electrón www.clasesalacarta.com 5 Tema 2: Estructura Atómica de la Materia Modelo de Schrödinger Especifica los posibles estados de E que puede ocupar el e- del átomo de H, e identifica las respectivas funciones de onda 2 2 2 ℏ2 δ φ δ φ δ φ E·φ=+ + 2 · m δ x2 δ y2 δ z2 + V x, y, z · φ Función de Onda ().- describe el estado del electrón en función del espacio y del tiempo: es proporcional a la probabilidad de encontrar al electrón en cierta región del espacio. Los Orbitales son regiones del espacio donde es probable encontrar una nube de electrones No funciona con átomos polielectrónicos Modelo Atómico Mecano-Cuántico Cada orbital se caracteriza porque: 1. Tiene una energía característica 2. Describe una distribución espacial del electrón La diferencia con el modelo de Bohr es la descripción del comportamiento del electrón. La ecuación de Shrödinger no determina la posición o trayectoria del electrón, sino la mayor o menor probabilidad de que se encuentre en los diversos puntos alrededor del núcleo Números Cuánticos Bohr Modelo Mecanocuántico Órbitas Planas y Circulares n Orbitales n, l , m Número Nombre Valores n Principal 1, 2, 3, … l Secundario o Azimutal 0, …, (n-1) m Magnético -l, … , 0, … , +l s De Spin Capa n l Primera 1 0 1s Segunda 2 0 1 2s 2p Tercera 3 0 1 2 3s 3p 3d 4 0 1 2 3 4s 4p 4d 4f Cuarta -½, +½ Significado Nivel Energético K, L, M, N, … Subnivel Energético Tipo de Orbital s, p, d, f Orientación del Orbital Comportamiento de imán del electrón Orbital á á 6 Química _ 2º Bachillerato Distribución de los Electrones en los Orbitales Principio de Exclusión de Pauli Diagrama de Möeller 1s2 Dos electrones de un mismo átomo no pueden tener sus cuatro nº cuánticos iguales 2s2 2p6 Principio de Mínima Energía 3s2 3p6 3d10 4s2 4p6 4d10 4 f14 Los electrones se distribuyen ocupando los orbitales de menor a mayor energía 5s2 5p6 5d10 5 f14 Principio de Máxima Multiplicidad o Regla de Hund 6s2 6p6 6d10 6 f14 Los electrones ocupan los orbitales de la misma energía de forma que el nº de electrones desapareados resulte máximo 7s2 7p6 7d10 7 f14 Espectros Atómicos Si un haz de rayos luminosos atraviesa primero una rendija y después un prisma óptico, experimentará una descomposición en tantos rayos distintos como colores tenga la luz compleja original. Recogiendo en una pantalla, o en una placa fotográfica, todos los rayos de luz que salen del prisma, se obtendrán una serie de rayas o bandas. Estas imágenes reciben el nombre de rayas espectrales, y al conjunto de todas ellas se le denomina espectro Pantalla Rendija Prisma Vista de frente Luz El espectro es el análisis de las distintas radiaciones (o longitudes de onda) emitidas por un foco luminoso Clases de Espectros 1. De emisión, si son originados por cuerpos incandescentes. Se dividen en: a) Continuos, si poseen todos los colores de la luz blanca (rojo, naranja, amarillo, verde, azul, índigo y violeta); por ejemplo, el espectro emitido por el filamento incandescente de una bombilla. En general, los espectros continuos proceden de sólidos y líquidos incandescentes. b) Discontinuos, si solamente contienen algunos colores de los siete que componen el espectro visible. Estos pueden ser: i. De bandas, si la franja coloreada es suficientemente ancha. Proceden de gases y vapores en forma molecular ii. De rayas, si la franja coloreada se reduce a una línea. Proceden de gases y vapores en forma atómica. En realidad, los espectros de bandas están constituidos por una serie de rayas muy próximas entre si, pudiendo resolverse la banda si la dispersión es grande. 2. De absorción, son los obtenidos por absorción parcial de las radiaciones emitidas por un foco luminoso cuando la luz producida por él atraviesa una sustancia en estado gaseoso, ya que todo gas o vapor absorbe, a cualquier temperatura las mismas radiaciones que es capaz de emitir si estuviera incandescente (ley de Kirchhoff). Por ejemplo: si se utiliza vapor de sodio en una experiencia de absorción, se observarán dos rayas oscuras en la zona del espectro luminoso cuya posición coincide, precisamente, con la de la radiación amarilla que emite el vapor de sodio incandescente. Espectro Visible www.clasesalacarta.com 7 Tema 2: Estructura Atómica de la Materia f 1020 1018 1016 1014 1012 1010 108 106 Hz 10-12 10-10 10-8 10-6 10-4 10-2 1 102 m Rayos X UV Rayos 400 nm 500 nm V i s i b l e Infrarrojo -Ondas TV 600 nm Radio 700 nm Ecuación de Rydberg El espectro del átomo de hidrógeno fue el primero que se interpretó, al ser el más sencillo por tener un único electrón. Rydberg propuso una ecuación empírica que permitía calcular la colocación de sus líneas espectrales: 1 1 1 =-R · 2 - 2 λ n1 n2 Siendo n1 < n2 y R la constante de Rydberg = 1’097 · 10 7 m-1 Balmer, en 1885, descubrió que las líneas del espectro del hidrógeno estaban agrupadas en series. Cada una de estas series recibe el nombre del investigador que las estudió Series del espectro del átomo de hidrógeno Serie n1 n2 Zona del Espectro Lyman 1 2,3,4,… UV Balmer 2 3,4,5,… Visible Paschen 3 4,5,6,… Brackett 4 5,6,7,… Pfund 5 6,7,8,… Infrarrojos