tesis - Universidad de Colima
Anuncio

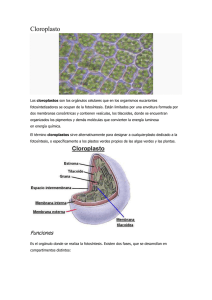
UNIVERSIDAD DE COLIMA FACULTAD DE MEDICINA CENTRO UNIVERSITARIO DE INVESTIGACIONES BIOMEDICAS “ OBTENCION Y CARACTERIZACION DE VESICULAS DE MEMBRANA TILACOIDEA DE CLOROPLASTOS DE AMARANTHUS HYBRIDUS”. I TESIS Para obtener el Título de: MAESTRO EN CIENCIAS con Especialidad en Fisiología Presenta Marcos Antonio Díaz Polanco Colima, Col., Enero 1 996. INTRODUCCION . . . . . . . . . . . . . . 1 ANTECEDENTES . . . . . , . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . , . . . . . . . . . . . . . . . . . . ll OBJETIVOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . , . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13 .. MATERIAL Y METODOS . . . . . . , , . . . . , . . . . . . . . . . . . . , . . . . . . . . . . , . . . . . . . , . . . . . . . . . . . . . . 14 RESULTADOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 DISCUSION .................................................................. 29 CONCLUSIONES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . , . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35 APENDICE . . . . . . . . . . . . . . . . . , , . . . . . . . . . . . . . . . . . . . . . . . . . . , . . . . . . . . . . . . . . . . . . , . . . , . . . . . . . , . , . . . . . . 3. 6 LITERATURA CITADA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40 1 Los cloroplastos son los organelos vegetales responsables de llevar a cabo la fotosíntesis, que es el proceso biológico mediante el cual la energía de la luz solar es absorbida y utilizada para la formación de compuestos orgánicos a partir de dióxido de carbono y agua. Los cloroplastos en plantas superiores son cuerpos discoidales o elipsoidales que miden entre 2 µ y 10 µ de diámetro y 1 µ de grosor (Gold, 1990). Una célula típica de hoja de espinaca contiene entre 20 y 60 cloroplastos (Butterfass, 1979), cada uno de los cuales tiene un volumen promedio de 34 µm3 y dimensiones de 5.5 x 2.1 (Menke, m 1962). Estar-r rodeados por dos membranas, cada una de aproximadamente 5 nm de grosor; una membrana externa y una membrana interna; estas membranas estan separadas por un espacio intermembrana de unos 10 nm (Alberts, 1990). Los estudios de permeabilidad han demostrado que la membrana interna regula el transporte de metabolitos, mientras que la membrana externa es altamente permeable a muchas sustancias de bajo peso molecular (Heldt & Sauer, 1971; Murakami et al., 1975; Douce & Joyard, 1979). Cuando son examinadas con microscvpía electrónica por criofractura, la membrana interna muestra mas partículas que la membrana externa (Sprey & Laetsch, 1976; Simpson, 1978b; Cline et al., 1985), en cvncvrdancia con el mayor numero de actividades enzimáticas y de transporte asociadas con aquella (Douce & Joyard, 1979; Keegstra, 1986). El estroma es el compartimento del cloroplasto comprendido entre la membrana interna y la membrana tilacvide. Incluye las enzimas asociadas con el ciclo de Calvin, particularmente ribulosa bifosfato carboxilaw’vxigenasa, que contribuyen a la masa de componentes protéicvs, aunque también otras 2 enzimas están presentes (Robinson & Walker, 198 I ; J. W. Anderson, 198 1). El estroma contiene multiples copias de DNA (aproximadamente 30 por cloroplasto en muchos tipos de células de plantas superiores), 70s ribosomas, mRNA’s y todos los otros elementos necesarios para la síntesis de proteínas (Ellis, 1976). Granos de almidón y plastoglobulinas son otros de los componentes estromales comunes (Coombs & Greenwood, 1976). Las membranas conteniendo clorofila, responsables de las reacciones dependientes de luz, son vesículas lamelares aplanadas (tifacsides) que suelen ocupar una gran parte del volumen de los cloroplastos de organismos eucarióticos. Las superficies exteriores de las membranas lamelares están a menudo acomodadas muy de cerca a las superficies exteriores de las otras lamelas dando lugar a un apilamiento de extensión variable llamado grana. Todos los tilacoides del estroma y de grana dentro de un cloroplasto forman un sistema de membrana continuo, el cual está organizado en una red altamente compleja que encierra una cámara anastomosada, normalmente referida como el lúmen ó espacio tilacoidal (ver dibujo 1). DIBUJO 1. El cloroplasto contiene tres membranas distintas (la membrana externa, la membrana interna y la membrana tilacoide) que define tres compartimentos internos separados: el espacio intermembrana, el estroma y el espacio tilacoide. La membrana tilacoide contiene todos los sistemas generadores de energía del cloroplasto. 3 La relación espacial precisa entre tilacoides de grana. y de estroma fue establecida por medio de reconstrucciones de cloroplastos seccionados en serie (Heslop-Harrison, 1963; Wehrmeyer, 1964 a, b; Paolillo, 1970; Thomson, 1974). Los modelos tridimensionales derivados de tales estudios describen pilas de tilacoides de grana siendo intersectados en angula por tilacoides de estroma paralelos, igualmente espaciados que giran hacia arriba y alrededor de las pilas. En cada intersección entre un tilacoide de estroma y uno de grana, se observa una región de membrana angosta parecida a un cuello que interconecta los dos tipos de tilacoide. Muchos de estos rasgos pueden ser verificados en micrografks de criofractura (Staehelin & Arntzen, 1986) Los tilacoides contienen todos los elementos funcionales que son necesarios para atrapar y transducir la energía de la Iuz en formas de energía química. Estos incluyen complejos captadores de luz, dos tipos de centros de reacción, diversos transportadores de electrones, un sistema para sintetizar ATP, y enzimas para extraer electrones del agua. Los estudios bioquímicos y estructurales han revelado que estos componentes están empaquetados en al menos cinco tipos principales de complejos proteínicos intramembrana discretos (Staehehn & Arntzen, 1986). Ver dibujo 2. 4 himen msmbrãnás filá.6õidss 2kt+ 21 I ‘+.----II-i w&s--.“...-w.“..e.-----“.---c’ Wman uOid Mb LHC mbvil PSR-LH \ I cyt flbr PSI-LH DIBIJJO 2. Organización de los componentes de la membrana del cloroplasto que participan en las reacciones de acoplamiento electrónico del transporte de electrones fotosintético. Flechas de&~:das, sólidas reacciones de transferencia de electrones; flechas ubiertLis transiciones químicas; flecha ~WZSUS movimientos de protones; flechadiscontinuas rutas de reciclamiento para PQ. Participan tres complejos de proteína estructuralmente distintos en la ruta de transporte de electrones lineal de agua a NADP: un complejo PS II, el cual esta unido a un complejo de citocromos f/bg por un grupo de moléculas de plastoquinona solubles en lípidos, y un complejo PS 1 que recibe los electrones del complejo de citocromos vía plastocianina, una proteína soluble en agua. También se indica un ciclo de transporte de electrones por quinonas, o ciclo Q, el cual causa la translocacion de un protón adicional por cada dos electrones que pasan a través de la cadena de transporte electrónico lineal. Los protones depositados dentro del lumen del tilacoide salen a través del complejo CFo-CFl ATP sintetasa translocador de protones. Los complejos de pigmento-proteína que recolectan luz (LHC) sirven a ambos fotosistemas; estos se asocian preferencialmente ya sea con PS I ó PS II y son designados LHC i ó LHC 1I respectivamente. Una población de LHC II es móvil y puede servir ya sea a PS I ó PS II viajando lateralmente entre las lamelas estromales (enriquecidas con centros PS 1) y pilas de grana (enriquecidas con PS II). (Staehelin & Arntzen, 1983). El primer evento en la fotosíntesis es la captación de luz por alguno de los pigmentos que forman el complejo captador de luz. La excitación 5 electrónica inducida por la luz es transmitida al centro de reacción, probablemente constituido por un dímero de clorofila, resultando en una oxidación al ser transferido un electrón a la quinona. El hueco que se genera es llenado por el elesMm resultante de la oxidacibn del agua. (Staehelin & Arntzen, 1986) Ver dibujo 3. MOLECULAS RE LUZ N ELECTRDN D E “PAR ESPECIAL” D MOLECULAS OE CLOROFILA DEL CENTRO DE REACCION TRANSPQRT&NDQ Ubi ELECTROH DE “ALTA ENERCIA” COMPLEJO PROTEINA-PIGMENTO DEL CENTRO DE REACCION DIBUJO 3. El noventa y cinco por ciento o más del total de pigmento del complejo captador de luz funciona para cosechar la energía de la luz y transferirla al resto del pigmento que está localizado en un componente del centro de reacción fotoquímico donde ocurre el evento fotoquímico primario. La combinación del complejo captador de luz con aquellos pigmentos del centro de reacción a los cuales alimentan con energía, es un fotosistema. Vistos como una enzima, los sustratos de un centro de reacción serían un donador débil de electrones (molécula A: como el agua) y un aceptor débil de electrones (molécula 8: como la quinona), y sus productos serían un aceptor fuerte de electrones (molécula A oxidada) y un donador fuerte de electrones (molécula B reducida: como la hidroquinona). 6 La transferencia de energía dentro de un fotosistema ocurre con una eficiencia muy alta como resultado de que las moléculas de pigmento estan apropiadamente orientadas y espaciadas entre 10 A a 70 A unas de otras, Esta organizacion es lograda por la asociación no covalente (en general) de las moléculas de pigmento con una variedad de proteínas específicas, Estos complejos de proteína - pigmento están embebidos en la membrana fotosintética o, por lo menos, están fuertemente asociados con la superficie de membrana. Los complejos productores d.e oxígeno, citocromo bg/f y ATPasa, procesan los electrones y hoyos formados durante el evento primario en el fdosistema para producir ATP y NADPH requerido para la fijación de dióxido de carbono y otros procesos metabólicos (Staehelin & Arntzen, 1986). El centro de reacción excitado dona un electrón a una molécula aceptora cuya identidad química depende del fotosistema (para el PSII es la plastoquinona y para el PSI es la ferredoxina). Aunque las reacciones fotoquímicas en los dos centros de reac;cion del fotosistema son diferentes, ambos fotosistemas causan transformaciones de la energía almacenada en los electrones y núcleos reordenados de la clorofila “a” excitada por luz, convírtíendo la energía de excitación en una molécula aceptora de electrones reducida y una clorofila oxidada. La donación de los electrones de la clorofila en el fdosistema II a la plastoquinona genera una asimetría de cargas a través del dieléctrico de la membrana. Esta asimetría es conservada al oxidarse el agua para reducir a la clorofila y producir iones hidrogeno, así la asimetría de carga es convertida a un potencial electroquímico transmembrana de iones hidrógeno. En una manera todavía no comprendida, esta diferencia de potencial de ión hidrogeno es utilizada para llevar a cabo la reacciõn de transferencia del grupo fosforil en la síntesis de ATP (Staehelin & Arntzen, 1986). La formación de gradientes de potencial electroquímico a través de las membranas implica el transporte de partículas cargadas; en cloroplastos los protones son bombeados desde el estroma hacia el espacio tilacoideo, lo cual determina sus propiedades osmóticas y conduce a procesos de hinchamiento ó enjutamiento de cloroplastos y tilacoides (Hoppe et al., 1982). Las mediciones de dispersión de luz han sido un medio conveniente de medir la penetración unidireccional de sustancias a través de su cubierta cuando ocurren cambios osmóticos en la talla de los mismos. Los estudios de recaptura han demostrado efectivamente que la cubierta de cloroplastos intactos es impermeable a sorbito1 (Heldt & Sauer, 1971). Sin embargo, el término “impermeable” debe ser usado en un sentido restringido. Solamente significa que la tasa de penetración es muy baja para ser medida dentro del tiempo apropiado para experimentación con organelos frágiles tales como cloroplastos. En soluciones de sorbito1 mayores a 0.1 M, el cloroplasto es un osmómetro casi perfecto. En 0.16 M de sorbitol, los cloroplastos aislados son esféricos (Heldt & Sauer, 1971); y un cloroplasto promedio, en estas condiciones, ocupa un volumen de 50 Pm3 (Heber & Heldt, 1981). Cuando se añaden gradualmente sales tales como KCl a cloroplastos intactos, la dispersión de la luz se incrementa gradualmente (Heber & Purczeld, 1977) indicando que los cloroplastos responden osmométricamente a la adición de sal. La recaptura está limitada por la permeabilidad de la cubierta del cloroplasto a K+ (Heber & Purczeld, 1977). Cuando se añade valinomicina, la cual incrementa específicamente la permeabilidad de la membrana al K+, se observa un rápido hinchamiento del cloroplasto en la presencia de aniones tales como cloruro, fluoruro, ioduro, bromuro, nitrato, nitrito. 8 Cuando se rompe la cubierta del cloroplasto, la penetración de aniones 6 ácidos a través de las membranas tilacoides dentro del espacio intratilacoidal puede ser medido por dispersión de luz en un modo similar como con cloroplastos intactos. Las tasas de hinchamiento de tilacoide inducidas por valinomicina se esperarían mucho mas rápidas que aquellas de hinchamiento de cloroplastos porque el área de la membrana tilacoide es mas grande por un factor de 25 que el &-ea superficial de cloroplastos intactos. Sin embargo, el hinchamiento de tifacoides bien preservados en la presencia de KCl, KBr o KI y valinomicina es mucho mas lenta que la de cloroplastos intactos (Heber & Heldt, 198 1), indicando que los coeficientes de permeabilidad de la cubierta para halogenuros son mucho mas altos que para membranas tilacoides. Las pocas mediciones de flujos pasivos de H+ indican que la permeabilidad de la cubierta es mayor que la de la membrana tilacoide (Gimmler et al, 1974). Todas las propiedades físicas y químicas tienen una base estructural. Así, una comprensión completa de las funciones de la membrana fotosintética requiere un conocimiento detallado de la organización estructural de tales membranas. Durante los últimos 25 años se ha hecho un progreso significativo en el analisis de las reacciones fotoquímicas catalizadas por la clorofila, en la identificación de las moléculas asociadas con estos procesos, y en la elucidación del arreglo tridimensional de estas moléculas en las membranas fotosintéticas. Uno de los métodos más adecuados para estudiar la organización supramolecular de las membranas tilacoides es la técnica de criofractura (grabado). La principal ventaja de esta técnica es que provee imágenes de réplicas de alta resolución de las superficies exoplásmica (SE) y protophísmica (SP). La exoplásmica es la superficie en contacto con el estroma y la 9 protoplásmica con el lúmen. También ofrece una imagen fiel de las caras de fractura. Las caras de fractura son producidas por división mecánica de las bicapas de membrana congeladas (ver dibujo 4). Este tipo de fractura ocurre porque las interacciones hidrofobicas que estabilizan a las membranas biológicas son sensibles a la temperatura; a temperaturas menores o iguales a 100 O C son reducidas a tal grado que las interfaces hidrofóbicas representan planos de debilidad. DIBUJO 4. Las dos caras de fractura de membrana complementarias son designadas CE ó Cara-E y CP 6 Cara-P. CE se refiere a la cara de fractura de la membrana exoplásmica, CP a la cara de fractura de la membrana protoplásmica. Las superfkies de membrana correspondientes son etiquetadas como SE y SP. Como los tilacoides del estroma y de los grana dan lugar a diferentes tipos de Caras-E y P, se han usado subíndices para designar si una cara de fractura dada ó área superficial corresponde a una región de membrana apilada (a) o no apilada (n) (ej. CPa, CEn, etc.). El examen cuidadoso de una rnicrografla típica de membrana tilacoide fracturada por congelamiento revela que cada tipo de cara de fractura (CEa, CEn, CPa, CPn) exhibe una poblacion distinta de partículas intramembrana, consistente con el hecho de que el apilamiento de membrana produce una diferenciación estructural y fwcional de las membranas tilacoides. Las imágenes, a juzgar por la densidad y distribución en tallas de ‘tas partkulas intramembrana, sugieren que cada tipo de complejo de proteína de membrana 10 funcional dá lugar a una partícula de una talla característica. Por esta razón, una de las principales metas a largo plazo de estudios de criofractura de membranas tilacoides ha sido la identificación positiva de diferentes categorías de partículas intramembrana y el desarrollo de mapas supramoleculares de la distribución de estos complejos funcionales en el plano de la membrana, Ademas de proveer información sobre la distribucion espacial de los componentes de la cadena de transporte electrónico, tales mapas podrían proporcionar información directa sobre el número exacto de complejos específicos en un ásea de membrana dada y sobre el espaciamiento entre estos y otras unidades funcionales. Una vez que ha sido establecida una correlacion entre un tipo específico de partícula y una unidad funcional específica, puede ser posible estudiar cómo las perturbaciones en la organización de la membrana afectan su función, y viceversa. I ANTECEDENTES Y JUSTIFICACION. I El estudio del sistema fotosintético de las plantas se ha enfocado principalmente a los aspectos químicos del proceso. Las corrientes acarreadas por iones o por la separación de cargas durante la excitación electrónica inducida por luz a través de las membranas cloroplásticas ha sido poco estudiada. Los estudios de permeabilidad indican la presencia de selectividad en las membranas. Además la expresión final de la absorción de luz es un gradiente electroquímico a través de la membrana tilacoidea. Por lo anterior resulta interesante estudiar las propiedades electrofisiológicas de la membrana fotosintética tratando de establecer su correlación con el estímulo luminoso que inicia el proceso fotosintético. Muñiz et al. (1995) reportan el registro, en la membrana tilacoidea, de corrientes iónicas inducidas por estímulos luminosos en el rango de 9 a 18 pA. Esta corriente corresponde a la entrada de II+ desde el estroma hacia el espacio tilacoideo. Los pulsos de luz largos (mayores a 8 mseg.) inducen una respuesta con un curso temporal complejo; una fase inicial de gran amplitud seguida de una fase de decaimiento y una inversión de la dirección de la corriente al terminar el pulso de luz. La amplitud del componente inicial en una respuesta está determinada por la duración del estímulo luminoso previo y el tiempo transcurrido entre los estímulos. Una de las preguntas que surgieron de las observaciones hechas en este estudio y que fué uno de los objetivos del presente trabajo fué el de conocer el área superficial de esta membrana para calcular la densidad de corriente y compararla con los resultados de otros autores sobre la actividad de los fotosistemas 1 y II y su densidad superficial. Además, esta caracterización de la 12 membrana tilacoidea facilitará en estudios posteriores el registro de canales iánicos y fotocorrientes mediante el uso de La técnica de “patch clamp” para entender mejor como se lleva a cabo el proceso fotosintéticoZ Este trabajo pues, está orientado a desarrollar la técnica para obtener vesículas de membrana tilacoide utilizables para estudios electrofisiológicos. 13 I OBJETIVO. 1 1. Determinar las condiciones osmóticas y los valores de pH en los cuales se provoque la formación del mayor número de esferas de tilacoide con los mayores diámetros a partir de cloroplastos aislados de hojas frescas de Amuranthus hybridus. 14 MATERIAL Y METODOS. Se utilizaron hojas de Amarunthus hybridus; estas plantas fueron cultivadas en palanganas utilizando tierra acondicionada con “Happy flower” cuya fórmula consiste en: 1). abono natural (tabaco); 2). fertilizante nitrogenado (26.5 % de nitrogeno); 3). vermiculita como acondicionador que provoca la porosidad de la tierra permitiendo la oxigenación de las raíses y que aumenta la capacidad retentiva del agua que se aplica, evitando riegos fkesuentes que producen marchitamiento pudrision y lixiviasion. Se midio la osmolaridad de las soluciones extraídas de hojas frescas sin nervaduras. Para esto, las hojas se cosecharon a las 8:30, 12:OO y 20:00 horas, Algunas hojas fueron envueltas, en la misma planta, con papel aluminio a las 8:30 para impedir su iluminación; estas hojas se cosecharon a las 12:OO hrs. y sus osmolaridades se compararon con las hojas iluminadas. En las tablas 1, 2 y 3 se presenta la composición químka de las ocho soluciones utilizadas para aislar cloroplastos de hojas de Amarmthus hybridzo, en donde: mOsm = miliosmolar y mM = milimolar. La osmolaridad de las soluciones aisladoras (S.A.) fué verificada en un osmómetro de presión de vapor 5500 “Wescor” presentando una variación de f 10 %. Se utilizó Trizma para ajustar el pH de las ocho soluciones a tres valores: 5.0, 7.2 y 8.0 (24 soluciones diferentes). 1. Las hojas, con edades comprendidas entre los 10 y 30 días de nacida, fueron colectadas entre 8:30 y 9:00 A.M. y se conservaron a 4 “C para reducir Ia presencia de almidones. Las nervaduras fueron separadas y el resto de la hoja, inmersa en la solución aisladora, se corto en pequeños fragmentos con una navaja delgada de acero inoxidable; con este procedimiento rompemos Zas células y los cloroplastos son liberados a la solución aisladora. Se colocó una alícuota de la preparacion en la cámara experimental de teflón can fondo de cristal. Las observaciones se iniciaron 30 minutos después con el propósito de permitir el depósito de los cloroplastos en el fondo de la cámara y la manifestación del choque osmótico. El choque osmótico permitió el aumento en talla de los cloroplastos hasta la ruptura de la envoltura externa y el hinchamiento de la membrana tilacoide para dar lugar a la formación de vesículas de tilacoide (blebs), El orígen tilacoide del bleb se estableció realizando observaciones directas del hinchamiento de un cloroplasto en solución hipotónica hasta su ruptura y el surgimiento del tilacoide hinchado para formar vesículas de membrana esférica fblebs). Cabe señalar que es muy dificil separar fisicamente la membrana interna de la membrana externa del cloroplasto (Douce & Joyard, 1979); esto se debe a la presencia de partículas vinculadoras, “linkers”, entre las dos membranas. Esta información apoya la idea que los blebs observados al microscopio se trataban realmente de membranas tilacoideas hinchadas y no de la membrana interna del cloroplasto. Las observaciones se realizaron en un microscopio Nikon DIAPHOTTMD. Se midieron los diámetros de 100 cloroplastos y 100 blebs para cada una de las 24 soluciones con un escalímetro (LEITZ WTZLAR) incluído en uno de los oculares del microscopio; el rango de incertidumbre de éste fué de f 1.2 micras. Las mediciones se realizaron en los tres diferentes valores de pH de cada una de las soluciones aisladoras, La búsqueda de 100 eventos tanto para cloroplastos como para blebs se realizó en una misma preparación “barriendo”, de ser necesario, todo el campo visual en el microscopio. Las observaciones se sometieron a tres tipos de análisis estadístico realizados en la hoja de cálculo de EXCEL 4.0: a). Análisis de Varianza (ANOVA) de un factor. b). Análisis de Varianza de Dos Factores sin Replicación. c). Prueba t de Student: Dos Muestras Pareadas para Promedios. - Los detalles del método analítico se describen en el apéndice. - Todas las comparaciones estadísticas se realizaron con una prueba unidireccional ó de una cola (excepto “ANOVA: Dos Factores sin Replicación”: prueba bidireccional ó de dos colas) con un nivel de confianza de 99 %. 17 Osmoiaridad en Hojas de Amaran~hs hybridm En la tabla 4 se muestran las osmolaridades encontradas en las soluciones extraídas de una cantidad de hojas similares (10 hojas) de Amarmthus hybriu’zrs en tres horas diferentes del dia; “n” indica el número de mediciones y es el valor que se encuentra a la derecha del valor de osmolaridad promedio. Esto se realiz(, con el fin de verif’icar el rango de variación funcional de la osmolaridad de la solucir)n donde se encuentran inmersos los cloroplastos y apoyar la idea de utilizar una solución aisladora “normal” 250 mOsm. La tabla 5 muestra las osmolaridades encontradas a las 12 del día en hojas de Amaronthus hybridus en presencia y ausencia de luz. Las hojas sin luz se cubrieron ea la misma planta con papel aluminio a las 8:30 y fueron cosechadas a las 12:00 hrs. 4. DIFERENTES PROMEDIO 12:oo 486 n=5 1.8 358 ll=5 0.7 P.M. 8:00 P.M. 5. KmA DEL DIA 8:30 A.M. CON LUZ 1290 P.M. SlN OSMOLARIDAD PROMEDIO (mOsm) ERROR ESTANDAR 399 n=5 1.0 380 ll=5 0.6 602 n=4 2.2 DIFERENTES ENTRE SI * LUZ 12:oo P.M. CON ls.Jz * Los espacios en blanco relacionan las concentraciones promedio que son signiíkativamente diferentes entre sí. Diámetros Promedio Controhndo pH y Concentración. En las tablas 6, 7 y 8 se muestran los promedios de los tamaños de cloroplastos y blebs obtenidos en cada solución. “DS” significa desviación stándard y es el valor que se encuentra en letra más oscura a la derecha del diámetro promedio. 19 6. pH =5.0 I CLOROPLASTOS: D~R/~I%TR(-~S CONCENTRA PROMEDIO CION (mOsm) (micras) Y 1000 500 250 120 60 30 10 5 “DS” 7.2 1.3 9.1 1.2 9.3 1.1 9.8 1.1 9.8 1.0 8.9 1.3 9.0 1.3 8.4 1.5 EvENTOS OBSERVA DOS 100 100 100 100 100 100 100 100 1 BLEBS: DiAMETROS PROMEDIO (micras) Y “DS” 12.0 1.5 10.5 2.1 12.2 1.5 12.2 1.5 12.7 1.4 12.4 1.6 12.5 1.7 11.9 1.9 I EVEN-TOS OBSERVA DOS 66 27 i 100 100 ---EE-i 7. PI-I =7.2 CONCENTRA CION (mOsm) 1000 500 250 120 60 30 10 5 BLEBS: CLOROPLASTOS: DIAMETROS EVENTOS DIAMETROS EVENTOS PROMEDIO OBSERVA PROMEDIO OBSERVA (micras) Y DOS (micras) Y DOS “DS” “DS” 7.8 1,7 100 12.3 3.1 34 8.0 1.2 100 12.5 2.5 60 8.1 1.0 100 13.7 2.1 58 12.0 1.4 100 15.3 2.0 100 12.8 1.9 100 17.1 3.0 100 8.0 1.5 3 18.4 1.8 100 ll.2 1.1 3 18.5 2.1 100 6.2 1.3 6 12.7 2.2 17 I 8. I DIAMETROS EVENTOS DIAMETROS EVENTOS BROMEBIO O B S E R V A P R O M E D I O O B S E R V A (micras) Y DOS (mieras) Y DOS ?IgJS” VS” 100 9.6 ll.5 5 5.0 0.8 1000 SO0 250 120 60 30 10 5 BLEBS: CLOROPLASTOS: --._-- - ~. .- ~-. CONCENTRA CION (mOsm) I SS 0.8 6.5 0.7 10.4 1.3 6.9 1.1 13.2 1.0 10.4 3.0 0 ,, 0 100 100 100 62 3 3 0 11.2 11.9 13.1 13.0 9.9 10.5 10.2 2.0 í.7 1.5 2.0 1.4 í.8 2.0 36 100 100 100 100 100 46 Comparación Estadística del pH y la Concentración. Se utilizó la herramienta estadística “ANOVA” (análisis de varianza) para indagar si los diámetros promedio (variable dependiente) de los blebs observados eran significativamente diferentes entre cada concentración y entre cada valor de pH (variables independientes), donde: SC = suma de cuadrados de los diáunetros individuales de los blebs; gl = grados de libertad; CM = cuadrado medio (SC/gl); F = valor de F calculado; P-valor = probabilidad de rechazar erróneamente la hipí>tesis nula: “la media es igual en todas las soluciones” cuando en realidad es verdadera; F crit. = valor de F esperado de tablas (gl de variable independiente VS. gl del error). Ver tabla 9. 21 9. FCENEDE VAR/AC/UN Anova: Dos Factores Sid Repheión SC Hileras (pH) Il 478.2 Columnas 41688.65 [cãncentracih) Error 39786.73 TC&?!1 92953.58 T 299 t38.38864t2.019453t8.17E-19t 1.217348 t 7 15955.521 j 313.293 / 0 12.647838 / 2093 19.00943 2399 Conclusión: como el valor de F calculado es mayor que el valor de F esperado de tablas tanto para hileras como para columnas entonces se rechaza la hipotesis nula: “Todas las medias son iguales” y se acepta la hipótesis alterna: “No todas las medias son iguales”. Para determinar de una manera mas específica si Ios dirúnetros promedio de los blebs eran significativamente diferentes entre las distintas soluciones para cada valor de pH, se realizaron las siguientes pruebas estadísticas: (ver tablas 10, ll, 12). 10. pH = 5.0 Factor 7 Entre Grupos bntra del 1782.562 1 668 t1 IL45628 L.-- 2.668506 6.16685 22 ll. 1pH = 7.2 Anova: Un Factor Fuenfed~ V~H~Cc/an SC Entre 3037.309 Grupus Dentro de 3105.106 Grupos TChl 6192.415 g/ 7 GW F /%fLiYiur FCfl/ 441 ll442 79.68353 5.31 E-80 2.671214 561 5.534948 568,.. .~ i 12. ] pH = 8.0 Anova: Un Factor Fr/e/e de SC g/ CM F Fc,? j Conclusión: para los tres casos el valor de F caIcuIado es mayor que el valor de F esperado de tablas, por lo tanto se rechaza la hipótesis nula: “Todas las medias son iguales” y se acepta la hipótesis alterna: “No todas Ias medias son iguales”. 23 Diferencias en Talla entre CloropIastos y BIebs. En las tablas 13, 14 y 15 se muestran las diferencias en diámetro que para los distintos valores de pH existen entre cloroplastos en solución aisladora normal (250 mOsm), y blebs en el rango de soluciones aisladoras en que alcanzaron los diámetros mátximos (véanse tablas 6,7 y 8) 13. pH = 5.0 CLOROPLASTOS BLEBS OSMOLARID.4D (mOsm) 250 250 a 10 DIAMETROS PROMEDIO AIJMENTO (micras) (%)” 9.3 35 12.4 4. pH = 7.2 CLOROPLASTOS BLEBS DIAMETROS OSMOLARIDAD PROMEDIO AUMENTO (mOsm) (micras) (%)* 250 8.1 30 a 10 18.5 130 15. pH = 8.0 CLOROPLASTOS BL.E.BS DIAMETROS OSMOLARIDAD PROMEDIO AUMENTÓ (mOsm) (micras) % * 6.5 250 120 a 60 * Los valores indican la talla de blebs respecto al de cloroplastos expresado en porcentaje. 24 Comprobación Estadística de Diferencias en Taila de los Cloroplastos y Ios BIebs en las Condiciones de pH y Osmolaridad Utilizadas. - En Ia tabla 16 se muestran las diferencias en dihmetro de cloroplastos a diferentes osmdaridades, para cada valor de pH. 16. 25 - En la tabla 17 se muestran las diferencias en diámetro de blebs a diferentes osmolaridades, para cada valor de pH. 17. * Sólo se incluyen las osmolaridades en las que se pudieron obtener un total de 100 eventos (cloroplastos y blebs) para efectos de aplicación de la prueba estadística correspondiente. ** Los números iguales relacionan los promedios de diámetro que no son signifícativamente diferentes entre sí. Los diámetros promedio sin número son significativamente diferentes con los demás. 26 - En las tablas 18 y 19 se muestran las diferencias en diámetro de los cloroplastas y los blebs para los distintos valores de pH, en la asmalaridad normal y aquellas en las que alcanzaron sus dihrnetros máximos respectivamente. 18. PH 5.0 7.2 8.0 CLOROPLASTOS OSMOLARIDAD DL4METROS DIFERENTES PROMEDIO ENTRE Sl (mOsm) * ** (micras) 250 9.3 250 8.1 250 6.5 k 19. * La osmolaridad para cloroplastos corresponde a la solución aisladora normal; la osmolaridad para biebs corresponde a aquellas donde se alcanzaron los diámetros máximos. ** Los espacios en blanco relacionan los promedios de diámetro que son significativamente diferentes entre sí. 27 - En las tablas 20, 21 y 22 se muestran las diferencias en diámetro entre cloroplastos en solución aisladora normal y blebs en soluciones aisladoras donde alcanzaron los diámetros máximos, a un pH dado. 20. pH = 50 CLOROPLASTOS BLEBS OSMOLARIDAD DIAMETROS DIFERENTES (mOsm) PROMEDIO ENTRE SI * (mic ras) 250 9.2 250 a 10 12.4 21. pH = 7.2 CLOROPLASTOS BLEBS OSMOLARIDAD DJAMETROS DIFERENTES (mOsm) PROMEDIO ENTRE SI * (micras) 250 8.0 30a 10 18.5 22. OSMOLARIDAD DIAMETROS DIFERENTES pH = 8.0 ENTRE SI * (mOsm) PROMEDIO (micras) CLOROPLASTOS 250 6.5 120 a 60 13.1 1 BLEBS I I I 1 28 - En las tablas 23,24 y 25 se muestran las diferencias en diámetro entre cloroplastos y blebs en solución aisladora normal, a un pH dado. 23. pH = 5.0 CLOROPLASTOS BLEBS 1OSMOLARJDAD (mOsm) 250 250 1 DIAMETROS 1 DIFERENTES 1 PROMEDIO ENTRE SI * (micras) 9.3 12.2 24. pH = 8.0 CLOROPLASTOS BLEBS OSMOLARIDAD DIAMETROS DIFERENTES (mOsm) PROMEDIO ENTBE SI * (micras) 250 6.5 250 ll.9 * Los espacios en blanco relacionan los diámetros promedio que son significativamente diferentes entre sí. ** Para el pH de 7.2 se utilizó Ia concentración de 120 mOsm debido a la falta de observaciones de blebs en la concentración de 250 mOsm. 29 Se utilizó el osmómetro para hacer el analisis de la osmolaridad de las hojas LI diferentes horas del día, observándose un rango de variación que oscila entre los 300 y 600 mOsm; estas concentraciones al parecer son menores durante la noche y en las primeras horas del día, y aumentan a las 1200 del día. En estos cambios de la osmolaridad podría estar involucrado el movimiento estomático de las hojas el cual se ve afectado por tres factores principalmente: el agua, el dióxido de carbono y la luz. Agua: las plantas pueden detectar una reducción de agua y operar un mecanismo o movimiento específico que cierre los estomas. Uno de tales mecanismos de control hidroactivo está bajo la influencia de la hormona ácido abscísico (ABA), cuya secuencia de control es la siguiente: cuando existe agua en abundancia no se forma ABA y los estomas están abiertos; cuando se produce una ligera reducción del agua, se forma una pequeña cantidad de ABA y los estomas se cierran ligeramente. Al mismo tiempo la acción del ABA hace a los estomas mucho más sensibles a las necesidades del 602, así que la fotosíntesis no es obstaculizada. Al producirse un severo deficit de agua (si bien todavía inferior al potencial hídrico foliar crítico) se forman grandes cantidades de ABA y los estomas se cierran. El CO2 tiene un marcado efecto sobre los estomas. Las bajas concentraciones de CO2 promueven la apertura estomática, y las altas causan el cierre rápido a la luz o a la oscuridad. Sin embargo, la exposición a la luz bajo condiciones de alta concentración de CO2 pronto causará la apertura, porque el CO2 del interior de la hoja es consumido en la fotosíntesis. Por lo tanto existen mecanismos de control que evitan ía inhibición de la tasa fotosintética, mientras el agua no sea hrnitante, pero los cierran con el fin de impedir la innecesaria pérdida de agua cuando la fotosíntesis no puede operar debido a la ausencia de luz. Un fuerte factor de control es la luz. Los estomas normalmente se abren a la luz y se cierran en la oscuridad. El efecto luminoso sobre los estomas podría ser una consecuencia de la fotosíntesis que ocurre en las células oclusivas (las cuales, a diferencia de otras células epidérmicas, poseen cloroplastos). Esto afecta la apertura estomatica de tres maneras. Primero, la fotosíntesis reduce la concentración de COzi que es un poderoso estímulo para la apertura de los estomas. Segundo, las sustancias osmóticamente activas como los azúcares son producidas en la fotosíntesis, lo cual coadyuva a abatir el potencial hídrico de las células oclusivas. Tercero, la fotofosforilación podría suministrar el ATP necesario para conducir los bombeos transportadores de iones que movilizan el K+ u otras sustancias al interior de las células oclusivas. (Bidwell, 1979). Además, el incremento en la osmolaridad implica la presencia de partículas osmóticamente activas que podrían formarse por el proceso de la fotosíntesis. La disminución del CO2 durante la fotosíntesis es un estímulo para la apertura estomática en presenci.a de luz; por otra parte, en nuestras condiciones (la planta en suelos húmedos) la producción de ABA sería nula o bien se formaría una pequeña cantidad cerrando ligeramente los estomas pero haciéndolos mucho más sensibles a las necesidades del COZ. Por tal motivo, la respuesta estomática primaria dedido a la falta de agua, es decir el cierre de 31 estomas pasaría a un nivel de importancia mínimo, mientras que una respuesta estomática secundaria en base a la concentración del CO2 y presencia de luz pasaría a un primer nivel de importancia, manteniendo cierta apertura estomática que favorecería el incremento de osmolaridad como consecuencia de la fotosíntesis y que se observó en las hojas cosechadas al mediodía (1290 l-m.). La tabla 5 de resultados nos muestra que mientras la osmolaridad de las hojas aumenta conforme avanza el día, en presencia de luz, no ocurre en ausencia de luz. Las diferencias son estadísticamente significativas con luz y sin luz. Esto nos sugiere que estos incrementos de osmolaridad se deben a la actividad fotosintética de la hoja en presencia de luz más que a una transpiración excesiva. Como ya se mencionó anteriormente, las hojas utilizadas para la obtención de cloroplastos y medición de diametros fueron colectadas por la mañana (entre 8:30 y 900 A.M.). De acuerdo con esto y tomando en cuenta los valores de osmolaridad de las tablas 4 y 5 a esa misma hora se sugirió tomar el valor de 250 mOsm como “normal” para hacer las comparaciones correspondientes. Además de acuerdo con los resultados mostrados en la tabla 16, no existen diferencias estadísticas significativas en los diámetros de cloroplastos entre 2.50 y 500 mOsm a pH de 5.0 y 7.2. Las mediciones de la distribución de tallas de cloroplastos y blebs aislados de Amaranthus hybridus que se reportan en las tablas 6, 7 y 8 de resultados muestran que cambian con las condiciones de osmolaridad donde están inmersas. La aplicación de la prueba estadística “ANOVA: DOS FACTORES” en la tabla 9 de resultados permitió estimar los efectos directos de la osmolaridad y el pH, sobre una población de diámetros de blebs. Dentro de este analisis, las comparaciones hechas entre los distintos valores de pH resultaron en una “F” calculada mayor que la “F” crítica de tablas. De igual manera, las comparaciones hechas entre las distintas osmolaridades resultaron en una “F” calculada mayor que la “F” de tablas; por lo tanto, nuestra hipótesis nula: “La media es igual en cada uno de los niveles del factor” se rechaza, y se acepta la hipótesis altema:“No todas las medias son iguales”. Por otra parte, la diferencia que se observa entre la “F” calculada y la “F” de tablas para la osmolaridad es mayor que para el pH, lo cual nos indica que la osmolaridad tiene una mayor influencia sobre las tallas de los blebs que el pH. La prueba de “ANOVA: UN FACTOR” de las tablas íO, ll y 12 de resultados se aplicó para evaluar bajo qué condiciones de pH las diferencias entre las osmolaridades son significativamente mayores. De acuerdo con esto, se observó que la diferencia entre la “F” calculada y la “F” de tablas fué mayor a un pH de 7.2, siguiéndole en segundo lugar el pH de 8.0 y por último el pH de 5.0 (ver figura 1). 33 BLEBS: RELACION p H - C O N C E N T R A C I O N DIAMETRO (micras) FIGURA 1 Antes de probar que las observaciones de diámetros hechas en una muestra de cIoroplastos están de alguna manera correlacionadas con las observaciones hechas en una muestra de blebs (tablas 13, 14 y 15 de resultados), se utilizó la “PRUEBA t DE STUDENT: DOS MUESTRAS PAREADAS PARA PROMEDIOS” (tablas 16 - 25 de resultados) para evaluar las diferencias estadisticas entre: aj cada una de las ocho osmolaridades probadas, a un pH dado (tablas 16 y 17). bj cada uno de los valores de pH, a una osmolarídad dada (tablas 18 y 19). cj cloroplastos en solución aisladora normal y blebs en soluciones donde alcanzaron los diámetros máximos, a un pH dado (tablas 20, 21 y 22). - Para todos los casos las diferencias fueron significativas. 34 De acuerdo con esto y utilizando la misma prueba estadística, se encontró que el diámetro promedio de las observaciones hechas en cloropIastos a una osmolaridad de 250 mOsm es significativamente diferente del diámetro promedio máximo alcanzado por los blebs en cada uno de los valores de pki probadas. Por lo tanto el cambio en diáînetro de blebs respecto aJ de cloroplastos a un pH de 7.2 fue del 130 %; del 100 % a un pH de 8.0 y de un 35 % a un pH de 5.0 (ver @ura 2). REtACtON CtOROPtASfOS l 250 - B~EBS CONCENTRACION [mOsm) FIGUFtA 2 También se encontraron diferencias significativas entre los diarnetros promedio de los cloroplastos así como entre los diámetros promedio de blebs. Así mismo se wmprobo que existen diferencias significativas entre el diámetro promedio de cloroplastos y el de blebs a una misma osmolaridad (tablas 24, 25 y 26); esto confirma que en realidad estábamos observando dos eventos diferentes (cloroplastos y blebs). 1. De los dos factores involucrados en el hinchamiento de tilacoides para estos experimentos, la osmolaridad de la solución aisladora fué dominante sobre el pH. 2. Ei valor óptimo de pH para obtener los mayores diámetros de biebs fué de 7.2. 3. Las mejores osmoiaridades utilizadas a pH 7.2 para inducir la formación de blebs fwron: 30 y 10 mOsm. 4. Ei aumento en taiia de blebs respecto al de cloroplastos fué del 13G% a un pH de 7.2. ANO-VA UN FACTOR: Suma de Cuadrados Total: SCqQ=;E;r,(Y,-Y)Z SCE=C( Yij’Yj) ’ Suma de Cuadrados Dentro de Grupos: Suma de Cuadrados Entre Grupos: Grados de libertad: Total=n-- 1 Dentro de GrupOS = nT - C Entre grupos = c - 1 Cuadrado Medio Dentro de Grupos: CME = -%& nT - c Cuadrado Medio Entre Grupos: CM,, = S c , c-l Valor de “F” Calculada: pd-ZMTR CME Valor de Probabilidad: t = &L$ = El resultado se busca en tablas percentiles con S~W nT = c grados de libertad. s2(x]=cM, + L-p. n Valor de “F” Crítica: n 37 ANOVA DOS FACTORES sc&* = Suma de Cuadrados Total: i=li j=lIr.(Xij-x>z Suma de Cuadrados de Hileras: SCH= c [ii ( Xi - X ) 2 ] Suma de Cuadrados de Columnas: Grados de Libertad: SC,=rL)I(X,-X)21 Total=n,- 1 Error=(r- l)(c- 1) Columnas = c - 1 Cuadrado Medio del Error: CME = Cuadrado Medio de Hileras: CMH = 2q.g (r-l) Hileras = r - 1 Sc, (r-1) (c-l) Cuadrado Medio de Cohmnas: CMc = .& (c-l) Valor de “F” Calculada: Hileras:FfT = aI, Columnas: F = .ac CME CME 38 Valor de Probabilidad: tC = “1L~2 = El resultado se busca en tablas percentiles con (cr l)(r- 1) 9 xi grados de libertad. G(X)= CME + CM, n n h = -‘/ Fcalculada Valor de “F” Crítica: F crit. = = El resultado se busca en tablas percentiíes con (c-l ) (r- 1) grados de libertad. (c- 1) 6 (r- 1) (c-l)(r-1) 39 PRITEBA t DE STUDENT: DOS MUESTRAS PAREADAS PARA PROMEDIOS Media: X=clx.,) n Varianza: Coeficiente de Pearsons: r= z (Xi - X) (,Y; - Y) d[ c (X; - X)2 ] [ 2 (Y; - w2 1 = c (X; - X) (Yi - r n-l Varianza Combinada: s2c Grados de Libertad: n-f Valor de “t” Calculado: t= -----d S&i- d z ----------n = El resultado se busca en tablas percentiles con (n - 1) grados de libertad. LITERATURA CITADA. ALBERTS, B. (1989) Molecular biology of the ceh. Segunda edicion. Garland Publishing, Inc. U.S.A. 1219 pp. ANDERSON, J. W. (198 1) Light energy dependent processes other than CO2assimilation. In: H.atch, M. D. & Boardman, N. K. (eds.) The biochemistry of plants: photosynthesis. Academic Press, London, New York, pp, 473 - 500. BIDWELL, R. G, S. (1979) Fisiología vegetal A.G.T. Editor S.A. México. 783 pp. BIJTTERFASS, T. (1979) Pattems of chloroplast reproduction. Cell biology monographs, vol. VI. Springer, Berlín Heidelberg New York. CLINE, K.; Keegstra, K.; Staehelin, L. A. (1985) Freeze-fracture electron microscopic analysis of ultrarapidly frozen envelope membranes on intact chloroplasts and after purification. Protoplasma 125: ll 1 - 123. COOMBS, J. & Greenwood, A. D. (1976) Compartmentation of the photosynthetic apparat-us. In: Barber, J. (ed.) The intact chloroplast. Elsevier, Amsterdam, New York, Oxford, pp. 1 - 5 1, DOUCE, R. & Joyard, J. (1979) Structure and function of the plastid envelope. Adv. Bot. Res. 7: 1 - 116 ELLIS, R. J. (1976) Protein and nucleic acid svnthesis by chloroplasts. In: Barber, J. (ed.) The intact chloroplast. Elsevier, Amsterdam, New York, Oxford, pp. 335 - 364. GIh4h4LER, H.; Schafer, G.; Heber, U. (1974) Low permeability of the chloroplast envelope towards cations. Proc. Int. Congr. Photosynth. 3rd 2: 1381 - 92. Amsterdam Elsevier-North Holland. BEBER, U. & Heldt, H. W. (1981) The chloroplast envelope: structure, function, and role in leaf metabolism. Ann. Rev. Plant Physiol. 32: 139 - 68. Annual Reviews Inc. HEBER, U. & Purczeld, P. ( 1977) Substrate and product fluxes across the chloroplast enveloge durinp bicarbonate and nitrite reduction. Proc. Int. Congr. Photosynth. 4th Reading, pp. 107-l 8. London: Biochem. Soc. HELDT, H. W. & Sauer, F. (1971) The inner membrane of the chloroplast envelope as the site of specific metabolite transport. Biochem. Biophys. Acta 234: 83 - 91. HESLOP-HARRISON, J. (1963) Structure and morphogenesis of lamellar svstems in mana containing chloroplasts. 1. Membrane structure and lamellar architecture. Planta 60: 243 - 260. HOPPE, W.; Lohmann, W.; Markl, II. ; Ziegler, H. (1982) Biophysics Segunda edición. Springer-Verlag Berlín Heidelberg. Alemania. 94 1 pp. 42 KAíSER, W. M.; UrbacFt, W,; Gimmler, FT, (1940) The r~1.e Qf rn_snovalent cations for photosynthesis of isolated intact chloro&.sts. Planta. 143: 170 75, Ml3XE, W. (1962) Structure md chemistry of plastids. Annu Rev Plant Physio! 13: 27 - 44, MQRGAN, M. C. (í990) Procesos enerkticos de la vida. Area: Conceptual. Serie: M~tidki~l~gk3, Segada edición, Triks, M&&sQ, 70 pp 43 ROBINSON, S. P. & Walker, D. A. (1981) Photosynthetic casbon reduction cvcle. In: Hatch, M. D. & Boardman, N. K. (eds.) The biochemistrv of plants: photosvnthesis. Academic Press, London, New York, pp. 193 - 236. SIMPSON, D. J. (1978 b) Freeze-fracture studies on barley plastid membranes. II. Wild type chloroplast. Carlsberg Res Commun. 43: 365 389. SPREY, B. & Laetsch, W. M. (1976) Chloroplast envelopes of Spirzacia oleracea, L . III. Freeze-fracturing of chloroplast envelopes. Z Pflanzenphysiol. 78: 360 - 371. STAEHELIN, L. A. & Arntzen, C. J. ( 1983) Re,qulation of chloroplast membrane function: nrotein phosphorvlation changes the spatial organization of membrane components. 5. Ce11 Biol. 97: 1327 - 1337. STAEHELIN, L. A. & Arntzen, C. J. (1986) Photosynthesis III: photosvnthetic membranes and li&t harvesting; systems. Encyclopedia of plant physiology New Series Volume 19 Springer-Verlag, Berlín, Heidelberg, New York, Tokio. 802 pp. THOMSON, W. W. (1974) Ultrastructure of mature chloroplasts. In: Robards, A. W. (ed.) Dynamic; aspects of plant ultrastructure. McGraw-Hill, London, New York, pp. 138 - 177. WEHRMEYER, W. (1964 a) Zur Kl&-unP der strukturellen variabilitat der chloroplastengrana des spinats in profil und aufsicht. Planta 62: 272 - 293. 44 WEHRMEYER, W . (1964 b) Über membranbildungsprozesse in chloroplasten . TI. Zur entstehung der grana durch membranüberschiebung. Planta 63: 13 - 30.