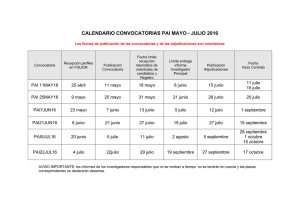
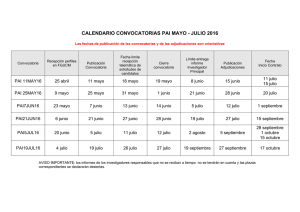
XXXX - Sociedad Argentina de Hematología
Anuncio

XXXX HEMATOLOGIA 1 ARGENTINA ÓRGANO DE DIFUSIÓN DE LA SOCIEDAD ARGENTINA DE HEMATOLOGÍA Esta revista está indizada en la Base de Datos LILACS, BIREME, BRASIL ISSN: 0329-0379 Presidente: Dardo Riveros Vice-Presidente: Jorge Milone Secretaria: Moira Lluesma Goñalons, Tesorero: Luis Palmer Carlos Ponzinibbio Director Gustavo Kusminsky, Buenos Aires Secretario de Redacción Comité de Redacción Jorge Arbelbide, Buenos Aires José Ceresetto, Buenos Aires Gustavo Chiappe, Buenos Aires Dorotea Fantl, Buenos Aires Regina Kohan, Buenos Aires Marta Martinuzzo, Buenos Aires Arturo Musso, Buenos Aires Carlos Ponzinibbio, Buenos Aires CONSEJO CIENTÍFICO ASESOR Mario Aggio, Bahía Blanca Luis Aversa, Buenos Aires Alfredo Basso, Buenos Aires Raimundo F. Bezares, Bs. As. Eduardo Bullorsky, Bs. As. Pedro Bustelo, Bs. As. Luis Carreras Vescio, Francia Fernando Cavagnaro, Bs. As. Eduardo Dibar, Bs. As. Hugo Donato, Bs. As. Beatriz Iparraguirre, Bs. As. Abraham Kohan, Bs. As. Regina Kohan, Bs. As. Lucía Kordich, Bs. As. Jorge Korín, Bs. As. Benjamín Koziner, Bs. As. Emilio Lanari, Corrientes Valentín Labanca, Mendoza Graciela Lucero, Bs. As. Mónica Matus, Santa Fe Jorge Milone, Bs. As. Arturo Musso, Bs. As. Elsa Nucifora, Bs. As. Emilio Palazzo, Córdoba Santiago Pavlovsky, Bs. As. Raúl Pérez Bianco, Bs. As. Lorenzo Pérez Polo, Mendoza Marco Pizzolato, Bs. As. Roberto Raña, Neuquén Julio C. Sánchez Avalos Bs. As. Norma Tartas, Bs. As. Miguel Tezanos Pinto, Bs. As. VOLUMEN 13 Nº 2 ● MAYO-AGOSTO ● 2009 Edición: Sociedad Argentina de Hematología: Julián Alvarez 146 - C1414 DRD - TEL/FAX: 4855-2452 e-mail: [email protected] Hematología se distribuye cuatrimestralmente en forma gratuita a los miembros de la Sociedad Argentina de Hematología Registro de la Propiedad Intelectual Nº 155751 El contenido de los artículos y de los avisos publicitarios no reflejan necesariamente la opinión del Editor 2 HEMATOLOGIA ● Volumen 1 - Nº 1, 1996 HEMATOLOGIA ARGENTINA VOLUMEN 13 Nº 2 ● MAYO-AGOSTO DE 2009 CONTENIDO IMÁGENES EN HEMATOLOGÍA Leucemia mieloide aguda con metástasis de carcinoma poco diferenciado en médula ósea. Un hallazgo inesperado Juliana Zimerman, Natalia Schutz, Jorge Arbelbide, Dorotea Fantl, Hernán García Rivello .................................. 35 ARTÍCULO ORIGINAL Evaluación de polimorfismos genéticos protrombóticos y alteraciones del sistema fibrinolítico en mujeres con historia de complicaciones obstétricas Yolanda P Adamczuk, María Luisa Iglesias Varela, Graciela S Cerrato, Ricardo R Forastiero, Marta E Martinuzzo 41 Clinical Outcome of Patients with Relapsed/Refractory Acute Leukemia Treated with FLAG-IDA Regimen Ana L Basquiera, M Virginia Prates, María Moirano, Cecilia García Erlich, Patricia Fazio, Ana G Sturich, Adriana R Berretta, M Gelemur, Jorge H Milone, Juan J García ............................................................................................ 49 ARTÍCULO REVISION Tromboprofilaxis: La Inyección o la Pastilla? José M. Ceresetto ................................................................................................................................... 53 ARTÍCULO ORIGINAL Diagnóstico y tratamiento de la flegmasia cerulea dolens Andrés Lázaro Brodsky, Marcelo José Melero, Carlos Darío Carbia ......................................................................... 68 REGLAMENTO DE PUBLICACIONES ................................................................................................... 74 Leucemia mieloide aguda con metástasis de carcinoma poco diferenciado en médula ósea. Un hallazgo inesperado Juliana Zimerman1, Natalia Schutz1, Jorge Arbelbide1, Dorotea Fantl1, Hernán García Rivello2 IMAGEN 1 Servicio de Hematología, Hospital Italiano de Buenos Aires; Servicio de Anatomía Patológica, Hospital Italiano de Buenos Aires 2 Fecha de recepción: 20/7/09 Fecha de aprobación: 30/7/09 HEMATOLOGIA, Vol. 13 Nº 2: 35-36 Mayo-Agosto 2009 Paciente femenina, 69 años, antecedentes de síndrome pluriglandular autoinmune, hernia hiatal e hipercolesterolemia. En junio del 2008 presenta anemia y leucopenia con aumento de transaminasas, se suspende fenofibrato por sospecharse como posible causante del cuadro. En julio revierte la hepatitis pero presenta progresión de las citopenias, por lo que es derivada a Hematología. La paciente presenta en el momento de la consulta disnea clase funcional III y fiebre. Al examen físico: mal estado general, taquicardia, rales crepitantes en hemitórax derecho y esplenomegalia. Hto 21%, Hb 7,4 gr/dl, Gb 770 mm3, plaquetas 181900 mm3, FAL 188, GOT 129, GPT 92, proteínas totales 5,8 gr/dl, albúmina 2,3 gr/dl, LDH 278 (VN: < 192) y función renal normal. TAC de tórax: Consolidación parenquimatosa heterogénea con broncograma aéreo afectando el lóbulo inferior derecho, compatible con proceso infeccioso en evolución, sin adenomegalias a nivel del mediastino. La paciente fue internada con diagnóstico de neutropenia febril con foco respiratorio, neumonía aguda de la comunidad (NAC), comenzando tratamiento antibiótico. Se realiza punción y biopsia de médula ósea con fenotipificación por citometría de flujo y citogenético. Aspirado médula ósea: celularidad aumentada. Hipoplasia de las series eritroide y mieloide. Fig. 1.– Infiltración medular por células epiteliales atípicas y blastos con diferenciación mieloide (100x). Fig. 2.– Expresión de citoqueratina 7 en las células epiteliales atípicas (DAB, 400x). 36 Fig. 3.– Expresión de CD34 en las los blastos mieloides (DAB, 400x). HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 Marcada infiltración por blastos de aspecto mieloide. Citometría: Blastos: 51%, CD34+, CD45+, CD7+, CD20+ parcial, CD33+ parcial, CD117+, CD15-, MPO+, CD10-, CD19-, HLA-DR+ intenso. Citogenético: 30 metafases. Cariotipo 46 XX del (18)(q11.2)(19)/46,XX(11). Biopsia de médula ósea: reemplazo de la celularidad por precursores inmaduros (CD34+, glicoforina C-) y colgajos de células epiteliales atípicas de gran tamaño (pancitoqueratina+, citoqueratina 7+, citoqueratina20-, vimentina-, receptores estrogénicos -). Diagnóstico: Leucemia mieloide aguda con metástasis de carcinoma poco diferenciado. El fenotipo observado (CK7+/CK20-) y el aspecto histológico son vinculables a origen pulmonar, aunque este fenotipo puede observarse también en neoplasias de origen mamario y ovárico. Evaluación de polimorfismos genéticos protrombóticos y alteraciones del sistema fibrinolítico en mujeres con historia de complicaciones obstétricas Yolanda P Adamczuk1, María Luisa Iglesias Varela1, Graciela S Cerrato1, Ricardo R Forastiero1,2, Marta E Martinuzzo1 ARTÍCULO ORIGINAL 1 Laboratorio de Hemostasia y Trombosis. Servicio de Hematología. Fundación Favaloro. Hospital Universitario. Buenos Aires Argentina 2 Hematología. Universidad Favaloro. Buenos Aires. Argentina Correspondencia: Dra. Marta E. Martinuzzo Laboratorio de Hemostasia y Trombosis Servicio de Hematología, Fundación Favaloro-Hospital Universitario Belgrano 1746 1er Subsuelo. Hematología 1093 Buenos Aires. Argentina Fax: (54)(11)4378-1200. Int 1219 TE: (54)(11) 4378-1349 Fecha de recepción: 30/6/09 Fecha de aprobación: 10/7/09 RESUMEN La presencia de polimorfismos protrombóticos y algunas alteraciones fibrinolíticas han sido descriptas en las pacientes con pérdidas de embarazos (PE) recurrentes si bien no hay datos concluyentes al respecto y menos aún en pacientes con falla de implantación. El objetivo del trabajo fue en primer lugar analizar la prevalencia de 3 polimorfismos protrombóticos [Factor V Leiden, Polimorfismo del gen de la Protrombina 20210 (PT 20210) y polimorfismo del promotor del PAI 1 (4G5G)] en 147 pacientes con historia de PE comparados con un grupo control de mujeres sanas con historia de embarazos sin complicaciones. En segundo lugar, analizar la correlación entre 3 pruebas del sistema fibrínolítico: PAI 1 inmunológico, Lisis de euglobulinas (LE) pre y post isquemia y polimorfismo del PAI 1 4G5G en un grupo de 92 mujeres con historia de PE (n=49) o fallas de implantación (FI) post procedimientos de fertilización in vitro ( n=43). La prevalencia de los polimorfismos protrombóticos estudiados en las pacientes no fue significativamente diferente de la hallada en el grupo control normal, excepto para el Factor V Leiden en PE tardías (p=0.03) y sólo una tendencia para el PAI 4G4G en abortos tempranos recurrentes (p=0.08). La respuesta en la LE post isquemia fue mala en el 17.4% y ligeramente alterada en el 19.3%. Considerando a la población total de 92 mujeres con complicaciones obs- HEMATOLOGIA, Vol. 13 Nº 2: 41-48 Mayo-Agosto 2009 tétricas, no existió relación entre los niveles de PAI 1 o la respuesta fibrinolìtica a la isquemia con el genotipo del promotor del PAI. Los niveles de PAI 1 estuvieron significativamente más elevados en las mujeres que presentaban factores de riesgo clásico de enfermedad cardiovascular (32.46 vs. 20.6 ng/ ml, p=0.023), y esto fue especialmente debido al grupo de portadoras del genotipo homocigota 4G4G. Los niveles de PAI 1 y las LE pre y post isquemia presentaron correlación positiva con el índice de masa corporal. En el grupo de pacientes estudiadas sólo se halló una clara asociación entre el factor V Leiden y las PE tardías. El polimorfismo del PAI 1 no se asoció a los niveles de PAI 1 ni a la respuesta fibrinolítica, excepto que las pacientes presentaran factores de riesgo clásico de enfermedad cardiovascular. Palabras claves: Polimorfismos protrombóticos, PAI 1, polimorfismo del promotor del PAI 1, pérdidas de embarazo, factores de riesgo clásico de enfermedad cardiovascular INTRODUCCIÓN Durante el embarazo están descriptos cambios importantes y graduales del sistema hemostático, que provoca una inclinación del equilibrio normal del sistema hemostático hacia un fenotipo protrombótico, 42 de manera de mantener la integridad y función placentaria y preparar a la madre para el momento del parto. Entre las modificaciones que se producen se observa aumento de factores de coagulación, siendo los más importantes el de factor VII, VIII y factor von Willebrand, especialmente en las últimas etapas del embarazo1. Sumado a esto, se producen disminuciones en los niveles de inhibidores fisiológicos del sistema de coagulación especialmente de proteína S. Finalmente se observan modificaciones del sistema fibrinolítico hacia un estado de hipofibrinolisis, dado por la disminución del activador tisular del plasminógeno, y el aumento de los niveles del inhibidor del activador del plasminógeno PAI 1 y del inhibidor de origen placentario PAI 21, 2. Es clara la asociación de embarazo con el desarrollo de complicaciones trombóticas, especialmente en el período puerperal, debido al estado hipercoagulable que llega a su máxima expresión en el momento del parto. La presencia de trombofilia genética concomitante es capaz de aumentar varias veces el riesgo de trombosis asociada al embarazo 3-5. La asociación de los anticuerpos antifosfolípidos (trombofilia adquirida) y trombofilia hereditaria, y dentro de éstas el factor V Leiden (FVL) y el polimorfismo del gen de la protrombina 20210 G→A (PT 20210), con las pérdidas de embarazo ha sido relatada y establecida a través de metanálisis. No obstante la asociación estadística, la relación de causalidad entre trombofilia genética y pérdidas de embarazo especialmente tempranas, es controvertida6-8. En la década de los 90 se ha relatado una alta frecuencia de alteraciones en la respuesta fibrinolítica a la isquemia en pacientes con abortos a repetición9, 10, en la mayor parte de los casos debido a aumentos de los niveles plasmáticos de PAI 1. Los objetivos del presente trabajo fueron evaluar la asociación de la presencia de polimorfismos protrombóticos con las pérdidas de embarazo, asi como evaluar las variables que influyen en la respuesta fibrinolítica alterada a la isquemia por éstasis venosa y en el aumento del PAI en mujeres con historia de pérdidas de embarazo o con historia de falla de implantación ante procedimientos de fertilización in vitro. PACIENTES En un primer estudio se evaluaron los polimorfismos genéticos, FVL, PT 20210 y Polimorfismo HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 de inserción deleción del promotor del PAI -675 4G5G (PAI 4G5G) en un grupo de 147 mujeres con pérdidas de embarazo que concurrieron a nuestro servicio para estudiar la presencia de trombofilia. Se incluyeron: 92 con pérdidas tardías (>10 semanas de gestación de un feto morfológicamente normal), y 55 con historia de abortos tempranos (< 10 semanas, excluyendo huevos anembrionados) a repetición (edad media 35 años, con un rango de embarazos perdidos entre 2 y 13). Como grupo control se estudiaron 88 mujeres sanas comparables en edad (media 34 años) sin complicaciones obstétricas, con al menos 2 embarazos normales. En una segunda etapa del estudio, para la evaluación de las alteraciones del sistema fibrinolítico (polimorfismo del PAI 4G/4G, PAI inmunológico y Lisis de Euglobulinas pre y post isquemia) se estudiaron 49 mujeres que habían sufrido por lo menos 2 pérdidas de embarazo recurrentes (grupo de pérdidas de embarazo PE), además se incluyeron 43 mujeres que tuvieron al menos 2 procedimientos de fertilización In vitro fallidos con transferencia de al menos 3 embriones (Grupo de falla de implantación, FI). La media de edad de las mujeres estudiadas fue de 36.6 años. Las pacientes fueron interrogadas y evaluadas desde el punto de vista clínico para recolectar datos acerca de los factores de riesgo clásico para enfermedad cardiovascular (CVD): hipertensión, tabaquismo, obesidad, dislipidemia, diabetes. EXTRACCIÓN Y TOMA DE MUESTRA Tanto los pacientes como los controles permanecieron en reposo durante por lo menos 20 minutos antes de la toma de la muestra. Para obtener las muestras de plasma se realizaron extracciones venosas por punción única y certera, evitando el éstasis venoso prolongado. Los primeros 5 ml fueron descartados y luego se recolectó la sangre en tubos plásticos que contenían citrato de sodio 0,11M (9:1). Las muestras fueron centrifugadas dos veces durante 10 minutos a 3500g para obtener el plasma pobre en plaquetas (PPP). El PPP de las pacientes fue utilizado inmediatamente para la realización de la lisis de euglobulinas y se congelaron fracciones de 1 ml a 70 °C, para los estudios posteriores (PAI). Para los análisis de biología molecular se recolectaron 2.5 ml de sangre entera en tubos estériles conteniendo EDTA-K3. En el caso de que hubiera que FLAG-ID PROTOCOL IN RELAPSE/REFRACTORY ACUTE LEUKEMIA tomar muestras de sangre para otras determinaciones además de las de biología molecular, se tuvo la precaución de cargar en primer lugar los tubos destinados paro el análisis de biología molecular. Las muestras se guardaron a 4 °C hasta el momento de la extracción del DNA. Luego de la primera extracción se colocó el tensiómetro a 90-100 mmHg (media entre la Sistólica y Diastólica) durante 20 min, finalizado este tiempo se tomó una nueva muestra recogida en citrato para realizar la lisis de euglobulinas post isquemia. DETERMINACIÓN DE PAI INMUNOLÓGICO Para la determinación de PAI-1 inmunológico se utiliza plasma citratado pobre en plaquetas. El método inmunológico (Asserachrom® PAI, Diagnostica Stago) se basa en la unión del PAI presente en el plasma a un anticuerpo monoclonal de captura pegado a la placa de ELISA; luego de la incubación, los pocillos fueron lavados y se agregó un segundo anticuerpo conjugado con peroxidasa. Finalmente luego de otro lavado, la actividad de peroxidasa se reveló mediante el agregado de TMB. El color desarrollado fue medido en el lector VERSAmax microplate reader a 405 nm. El valor normal de PAI en la población sana es de 4 a 44 ng/ml. 43 DETERMINACIÓN DE FACTOR V LEIDEN, PT 20210, PROMOTOR DEL PAI 4G5G La mutación G1691A en el gen del Factor V (FVL) fue evaluada a través de una PCR-RFLP, con la enzima de restricción Mnl I (New England Biolab) (11). La transición G→A en el nucleótido 20210 en la región 3‘no traducida del gen de la protrombina, se determinó a través de una PCR-RFLP (12) , utilizando la enzima Hind III (Promega) para la digestión. El polimorfismo 4G/5G en el promotor del gen del PAI [inserción (5G)/deleción (4G)] se estudió mediante una PCR-RFLP (14) que utiliza como enzima de restricción la Bsl I (New England Biolab). ESTADÍSTICA La comparación entre las prevalencias de los polimorfismos protrombóticos en las pacientes y los controles normales se realizó mediante el test de Contingencia X2 . Las correlaciones se realizaron a través de la correlación no paramétrica de Spearman. Las comparaciones de los niveles de PAI o de lisis de euglobulinas entre distintos grupos de pacientes se realizó mediante el test de Mann Withney. Todos los cálculos estadísticos se realizaron mediante el Software SPSS versión 15.5. RESULTADOS LISIS DE EUGLOBULINAS Para la precipitación de la fracción euglobulínica se agregaron 250 ml de plasma citratado pobre en plaquetas en un tubo conteniendo 4 ml de agua destilada con 50 ml de ácido acético al 1%. Luego de 30 min a 4 °C se centrifugó 5 min a 3000 rpm. Se descartó el sobrenadante, se secó el exceso de líquido, el precipitado se redisolvió en 250 ml de borato de sodio al 1% y luego se coaguló por el agregado de 250 ml de CaCl2 25 mM. Una vez que se formó el coágulo se mantuvo en baño termostatizado a 37 °C y se tomó el tiempo que tardó en lisar. La respuesta a la isquemia se consideró buena cuando el tiempo de lisis de la muestra post isquemia fue menor o igual a 30 min (percentilo 97.5), ligeramente alterada cuando fue entre 30 y 60 min (entre percentilo 90 y 97.5), y alterada si fue mayor a 60 min, rangos de referencia establecidos en nuestro laboratorio en la población normal. Al evaluar los polimorfismos protrombóticos en el primer grupo evaluado (147 mujeres con pérdidas de embarazo y 88 controles normales), no se halló asociación entre la presencia de PT20210 AG con las pérdidas de embarazo, pero sí se halló una prevalencia significativa mayor de FVL en las pacientes con historia de PE tardías (tabla 1). Al considerar la presencia del polimorfismo del PAI se observó una tendencia entre la presencia del genotipo 4G4G (homocigota 4G) y los abortos tempranos recurrentes, tabla 1. En una segunda etapa se estudiaron 3 pruebas del sistema fibrinolítico: Dosaje de PAI inmunológico, LE pre y post isquemia y el polimorfismo del PAI 4G/5G en un grupo de 92 mujeres con historia de PE (n=49) o FI post procedimientos de fertilización asistida (n=43) comparadas el grupo control de 88 mujeres. En este nuevo grupo de pacientes, la prevalencia del genotipo homocigota 4G/4G no demostró dife- 44 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 TABLA 1.– Prevalencia de los diferentes mutaciones y polimorfismos protromboticos en pacientes con pérdidas de embarazo FVL PT20210 PAI-1 (4G/4G) Abortos tempranos recurrentes Pérdidas fetales tardías 3/55 5.4% 1/45 2.2% 16/44 36.4% § 14/92 15.2%* 2/100 2.0% 18/93 19.3% Controles normales 2.3% 0% 21.3% *OR 7.7 (1.7-35.5), p=0.03 OR 2.1 (0.9-4.6), p=0.08 § TABLA 2.– Parámetros fibrinolíticos en relación al genotipo del promotor del PAI 4G5G Polimorf PAI 4G/4G 4G/5G 5G/5G LE basal (min) Media (DE) 219 (60) 218 (65) 220 (61) LE Post PAI (ng/ml) (min) Media (DE) Media (DE) 46 (44) 38 (38) 41 (40) 22.6 (19.1) 24.6 (23.4) 24.1 (22.1) Fig. 1.– Niveles de PAI 1 inmunológico en relación con la presencia de factores de riesgo clásico de CVD en la población total de pacientes con complicaciones obstétricas (n=92). Los resultados son graficados en Boxplot y expresados en mediana, percentilos 25 y 75, y rango. rencias significativas ni en el grupo con PE (26.3%) ni con FI (32%) comparado con el grupo control (21.6%). Fig. 2.– a) Niveles de PAI 1 inmunológico en relación con la presencia de factores de riesgo clásico de CVD en la población total de pacientes con complicaciones obstétricas portadores del genotipo homocigota 4G4G del polimorfismo del promotor del PAI 1. Los resultados son graficados en Box-plot y expresados en mediana, percentilos 25 y 75, y rango. b)Niveles de PAI 1 inmunológico en relación con la presencia de factores de riesgo clásico de CVD en la población total de pacientes con complicaciones obstétricas portadores del genotipo heterocigota 4G5G u homocigota normal 5G5G del polimorfismo del promotor del PAI 1. Los resultados son graficados en Box-plot y expresados en mediana, percentilos 25 y 75, y rango. La prevalencia de la mala respuesta en la LE post isquemia fue de 17.4 % en la población de pacientes con complicaciones obstétricas. Cuando se evaluó la FLAG-ID PROTOCOL IN RELAPSE/REFRACTORY ACUTE LEUKEMIA 45 Fig. 3.– Niveles de PAI 1 inmunológico de las pacientes con complicaciones obstétricas en relación con la respuesta fibrinolítica a la isquemia post oclusión venosa Los resultados son graficados en Box-plot y expresados en mediana, percentilos 25 y 75, y rango. Fig. 4.– Correlación no paramétrica (Spearman Rank) entre el BMI y los niveles de PAI inmunológico de las pacientes con complicaciones obstétricas. asociación entre los diferentes parámetros: Lisis de euglobulinas (pre y post isquemia) y PAI inmunológico con respecto al polimorfismo del PAI, tampoco se observaron diferencias. Los resultados obtenidos se pueden observar en la Tabla 2. La presencia de algún factor de riesgo clásico para enfermedad cardiovascular (hábito de fumar, dislipemia, obesidad, diabetes) se observó en 36 de las 92 pacientes estudiadas. Al evaluar los niveles de PAI, se observó que los mismos estaban significativamente más elevados en aquellas pacientes que presentaban factores de riesgo clásico de enfermedad cardiovascular. Los resultados se muestran en la Figura 1. Lo mismo se observó cuando se evaluaron los niveles de PAI en pacientes con genotipo homocigota 4G4G (Figura 2a), pero no en las de genotipo heterocigota u homocigota normal 5G5G (Figura 2b). También se verificó que los niveles de PAI fueron significativamente superiores en aquellas pacientes que presentaban pobre respuesta a la isquemia comparados con los de respuesta fibrinolítica adecuada como se observa en la figura 3, existiendo una correlación estadística positiva entre los tiempos de lisis de Euglobulinas tanto pre (r 0.472, p< 0.001), como post isquemia (r 0.402, p<0.001) y los niveles de PAI inmunológico. Analizando los datos obtenidos con las pacientes, se pudo constatar que existió una correlación positiva estadísticamente significativa entre el nivel de PAI plasmático y el Indice de masa corporal (BMI), Figura 4. La frecuencia de pobre respuesta (mala y ligeramente alterada) fue mayor en aquellas pacientes con factores de riego para enfermedad cardiovascular y genotipo 4G4G comparadas con las del mismo genotipo sin factores de riesgo (Figura 5). DISCUSIÓN La asociación estadística entre las pérdidas embriofetales y la presencia de trombofilia genética ha sido establecida en base a estudios familiares y también a metaanálisis. Esta asociación es clara entre el FVL y la PT 20210 AG con la historia de pérdidas de embarazo tempranas recurrentes y pérdidas tardías no recurrentes7, 15, complicaciones que también se asociaron a la deficiencia de proteína S. No obstante esto no fue hallado al analizar la presencia de deficiencia de proteína C, antitrombina o la homocigocidad para la variante termolábil de la MTHFR7. Cabe aclarar que en estas revisiones de la literatura no consideraron el polimorfismo del promotor del 46 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 Fig. 5.– Proporción de respuestas fibrinolìticas malas, ligeramente alteradas y normales frente a la isquemia por estasis venosa en función del genotipo del promotor del PAI y la presencia o ausencia de factores de riesgo de CVD. PAI 1 4G/5G. En nuestro estudio si bien la prevalencia de FVL fue significativamente más elevada en las pacientes con historia de PE tardía, dato que coincide con la literatura. Aunque la prevalencia en aborta-doras tempranas a repetición fue mayor que en los controles no se alcanzó significación estadística, posiblemente por el número de pacientes evaluadas. Con respecto a la presencia del polimorfismo del PAI 4G5G existen dos estudios del mismo grupo de investigadores que encuentran una mayor prevalencia del alelo 4 G, en las pacientes con abortos a repetición. Cabe destacar que en uno de ellos las prevalencias fueron comparadas con las de la literatura16 y en el otro el grupo control de mujeres fértiles con al menos 2 nacimientos vivos era muy pequeño17, comparado con la gran cantidad de abortadoras a repetición incluidas. En nuestro estudio, en el que utilizamos grupos controles adecuados, analizando el genotipo homocigota -675 4G4G del promotor del gen del PAI 1, si bien la prevalencia fue superior a la del grupo control, esta diferencia no alcanzó significación estadística en las pacientes con historia de pérdidas de embarazo tardías. Tan solo se observó una tendencia a una asociación entre el genotipo 4G4G y las pérdidas tempranas. No obstante, esta tendencia no se corroboró en el segundo grupo de pacientes evaluado. El PAI 1 es sintetizado en las células endoteliales, plaquetas (gran reservorio de este inhibidor) y adipocitos. Las células endoteliales no parecen ser grandes productores de PAI 1 en ausencia de estímu- los hormonales, inflamatorios o metabólicos. El gen del PAI 1 tiene diversas zonas respondedoras a un grupo de sustancias18, como por ejemplo la zona que reconoce la VLDL en la zona del promotor que induce la transcripción del gen y cuya acción es influenciada por el polimorfismo 4G5G19, 20. Asimismo se observan efectos del TNFα, insulina, glucosa, LDL, angiotensina II entre otros21, se considera al gen del PAI a un gen de expresión fundamentalmente inducible. El PAI 1 aumenta durante el embarazo, puede ser sintetizado por los sinciciotrofoblastos placentarios y tendría un aumento muy superior en pacientes que desarrollan preeclampsia o retardo del crecimiento fetal. En este grupo de pacientes el aumento de PAI 1 no se relacionó con el índice de masa corporal22. Existen evidencias de asociación entre los factores de riesgo clásico para enfermedad cardiovascular y los niveles de PAI, esto fue descripto inicialmente en pacientes con infarto agudo de miocardio, en individuos añosos, y luego estudiado en el contexto del estudio PREVEND, en hombres y mujeres de mediana edad. En el mismo se obsevó una correlación positiva entre los niveles de PAI y los de triglicéridos, colesterol, glucemia, PCR, presión diastólica, siendo la mayor parte de estas correlaciones más marcada en hombres y mujeres post menopáusicas, que en las mujeres en edad fértil23. Asimismo es muy clara la interrelación entre los genotipos y otras variables biológicas que influyen en el fenotipo que presenta cada individuo. En el caso FLAG-ID PROTOCOL IN RELAPSE/REFRACTORY ACUTE LEUKEMIA de los niveles de PAI, estos se asocian positivamente a los índices de masa corporal y la presencia de resistencia a la insulina y es conocido que cuando los individuos bajan de peso los niveles del PAI-1 disminuyen21. Es sabido que la actividad fibrinolítica global está dada por los niveles de PAI-1. En nuestro trabajo vimos una muy clara asociación entre la respuesta fibrinólitica a la isquemia alterada y los niveles más elevados de PAI. A pesar de ser una población joven, tanto la expresión de hipofibrinolisis como los niveles de PAI estuvieron claramente asociados a la presencia de factores de riesgo clásico para enfermedad cardiovascular, diabetes, dislipemia, hipertensión y sobrepeso u obesidad, confirmando lo hallado en la literatura. En esta población sin embargo no se habían registrado eventos trombóticos ni venosos ni arteriales, probablemente por la edad. Los niveles del PAI 1 y la hipofibrinolisis no se hallaron asociados al gentoipo 4G4G del promotor del PAI cuando se consideró el grupo total de pacientes, pero sí cuando se analizaron las mujeres que presentaban factores de riesgo clásico, confirmando nuevamente la interacción entre el genotipo y otras variables biológicas y metabólicas para la expresión del fenotipo hipofibrinolìtico por aumento de PAI, como ya fue descripto en la literatura. SUMMARY Evaluation of prothrombotic polymorphisms and fibrinolytic tests in patients with history of obstetric complications. The presence of prothrombotic polymorphisms as well as some fibrinolysis alterations was depicted in patients with recurrent pregnancy loss (RPL); but there are no clear conclusions about their associations with fertilization procedure failure (FPF). The aim of this study was to evaluate the presence of prothrombotic polymorphisms (factor V Leiden, PT 20210 y PAI-1 promoter polymorphism 4G5G) in 147 women with history of RPL and fibrinolytic tests: PAI-1 antigen, euglobulin lysis time (ELT) pre and post venous occlusion (VO) and PAI 4G5G in 92 women referred for RPL (n=49), or FPF (n=43). There was a statistic association between the presence of Factor V Leiden and late pregnancy loss, p=0.03. The other polymorphisms did not show statistic association with RPL, except a trend for PAI 4G4G (p=0.08). PAI 1 levels and the fibrinolytic response were not associated with PAI polymorphism considering all patients. The prevalence of very poor fibrinolytic response (PFR) to VO was 17.9% and that of slightly poor in 19.3% in the patients. PAI-1 levels were higher in women with classical risk factors for cardiovascular disease (CVD), particularly in those with 4G4G homozygous genotype. PAI- 47 1, as well as pre and post VO ELT correlated with Body Mass Index. In this group of patients, only factor V Leiden was associated with late PL. The prothrombotic polymorphisms were not associated to early RPL or FPF. Moreover, in these healthy and young women PAI-1 levels and fibrinolytic response to VO were not associated with PAI polymorphism, except in patients with classical risk factors of CVD, which were the main variables associated with hypofibrinolysis. Key words: prothrombotic polymorphisms, PAI 1, PAI 1 promoter polymorphism, pregnancy loss, cardiovascular disease risk factors BIBLIOGRAFÍA 1. Franchini M. Hemostasis and pregnancy. Thromb Hemost 2006; 95: 401-13 2. Benjamin Brenner. Haemostatic changes in pregnancy. Thromb Res 2004; 114, 409-414. 3. Firederich PW, Sanson BJ, Simioni P, y col. Frequency of pregnancy related venous thromboembolism in anticoagulant factor-deficient women: implications for prophylaxis. Ann Intern Med 1996; 125: 955-60 4. Martinelli I, De Stefano V, Taioli E, y col. Inherited thrombophilia and first venous thromboembolism during pregnancy and puerperium. Thromb Haemost 2002; 87: 791-5 5. Harvey D, Lowe GM. Factor V Leiden: association with venous thromboembolism in pregnancy and screening issues. Br J Biomed Sci 2004; 61: 157-64. 6. Opatrny L, David M, Kahn SR, y col. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a meta-analysis. J Rheumatol 2006; 33: 2214-21. 7. Robertson L, Wu O, Langhorne P, Twaddle S, y col. Thrombophilia in pregnancy: a systematic review. Br J Haematol 2006; 132: 171-96. 8. Middeldorp S. Thrombophilia and pregnancy complications: cause or association? J Thromb Haemost 2007; 5 (suppl 1): 276-82. 9. Patrassi GM, Sartori MT, Ruffatti A, y col. Fibrinolytic pattern in recurrent spontaneous abortions: no relationship between hypofibrinolysis and anti-phospholipid antibodies. Am J Hematol 1994; 47: 266-72 10. Sarto A, Rocha M, Martínez M, y col. Hipofibtinolisis y otras alteraciones de la hemostasia en mujeres con antecedentes de fallas reproductivas tempranas. Medicina 2000; 60: 441-7. 11. Zöller B, Svensson PJ, He X, Dahlbäck B. Identification of the same factor V gene mutation in 47 out of 50 thrombosis-prone families with inherited resistance to activated protein C. J Clin Invest 1994; 94: 2521-4. 12. Rajesh K. Kapur, Lisa A. Mills, Silvia G. Spitzer, Mae B. Hultin. A Prothrombin Gene Mutation Is Significantly Associated With Venous Thrombosis. Arterioscler Thromb Vasc Biol 1997; 17: 2875-2879. 13. Hironobu Fujimura, Tomio Kawasaki, Toshiyuki Sakata, Hideo Ariyoshi, Hisao Kato, Morito Monden and Toshiyuki Miyata. Common C677T Polymorphism in the Methylenetetrahy- 48 drofolate Reductase Gene Increases the Risk for Deep Vein Thrombosis in Patients with Predisposition of Thrombophilia. Throm Res 98 (2000) 1-8. 14. Margaglione M, Grandone E, Cappucci G, y col. An alternative method for PAI-1 promoter polymorphism (4G/5G) typing. Thromb Haemost 1997; 77: 605-6 (letter). 15. Rey E, Kahn SR, David M y col. Thrombophilic disorders and fetal loss: A meta-analysis. Lancet 2003; 361 (9361): 901-8 16. Goodman CS, Coulam CB, Jeyendran RS, y col. Which HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 thrombophilic gene mutations are risk factors for recurrent pregnancy loss? Am J Reprod Immunol 2006; 56(4): 230-6. 17. Coulam CB, Wallis D, Weinstein J y col. Comparison of thrombophilic gene mutations among patients experiencing recurrent miscarriage and deep vein thrombosis. Am J Reprod Immunol 2006; 60: 426-31. 18. Vaughan DE. PAI-1 and atherothrombosis. J Thromb Haemost 2005; 3: 1879-83. 19. Lijnen HR. Pleiotropic functions of plasminogen activator in- “Clinical Outcome of Patients with Relapsed/ Refractory Acute Leukemia Treated with FLAG-IDA Regimen” Ana L Basquiera1, M Virginia Prates2, María Moirano3, Cecilia García Erlich3, Patricia Fazio3, Ana G Sturich1, Adriana R Berretta1, M Gelemur3, Jorge H Milone2, Juan J García1 ARTÍCULO ORIGINAL 1 Department of Hematology and Oncology, Hospital Privado Centro Médico de Córdoba, Córdoba, Argentina 2 ITMO, Hospital Italiano, La Plata, Buenos Aires, Argentina HIGA San Martín, La Plata, Buenos Aires, Argentina Corresponding author: Ana L Basquiera, MD Naciones Unidas 346 (5016) Córdoba , Argentina TE: 54-351-4688250; FAX: 54-351-4688270 E-mail: [email protected] Fecha de recepción: 20/4/09 Fecha de aprobación: 15/5/09 HEMATOLOGIA, Vol. 13 Nº 2: 49-52 Mayo-Agosto 2009 ABSTRACT INTRODUCTION Background: Patients with Refractory/Relapsed (R/R) acute leukemia (AL) have a poor prognosis. Objective: We aimed to evaluate the chemotherapy regimen fludarabine, cytarabine, granulocyte colony-stimulating factor, and idarubicin (FLAG-IDA) in patients with R/R AL. Patients: We studied 33 patients with R/R AL. Distribution of the AL subtype was: myeloblastic n=17 (52%), lymphoblastic n=14 (42%),) and biphenotypic n=2 (6%). Results: Complete remission (CR) was achieved in 15 cases (45.5%) and seven patients dead resulting in a mortality of 21.1%. In patients with hematological recovery the median time to neutrophils recovery (> 0.5 x 109/ l) was 24 days (range 10-38); platelet levels of more than 20 x 109/l and 50 x 109/l were reached in a median time of 24 (range 17-44) and 27 days (range 18-51), respectively. After CR, five patients underwent allogeneic transplantation and 10 patients received a second course of FLAGIDA. Ten out of 15 patients who achieved CR with FLAGIDA relapsed at a median of 7.7 months (95% CI 1.8 to 13.6 months). Overall survival (OS) after FLAG-IDA in the surviving cohort had a median of 4 months. We found a significantly better OS in patients who received allogeneic transplantation post-FLAG-IDA than those who did not (median 11.4 months vs. 2.7 months; HR 0.29; 95% CI 0.1 to 0.6; p=0.017). Conclusions: In our series, FLAGIDA demonstrated to be an effective salvage chemotherapy regimen, however, the benefit in survival of this rescue treatment was restrained to patients who underwent allogeneic transplantation. Even though important advances in diagnosis and therapy of acute leukemia have been recently accomplished, most of the patients die of this disease.1 Acute leukemia in adults and children includes a spectrum of diseases that ranges from patients with a very poor prognosis, like older patients with acute myeloid leukemia (AML) to those with childhood acute lymphoblastic leukemia (ALL), where the cure rate with chemotherapy approaches 85%1, 2. Patients with refractory or relapsed leukemia have a poorer outcome, and allogeneic hematopoietic stem cell transplantation (HSCT) is recommended in these patients, provided that complete remission (CR) is achieved previous to transplantation 1. In these settings, FLAG-IDA (fludarabine, cytarabine, granulocyte colony-stimulating factor and idarubicin) has been indicated in both, adults and children with AML or ALL2, 3. FLAG-IDA is a combination chemotherapy based on the effect of priming with granulocyte colony-stimulating factor on blast cells, in order to increase their susceptibility to specific cell cycle agents, such as cytarabine4. The addition of fludarabine enhances the intracellular concentration of the cytarabine active metabolite, ARA-C-5´triphosphate, in leukemic blasts. Also, idarubicin is known to be less susceptible to multidrug resistance and may be less cardiotoxic.3 We aimed to evaluate the chemo- Key words: FLAG-IDA-leukemia-relapse-survivaltransplantation 50 therapy regimen composed by fludarabine, cytarabine, granulocyte colony-stimulating factor, and idarubicin (FLAG-IDA) in patients with relapsed/refractory (R/R) acute leukemia (AL). PATIENTS AND METHODS In a non-randomized retrospective study, we evaluated 33 patients with R/R AL who underwent FLAG-IDA as rescue regimen: 17 (52%), 14 (42%) and 2 (6%) patients had myeloblastic, lymphoblastic and biphenotypic leukemia, respectively. The patients were treated in 3 different institutions between June 2001 and April 2007. Cytogenetic studies at diagnosis were abnormal in 18 cases, normal in 10 cases and no metaphases were obtained in 5 cases. After diagnosis of AL, all patients had already received first line chemotherapy, according to the corresponding protocol of the Argentine Group for the Treatment of Acute Leukemia Study (GATLA). FLAG-IDA was indicated due to relapsed AL in 27 patients and refractory AL in 6 cases. Before administering FLAG-IDA, 17 (52%) patients were in their first relapse, 12 patients (36%) had received at least 2 different chemotherapy protocols (anti-CD33 monoclonal antibody combined with chemotherapy in 3 cases), and 4 (12%) patients underwent bone marrow transplantation (2 autologous transplantation and 2 allogeneic related transplantation). The median time from diagnosis of relapse or resistance to the beginning of FLAG-IDA was 10.23 months (r= 1.6 to 131 months). The doses of FLAG-IDA were administered as follows: 30-minute intravenous infusion of fludarabine 25 mg/m2 during days 1 to 4, 3-hour intravenous infusion of cytarabine 2 gr/m2 during days 1 to 4 (starting 4 hours after the beginning of fluradarabine), 15-minute intravenous infusion of idarrubicine 12 mg/m 2 during days 1 to 3 after ending cytarabine, and subcutaneous G-CSF 5 mcg/Kg daily, since day 0 to the end of chemotherapy, and resuming 7 days after completing chemotherapy until granulocyte recovery2, 3. Routine procedures and preventive measures, such as antibiotic prophylaxis and treatment were chosen by each institution following international recommendations. For each patient, we registered data related to: age, type of leukemia, performance status, karyotype at diagnosis, laboratory analysis, response category, consolidation treatment after FLAG-IDA, date of relapse and last visit or death. Toxicity of FLAG-IDA was evaluated according to NCI 3.0 version. Institutional Ethics Committees approved the study. HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 Complete remission (CR) and other response categories were defined as previously described1, 5. Overall survival (OS) was calculated from beginning of FLAG-IDA until death from any cause or date of last visit. Relapse free survival (RFS) was defined for patients in CR from date of attaining CR until AL relapse or death from any cause5. Time-event variables were estimated by the Kaplan-Meier method and compared with log-rank test. Multivariate analysis was performed with Cox-regression analysis. All p values were two sided and p <0.05 was considered statistically significant. RESULTS At the start of the FLAG-IDA protocol median age was 22 years (r= 11-56) and performance status was: 0 (n= 11), 1 (n= 13) and ≥ 2 (n= 9). None of the patients had compromise of the central nervous system. At day 0, media values of hemogram were: WBC 25,257.57/mm3 (±52,772.80); percentage of blast cells in peripheral blood 40.76% (±37.99); haemoglobin (Hb) 9.34 gr/dL (±2.22); and platelet count 89,284/ mm3 (±11, 4910.26). All patients had at least 1 episode of febrile neutropenia in a median of 8 days (r= 3-17) with positive blood cultures in 42% of the events. Grade 5 toxicity occurred in 7 patients resulting in a treatment-related mortality of 21.1%. All the deaths were due to sepsis. In patients with hematological recovery (n= 21; 63.6%) the median time to neutrophil recovery (> 0.5 x 109/L) was 24 days (r= 10-38); platelet counts of more than 20 x 109/L and 50 x 109/L were reached in a median time of 24 (r= 17-44) and 27 days (r= 18-51), respectively. Median hospitalization time was 28 days (r= 1-86). Overall, CR was achieved in 15 patients (45.5%), partial remission (PR) in 1 patient (3%) and 10 patients presented disease progression (30.3%). Response rates according to AL category are shown in Table I. In the univariate analysis, factors significantly associated with CR were haemoglobin level (10.2 gr/ TABLE I. Complete Remission Rate related with FLAGIDA treatment (n= 33)* Variable All patients Relapsed AL Refractory AL Myeloid AL Lymphoid AL Biphenotypic AL Number of Patients 33 26 7 17 14 2 CR rate (%) 15 12 3 5 8 2 * AL= acute leukemia; CR= complete remission. 45.4) (46.1) (42.8) (29.4) (57.1) (100) FLAG-ID PROTOCOL IN RELAPSE/REFRACTORY ACUTE LEUKEMIA O D Y L Y U X 6 O O D U H Y 2 S 0RQWKV Fig. 1. Overall survival (OS) of patients who underwent allogeneic HSCT post-FLAG-IDA (thick line) compared to those who did not (thin line). dL vs. 8.6 gr/dL; p= 0.04) and percentage of blast cells in peripheral blood (29.6% vs. 56.1%; p= 0.05) at the beginning of FLAG-IDA. After CR, 5 patients underwent HSCT (HLA-matched related donor in 4 patients and unmatched related donor in 1 patient) and 10 patients received a second course of FLAG-IDA (2 of these patients underwent allogeneic transplantation from HLA-matched unrelated donor and 8 without consolidation with transplantation). No grade 4 or 5 toxicity occurred with the second course of FLAG-IDA. Ten out of 15 patients in CR relapsed with a RFS of 7.7 months (r= 1.8-13.6). OS after FLAG-IDA in the surviving cohort had a median time of 4 months (95% CI, 2.4 to 5.6 months) and 1-year survival was 12.33%. We found a significantly better OS in patients who underwent allogeneic HSCT post-FLAG-IDA compared to those who did not (median 11.4 vs. 2.7 months; HR 0.29; 95% CI, 0.1 to 0.6; p= 0.017) (Fig. 1); in patients with normal karyotype at diagnosis of AL: 14.9 vs. 3.1 months; HR 0.35 (95% CI, 0.1 to 0.8; p= 0.011); and in patients with Hb level ≥10 gr/dL previous FLAGIDA: 7.2 vs. 2.7 months; HR 0.39 (0.19 to 0.82; p= 0.0197). In the multivariate analysis, only those who had received allogeneic transplantation post-FLAGIDA, remained statistically significant for OS (Fig. 1). DISCUSSION We have analysed the outcome of FLAG-IDA in a heavily pre-treated series of patients with R/R AL, both AML and ALL. Results on the use of G-CSF as priming in AL chemotherapy have been discordant in comparative studies. Estey et al. reported not differences between patients with myeloid malignancies receiving G-CSF or not, regarding CR or OS, with a 51 combination of fludarabine and cytarabine6. Löwenberg et al. found a higher CR and OS in the subgroup of standard risk AML7. We found a 45.4% of CR following a single course of FLAG-IDA. Trials evaluating FLAG-IDA in patients with refractory/relapse AML have reported a response rate of CR between 40 and 60%. The highest CR rate has been reported in children with AML. Few reports have evaluated the efficacy of FLAG-IDA in patients with ALL. A CR rate of 39% has been reported, but none of the patients with refractory disease achieved CR in this series8. However, G-CSF had been administered after completing chemotherapy and the priming effect of G-CSF may have been lost8. Effects of growth factors priming have been studied both in AML cells and in ALL4, 9, and response may be higher in ALL with myeloid antigen co-expression9. We reported a higher response rate in ALL patients including 2 patients previously refractory to induction chemotherapy. However, in patients with Phi+ALL, we had a lower CR rate (1/3) compared to other authors (5/6), and the only patient who responded received imatinib along with FLAG-IDA10. Toxicity observed in our series and in previous studies was considerable, probably because patients with high risk factors were included 11. Mortality rate with FLAG-IDA may be clearly superior in patients with refractory/relapsed disease, compared to those with de novo disease, and 0% mortality has been reported when FLAG-IDA was used as first-line therapy 3. On the other hand, no treatment-related mortality was observed during a second course of FLAG-IDA in this and other series8, even though higher mortality in children has been described because of a more prolonged myelosuppression2. We did not evaluate minimal residual disease after induction with FLAG-IDA, which indicates the quality of the response and is a prognostic marker in the upfront treatment1. However, minimal residual disease has not been evaluated in the setting of relapsed disease and the optimal timing has not been established12. In our series, FLAG-IDA demonstrated to be an effective salvage chemotherapy regimen but presented a high rate of treatment-related deaths. We found that the benefits of this rescue treatment on survival were restrained to patients subsequently who underwent allogeneic transplantation, underlying the correct selection of patients when an effective but toxic treatment was indicated. New agents in this setting should be considered. RESUMEN Objetivo: Evaluar la respuesta al esquema FLAG-IDA (fludarabina, citarabina, idarrubicina y G-CSF) en pacientes 52 con leucemia aguda (LA) recaída/refractaria (R/R). Métodos: Estudio retrospectivo multicéntrico. Treinta y tres pacientes con LA R/R: mieloblástica 17 (52%), linfoblástica 14 (42%) y bifenotípica 2 (6%). Resultados: 15 (45.5%) pacientes obtuvieron remisión completa (RC) y 7 pacientes fallecieron resultando en una mortalidad del 21,1%. En pacientes con recuperación hematológica la mediana para alcanzar > 0.5 x 109/l neutrófilos fue de 24 días (rango 1038) y la recuperación de plaquetas de >20 x 109/l y > 50 x 10 9/l fue de 24 días (17-44) y 27 días (18-51), respectivamente. Posterior a la RC, 7 pacientes recibieron trasplante alogénico (TxMO) y 10 pacientes un segundo ciclo de FLAG-IDA. 10/15 pacientes en RC presentaron recaída en una mediana de 7,7 meses (95% IC 1,8 a 13,6). La mediana de sobrevida global (SG) pos-FLAG-IDA fue de 4 meses. Hubo una diferencia significativa en SG a favor de los pacientes que recibieron TxMO pos-FLAG-IDA (11,4 vs 2,7 meses; HR 0,29; 95% IC 0,1 a 0,6; p= 0,017). En el análisis multivariado, el TxMO pos-FLAG-IDA retuvo significancia estadística. Conclusiones: El esquema FLAG-IDA demostró ser efectivo para obtener RC, independiente del tipo de LA y aún en pacientes refractarios. Sin embargo, el beneficio en SG está influenciado por el tratamiento posterior con TxMO. Palabras Claves: FLAG-IDA-leucemia-recaída-sobrevida-trasplante REFERENCES 1. Appelbaum FR, Rosenblum D, Arceci RJ, et al. End points to establish the efficacy of new agents in the treatment of acute leukemia. Blood 2007; 109: 1810-1816. 2. Fleischhack G, Hasan C, Graf N, Mann G, Bode U. FLAG-IDA (idarubicin, fludarabine, cytarabine, G-CSF), an effective remission-induction therapy for poor-prognosis AML of childhood prior to allogeneic or autologous bone marrow transplantation: experiences of a phase II trial. Br J Haematol 1998; 102: 647-55. 3. Parker JE, Pagliuca A, Mijovic A, et al. Fludarabine, cytarabine, G-CSF and idarubicin (FLAG-IDA) for the treatment of poor- HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 4. 5. 6. 7. 8. 9. 10. 11. 12. risk myelodysplastic syndromes and acute myeloid leukaemia. Br J Haematol 1997; 99: 939-44. Tosi P, Visani G, Ottaviani E, Manfori S, Zinzani PL, Tura S. Fludarabine + Ara-C + G-CSF: cytotoxic effect and induction of apoptosis on fresh acute myeloid leukemia cells. Leukemia 1994; 8: 2076-2082. Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the International Working Group for Diagnosis, Standardization of Response Criteria, Treatment Outcomes, and Reporting Standards for Therapeutic Trials in Acute Myeloid Leukemia. J Clin Oncol 2003; 21: 4642-4649. Estey E, Thall P, Andreeff M, et al. Use of granulocyte colonystimulating factor before, during, and after fludarabine plus cytarabine induction therapy of newly diagnosed acute myelogenous leukemia or myelodysplastic syndromes: comparison with fludarabine plus cytarabine without granulocyte colony-stimulating factor. J Clin Oncol 1994; 12: 671-8. Löwenberg B, van Putten W, Theobald M, et al. Effect of priming with granulocyte colony-stimulating factor on the outcome of chemotherapy for acute myeloid leukemia. New Engl J Med 2003; 349: 743-52. Specchia G, Pastore D, Carluccio P, et al. FLAG-IDA in the treatment of refractory/relapsed adult acute lymphoblastic leukemia. Ann Hematol 2005; 84: 792-5. Visani G, Tosi P, Zinzani PL, et al. FLAG (fludarabine, cytarabine, G-CSF) as a second line therapy for acute lymphoblastic leukemia with myeloid antigen expression: in vitro and in vivo effects. Eur J Haematol 1996; 56: 308-12. Virchis A, Koh M, Rankin P, et al. Fludarabine, cytosine arabinoside, granulocyte-colony stimulating factor with or without idarubicin in the treatment of high risk acute leukaemia or myelodysplastic syndromes. Br J Haematol 2004; 124: 26-32. Deane M, Koh M, Foroni L, et al. FLAG-idarubicin and allogeneic stem cell transplantation for Ph-positive ALL beyond first remission. Bone Marrow Transplant 1998; 22: 1137-43. Davis BH, Holden JT, Bene MC, et al. 2006 Bethesda International Consensus recommendations on the flow cytometric analysis of hematolymphoid neoplasia: medical indications. Cytometry B Clin Cytom 2007; 72 Suppl 1: S5-13. Tromboprofilaxis: La Inyeccion o la Pastilla? José M. Ceresetto REVISIÓN Servicio de Hematología, Hospital Británico de Buenos Aires e-mail: [email protected] Fecha de recepción: 24/4/09 Fecha de aprobación: 30/5/09 RESUMEN La enfermedad tromboembólica venosa es la principal causa de muerte prevenible en pacientes internados y constituye un serio problema para el sistema de salud mundial. El uso de medicamentos de uso parenteral ha sido hasta hoy el patrón de oro para la profilaxis antitrombótica. Estas drogas actúan interfiriendo múltiples factores de coagulación y tienen limitaciones que los aleja del “agente antitrombótico ideal”. Existe una gran expectativa con la llegada de los nuevos agentes anticoagulantes directos orales. El dabigatran etexilato es un antitrombínico con eficacia y seguridad semejante a enoxaparina, pero con limitaciones por la necesidad de ajuste de dosis y falta de antídoto. El rivaroxaban es un antagonista del Factor Xa superior a las HBPM pero que tampoco tiene antídoto. Ambas drogas terminaron la etapa de investigación y están disponibles en Argentina. Entre sus ventajas nos brindan la posibilidad de comenzar la profilaxis en el postoperatorio, mayor seguridad por ser un producto sintético que no produce trombocitopenia, y evita la inyección subcutánea diaria. Entre sus limitaciones el alto costo y escasa experiencia clínica no nos permite definirlas aún como nuevo patrón de oro. Solo el tiempo nos dirá si la ventaja de ser un comprimido se traduce en nuestro medio en una mejor profilaxis anticoagulante. INTRODUCCION La Enfermedad Tromboembólica Venosa (ETV) es un problema mayor en la política de salud pública Internacional. Es la primera causa de muerte en pacientes internados y la tercera causa de muerte de origen cardiovascular. De hecho, es el problema clínico más importante en muchos subgrupos de pacientes: primera causa de reinternación en artro- HEMATOLOGIA, Vol. 13 Nº 2: 53-67 Mayo-Agosto 2009 plastía de cadera, primera causa de muerte en embarazo y en cirugías de vesícula y de hernia abdominal1. La Agencia Federal para la Investigación y Calidad en Salud en E.E.U.U. considera hoy al uso apropiado de la tromboprofilaxis como la más importante medida a tomar en una Institución para mejorar su “Calidad de Prestaciones”. Una de las características mas trascendentes de esta enfermedad es que por cada embolia pulmonar sintomática que diagnosticamos existen 2.5 casos más de tromboembolismo pulmonar (TEP) fatal que nunca logramos identificar, a tal punto, que entre el 40 y 60% de las muertes por TEP ocurren en pacientes sin diagnóstico de trombosis previa y el 20% comienzan su enfermedad como una muerte súbita por embolia pulmonar masiva2. Sólo para poner estos valores en contexto, la cantidad total de muertes hospitalarias por esta enfermedad reportada en Inglaterra supera al número total de muertes combinando las ocurridas por cáncer de mama, SIDA y accidentes de tránsito3. Por eso, la profilaxis antitrombótica es la única herramienta útil que tenemos para evitar estas muertes. Y por eso se plantean guías y consensos locales o internacionales para tratar de efectivizar la prevención en los pacientes de riesgo4. Sin embargo, pese a los esfuerzos de innumerables publicaciones y a la seriedad con que se trata este problema en la bibliografía internacional, la realidad nos muestra que todavía no hacemos una adecauda profilaxis. El estudio ENDORSE5 recientemente publicado, es un registro internacional sobre como se realizó la profilaxis de ETV en 68.000 pacien- 54 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 tes internados en hospitales de todo el mundo (incluidos 4 países de Latino América). Lamentablemente, muestra que apenas el 50% de los pacientes con indicación de profilaxis antitrombótica según las guías internacionales recibió una prevención adecuada. Es más, el 36% de los pacientes quirúrgicos y el 52% de los pacientes clínicos no recibieron ninguna profilaxis pese a tener un riesgo real de ETV. Con este panorama, cualquier esfuerzo que se haga para mejorar la adherencia a la profilaxis antitrombótica es válido. En este sentido, se han estudiado en los últimos años una variedad de nuevos agentes antitrombóticos que presentarían la ventaja de la administración por vía oral sobre la clásica profilaxis convencional de administración subcutánea. Y parece una verdad de Perogrullo, pero si le damos a elegir a un paciente entre una inyección y una pastilla, si ambos tienen la misma eficacia, optará sin dudar por un comprimido. Sin embargo, hay que tener en cuenta una serie de consideraciones al momento de elegir entre estas 2 formas de prevenir la enfermedad tromboembólica venosa. Los nuevos anticoagulantes orales son agentes sintéticos de muy bajo peso molecular que bloquean en forma específica un factor determinado de la coagulación. Son drogas con una farmacocinética predecible, con rápido comienzo de acción, que no requieren monitoreo con pruebas de laboratorio de coagulación y que se pueden usar en una dosis fija independientemente del peso del paciente. Además, por su amplia ventana terapéutica, se propone que serían más confiables y seguros que los otros antitrombóticos tradicionales6. VENTAJAS y DESVENTAJAS DE LA PROFILAXIS ANTITROMBOTICA ORAL Existen tres tipos de drogas que se han evaluado para la profilaxis antitrombótica con vía de administración oral: 1) Los clásicos Antagonistas de la Vitamina K (AVK) o dicumarínicos 2) Los Antitrombínicos como el Dabigatran Etexilato 3) Los antagonistas del Factor Xa como el Rivaroxaban y Apixaban Dos de ellas ya superaron la etapa final de la investigación clínica y se venderán en el mercado Argentino en este año, el dabigatran y el rivaroxaban. 1) Antagonistas de la Vitamina K Previamente llamados “anticoagulantes orales”, actualmente esta definición no es correcta por compartirla con otros agentes antitrombóticos. Los dicumarínicos pueden usarse para la profilaxis anticoagulante en pacientes de alto riesgo tromboembólico. De hecho, en E.E.U.U. representan el 50% de las drogas utilizadas para profilaxis en cirugía de cadera y TABLA I.– El anticoagulante ideal: Nuevos anticoagulantes vs. anticoagulantes clásicos 1) Oral 2) Rápido comienzo acción 3) Rápida desactivación (24HS) 4) Dosis fija (tratamiento) 5) No monitoreo coagulación 6) Respuesta predecible 7) Amplia Ventana terapéutica 8) No Interferencia drogas/dieta 9) No monitoreo de plaquetas 10) No trombocitopenia inmune 11) Catabolismo extraterrenal 12) Antídoto 13) Bajo riesgo contaminación biológica 14) Bajo costo 15) Eficacia profilaxis alto riesgo Propiedades como agente antitrombótico ideal Nuevos agentes AVK HNF HBPM Sí Sí Sí Sí Sí Sí Sí Sí Sí Sí Algunos No Sí No Sí 80% Sí No No No No No No No Sí Sí Sí Sí Sí Sí Menor 47% No Sí Sí No No No No Sí No No Sí Sí No Sí No 40% No Sí Sí No Sí Sí Sí Sí No No No Sí No No Sí 53% TROMBOPROFILAXIS NUEVAS DROGAS rodilla4. Sin duda, los ortopedistas norteamericanos la prefieren porque la primera dosis se puede administrar luego de la cirugía y por su lento comienzo de acción (ya que tarda al menos 3 días en tener efecto anticoagulante). Incluso los AVK generan menos hematoma de la herida quirúrgica que las HBPM7. En cuanto al uso prolongado como profilaxis en reemplazo de cadera los AVK son sumamente efectivos con un número de pacientes necesarios de tratar para evitar un evento trombótico de 22, semejante a las HBPM8. La profilaxis extendida en reemplazo de cadera se ha estudiado en un trabajo comparando dicumarínicos vs HBPM9 y los resultados entre las dos drogas han sido equiparables con una incidencia de 2.3% eventos trombóticos sintomáticos con HBPM contra 3.3% con warfarina (p=0.3). Pero, el uso prolongado de AVK presentó un significativo aumento del sangrado mayor 5.5% vs 1.3% con HBPM (p=0.001)10. Los dicumarínicos tienen algunas desventajas como la necesidad de monitoreo estricto de coagulación para mantener el RIN entre 2 y 3, la interferencia con otros medicamentos y con la dieta y la prolongada vida media que complica la reversión en caso de requerir una nueva cirugía. Difícilmente encontremos un traumatólogo en nuestro medio que acepte comenzar con dosis terapéuticas de dicumarínicos en el mismo día de la intervención quirúrgica, especialmente si con su uso extendido existe un mayor riesgo de sangrado. Además el traslado del paciente para el monitoreo de coagulación suele ser engorroso en un período donde muchas veces no puede deambular por sus propios medios. En Argentina los antagonistas de la vitamina K no se utilizan en el postoperatorio inmediato para prevención de ETV. Sin embargo, esta droga tiene una virtud que no ha sido superada por ningún otro anticoagulante: es muy económica. El costo de un mes de profilaxis en pacientes de alto riesgo con las HBPM en muchos casos es muy elevado y los antagonistas de la vitamina K pueden perfectamente reemplazar a las heparinas luego del alta. Siendo la única alternativa económica aprobada por las guías internacionales para profilaxis de alto riesgo, debemos todavía tenerla en cuenta al momento de externar al paciente, especialmente si es la única que el paciente puede cumplir desde punto de vista económico. 2) Antitrombínicos directos de uso oral: DABIGATRAN ETEXILATO El dabigatran es el primero de los nuevos agentes antitrombóticos orales que llega a Argentina. Es 55 un inhibidor competitivo, selectivo y directo del Factor II activado de coagulación. Se administra como Dabigatran Etexilato, una prodroga oral que rápidamente se transforma en el organismo en la droga activa (dabigatran) mediante hidrólisis de esterasas de la sangre y del hígado6, 11. Ya se utiliza en Europa desde marzo del 2008 y en Argentina está disponible desde diciembre del 2008. El dabigatran es un antitrombínico directo y la trombina es la enzima final y la más importante en la cascada de coagulación. Un viejo axioma de la hemostasia dice que “sin trombina no hay trombo” por lo que con este tipo de drogas deberíamos tener asegurada la eficacia antitrombótica. La trombina actúa mediante diferentes mecanismos; por un lado regula la formación del coágulo de fibrina al amplificar su propia generación y activar sustratos que estabilizan al trombo. De este modo la trombina actúa como protrombótico no solo al transformar al fibrinógeno en fibrina sino también por un efecto de retroalimentación positiva que activa a los cofactores V y VIII para formar el complejo protrombinasa. También activa al factor XI que cumple un rol central en la amplificación de la cascada, activa al factor XIII, que es el estabilizador del coágulo de fibrina, y finalmente, libera TAFI, que modula al sistema fibrinolítico impidiendo la degradación prematura de la malla de fibrina. Por otro lado, la trombina es el más potente activador fisiológico de las plaquetas, y por lo tanto, es un fuerte inductor de la agregación plaquetaria. El dabigatran es capaz de inhibir a la trombina circulante pero también a la trombina ligada a la malla de fibrina lo que es más relevante fisiológicamente y le daría otra ventaja sobre los anticoagulantes clásicos. Sin embargo, todos los antitrombínicos también bloquean la activación de uno de los mecanismos de autocontrol de la hemostasia más importante que es el Sistema de la Proteína C Activada (PCA). El sistema de la PCA inhibe a los cofactores V y VIII y tiene una vida media prolongada en plasma. Por lo tanto el dabigatrán al bloquear esta vía de inhibición fisiológica tendría, en teoría, un efecto protrombótico. La trombina cumple además funciones no hemostáticas que pueden afectarse con un antitrombínico. Así, el efecto promotor sobre la respuesta inflamatoria al estimular la expresión de p-selectina en la célula endotelial, la adhesión de monocitos, la quemotaxis de los leucocitos y la liberación de citoquinas podrían alterarse con el uso crónico del dabigatran. También la trombina tiene una acción mitogénica directa sobre la proliferación de fibroblastos y células de músculo liso. Todos es- 56 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 tos efectos potenciales, que se perderían por la inhibición crónica de la trombina, no han sido todavía suficientemente evaluados. Sin embargo existen innumerables estudios que relacionan a la trombosis con la inflamación por lo que tener un efecto extra anti-inflamatório crónico podría potencialmente ser una ventaja para un medicamento anticoagulante6, 12. En la práctica este nuevo agente antitrombínico cuenta con algunos antecesores que ya han demostrado ser efectivos en la profilaxis de trombosis venosa. La hirudina en la década del ochenta fue 50% más efectiva que las HBPM en profilaxis de artroplastía de rodilla. Y el Ximelagatran, otro antitrombínico oral directo pariente del dabigatran, fue tan efectivo como la enoxaparina en prevenir eventos tromboembólicos en cirugía ortopédica mayor. Lamentablemente ambas drogas, una por costo y vía de administración y la otra por hepatotoxicidad, nunca lograron un lugar en la profilaxis de ETV12. Los estudios de profilaxis con dabigatran han incluido más de 10.000 pacientes evaluados en el postoperatorio de cirugía de reemplazo total de cadera y rodilla. El estudio RE-MODEL14 se realizó en 2.076 pacientes con cirugía programada de reemplazo de rodilla. Este estudio de no inferioridad comparó al dabigatran etexilato en dosis de 150 y 220 mg/ día por 10 días contra enoxaparina 40 mg/día, según el régimen habitual desde 12 hs previo a la intervención quirúrgica. La 1° dosis de dabigatran se administró al 50% de la dosis (75 o 110 mg) entre 1 y 4 hs luego de terminada la cirugía. Luego la dosis habi- tual es de 220 mg/día (dos comprimidos de 110 mg juntos). Solo los pacientes con insuficiencia renal moderada o los mayores a 75 años deben recibir la dosis menor de 150 mg/ día (dos comprimidos de 75 mg juntos). Los resultados mostraron una eficacia y seguridad equiparable entre enoxaparina y dabigatran y entre las dos dosis de dabigatran de 150 y 220 mg (Tabla II). La incidencia de TVP sintomática fue menor en el grupo dabigatran (0.15% vs 1.25% en el grupo enoxaparina p=0.03). Incluso los eventos denominados mayores (TVP proximal + TEP no fatal + muerte vascular) fueron 3.5% con enoxaparina y 2.6% con dabigatran, pero esto no alcanzó una diferencia significativa. Y el porcentaje de pacientes con alteraciones en el hepatograma fue menor en el grupo que recibió dabigatran. En el estudio RE-NOVATE15 de cirugía de reemplazo de cadera en 3.494 pacientes se comparó el mismo régimen de Dabigatran etexilato contra enoxaparina 40 mg/día por un mes y los resultados nuevamente fueron semejantes en eficacia y seguridad con lo que se pudo demostrar la no inferioridad de esta droga (Tabla III). Con un mes de profilaxis no hubo diferencias en el hepatograma entre los dos grupos. Un tercer estudio utilizando el esquema de profilaxis Americano comparó enoxaparina 30 mg cada 12 horas contra dabigatran 150/220 mg/día en cirugía de reemplazo de rodilla. Este estudio denominado RE-MOBILIZE comenzaba la primera dosis de HBPM y de dabigatran al día siguiente de la cirugía (1° do- TABLA II Enoxaparina ETV total / muerte ETV mayor ETV sintomática Sangrado mayor Eventos coronarios n: n: n: n: n: 193/512 (37.7%) 18/511 (3.5%) 9/685 (1.3%) 10/679 (1.3%) 6 Dabigatran 220 mg n: n: n: n: n: 83/503 13/506 1/675 9/703 3 (36.4%) (2.6%) (0.1%) (1.5%) Dabigatran 150 mg n: n: n: n: n: p 213/526 (40.5%) 20/527 (3.8%) 2/696 (0.5%) 9/694 (1.3%) 8 NS NS NS NS NS Dabigatran 150 mg p TABLA III Enoxaparina ETV total y muerte ETV mayor ETV sintomática Sangrado mayor Eventos coronarios n: n: n: n: n: 60/897 36/917 4 18/1154 12 (6.7%) (3.9%) (0.4%) (1.6%) Dabigatran 220 mg n: n: n: n: n: 53/880 (6%) 28/909 (3.1%) 9 (0.9%) 23/1146 (2%) 5 n: n: n: n: n: 75/874 38/888 10 15/1163 8 (8.6%) (4.3%) (0.9%) (1.3%) NS NS NS NS NS TROMBOPROFILAXIS NUEVAS DROGAS sis 12 hs post cirugía). La eficacia del dabigatran fue inferior a la enoxaparina (33% vs 25%) en la evaluación venográfica a 10 días de la cirugía. Con estos resultados la sugerencia sería comenzar el dabigatran cercano a la cirugía (y no al día siguiente) ya que si retrasamos la primera dosis termina siendo menos efectivo que las HBPM. Ventajas y dificultades del dabigatran etexilato Es el primer anticoagulante oral que no requiere monitoreo de coagulación en el mercado Argentino. Es un péptido mimético selectivo, sintético, que no tiene riesgo de contaminación biológica. Solo actúa sobre la trombina y no inhibe a otras serino-proteasas. Se administra en una dosis fija oral en forma independiente del peso, una vez por día y de comienzo postoperatorio. Esto probablemente sea muy importante para muchos traumatólogos que ven que se puede operar “sin efecto del anticoagulante en la sangre”. Posee una amplia ventana terapéutica lo que la hace una droga segura. Además no parece producir alteraciones en las enzimas hepáticas en más de 38.000 pacientes evaluados, lo que permite no realizar monitoreo hepático. No existen pruebas de coagulación diseñadas hasta ahora para evaluar el efecto del dabigatran en sangre. El dabigatran en dosis de profilaxis antitrombotica puede prolongar levemente el aPTT y el tiempo de protrombina (especialmente en pacientes con sangrado) pero estas pruebas son poco sensibles y no debemos considerarlas para definir la conducta médica. Posiblemente una prueba sencilla y sensible a la actividad antitrombínica en la sangre es el tiempo de trombina que estará extremadamente prolongado, pero no existe correlación entre el valor del tiempo de trombina y la potencia del dabigatran. Esta droga probablemente será especialmente útil para la profilaxis antitrombótica prolongada en el domicilio16: - Evita la inyección subcutánea de las HBPM por 30 días (tengamos en cuenta que hay pacientes que le tienen especial aversión a las agujas). - Evita el costo adicional de tener que pagar a una enfermera la aplicación subcutánea de la heparina, ya que muchos pacientes no se animan a auto inyectarse. - Evito el hematoma en el sitio de punción subcutánea (frecuente con las HBPM), que si bien sólo es un problema estético, en muchos casos preocupa a los pacientes. También evita posibles reacciones 57 alérgicas cutáneas a la heparina, esporádicamente observadas. - No produce la mayor complicación que tienen las heparinas: la trombocitopénia inmune inducida por heparina (Tipo II). Esta patología se presenta en 1 a 5 % de los pacientes que reciben heparina no fraccionada por más de una semana. Se produce por la formación de complejos inmunes entre el factor 4 plaquetario y la heparina, provocando una caída en el recuento de plaquetas. Para detectarla en el paciente que recibe heparina se requiere un monitoreo del recuento de plaquetas (al menos en 3 oportunidades: basal, a los 4 y 14 días del postoperatorio). La trombocitopénia inmune por heparina puede desencadenar un evento trombótico (venoso o arterial) en hasta el 75% de los casos, con una mortalidad de 20%. Con las HBPM la incidencia de plaquetopénia secundaria a heparina es menor pero también ocurre. El dabigatran por el contrario no produce este fenómeno inmune. Hasta el momento, con los estudios RE-MODEL y RE-NOVATE aprobados, solo está permitido usar al dabigatran en profilaxis de reemplazo de cadera por 35 días y en reemplazo de rodilla por 10 días. Sin embargo existen otras indicaciones en donde esta droga podría ser de utilidad para la profilaxis antitrom-bótica prolongada si utilizamos nuestro criterio médico. Estas indicaciones aún no aprobadas deben considerarse con máximo cuidado y en forma individual, pero en algunas oportunidades podrían ser de gran ayuda para nuestros pacientes. Por ejemplo en la fractura de cadera, otra patología con muy alto riesgo de ETV y que debe recibir la profilaxis por un mes. También si consideramos las recientes recomendaciones del Consenso Internacional ACCP 2008 (4) deberíamos en artroplastía de rodilla, extender la profilaxis a 30 días (sugerencia nivel 2A) y lo mismo en la cirugía abdominopelviana mayor por cáncer (17). Dificultades del dabigatran en profilaxis antitrombótica: 1) La primera dosis de la droga es muy temprana en el postoperatorio. (en los estudios se administró en promedio 3.5 horas luego de la cirugía). Es probable que como el paciente aún se está recuperando de la anestesia general difícilmente tolere un comprimido por boca. Por el contrario si recibe anestesia raquídea podrá tolerarlo mejor. En el caso de que el paciente tenga un vomito hasta en los 30 minutos posteriores a la ingesta del dabigatran hay que repetir la toma. Si el drenaje quirúrgico tiene un débito 58 hemático mayor al habitual se debe posponer la primera dosis de profilaxis hasta el día siguiente. 2) Esta droga se elimina en un 85% por vía renal y sin cambios. Siendo que el dabigatran aumenta su concentración en sangre 2.7 veces en pacientes con insuficiencia renal moderada (clearence de creatinina menor a 50 ml/minuto) se ha indicado en esta población una dosis menor: 150 mg/día (18). Justamente por esto, para definir la dosis mayor (220 mg/d) o menor (150 mg/d) en profilaxis, se necesita el valor de creatinina del paciente y hacer un cálculo según la fórmula de Cockcroft y así saber si el clearence de creatinina es menor a 50 ml/minuto. El traumatólogo, que es quién en muchos casos realizará la indicación de profilaxis, no suele pedir en el prequirúrgico el valor de creatinina basal, probablemente tampoco tenga presente la fórmula de Cockcroft y de hecho ni siquiera se planteará el problema. Simplemente indicará la dosis convencional de 220 mg /día del dabigatran. Sin embargo esto podría resultar en una seria dificultad si existe la posibilidad de que aumente el sangrado por administrar una dosis excesiva. Puede ser que incluso la incidencia de sangrado sea mayor a la que se presenta en los estudios, ya que los pacientes de protocolo están muy seleccionados y no siempre se asemejan al contexto clínico habitual. Por ejemplo una paciente clásica propuesta para una cirugía de reemplazo de cadera sería una señora de 70 años, que pesa 60 kg y cuya creatinina es de 1.2 mg %. Esta paciente tiene un clearence de creatinina de 40 ml/minuto y no puede recibir la dosis convencional de 220 mg/ día. ¿Cuántos de ustedes hubieran sospechado esto? Por otro lado la vida media del dabigatran pasa de 11 horas en personas jóvenes a 14-17 horas en ancianos (18) y esto también es por la menor depuración renal. Así se explicaría porqué se ajustó la dosis a 150 mg/día en todos los pacientes mayores a 75 años. 3) El dabigatran al igual que los anti Xa orales pasa la placenta y a la leche materna por lo que no se podrán usar en embarazo y lactancia. En cuanto a la interferencia medicamentosa por el momento no está autorizado su uso conjunto con el clopidogrel ni con la quinidina y en el caso de los pacientes que toman amiodarona se debe ajustar la dosis de dabigatran a 150 mg/día. 4) El dabigatran es un Antitrombínico oral directo y como toda “droga nueva” genera cierto recelo en la comunidad médica. Justamente hace 3 años otro Antitrombínico oral directo, el XIMELAGATRAN, HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 fue aprobado para su comercialización en Argentina luego de más de 30.000 pacientes evaluados en diferentes estudios y de la autorización para su venta por la Autoridad Reguladora de Medicamentos de Europa (EMEA). Pero con solo 3 meses en el mercado local, en febrero del 2006, debió ser retirado del mercado mundial por hepatotoxicidad severa (incluso se registraron 2 muertes relacionadas a la droga). Si bien el dabigatran es una droga diferente, que de hecho ni siquiera aumenta las enzimas hepáticas, siempre debemos realizar una adecuada fármaco-vigilancia sobre estos agentes recién llagados por su potencial toxicidad13. 5) A pesar de que está protegido por la ley de patentes en Argentina el dabigatran es una molécula pequeña de síntesis química y posiblemente muy fácil de reproducir, con lo que habrá que estar atentos a la potencial aparición de copias en un país donde ya tenemos 4 copias de la enoxaparina autorizados por el ANMAT. 6) En el caso de que un paciente que recibe dabigatran presente un sangrado clínicamente significativo debe suspender de inmediato la administración de la droga (tarda 24 horas en perder su acción anticoagulante). Dado que se elimina por riñón, se debe hiperhidratar al paciente para forzar diuresis y como solo se une un 30% a las proteínas del plasma, hasta es posible ultrafiltrarlo para deshacernos más rápidamente de la droga. No tiene antídoto, por lo que eventualmente ante un sangrado crítico se podría usar concentrado de factores protrombínicos activados o concentrado de FVII activado recombinante (rFVIIa) , pero con un costo muy alto. 7) El precio de la tromboprofilaxis sigue siendo inalcanzable para la mayoría de los pacientes en Argentina. La experiencia lamentablemente nos ha enseñado que muchas veces ni se le menciona al paciente el costo de la profilaxis, y que luego del alta, ante un costo inesperado, los pacientes abandonan la profilaxis. Una posible solución para este problema es que el paciente se externe con un sistema de internación domiciliaria, donde la cobertura de la medicación es completa, pero esto solo ocurre en un determinado segmento de la población. La conclusión de los estudios con el dabigatran etexilato hasta la fecha en profilaxis antitrombotica es que es una alternativa a las HBPM bien tolerada para la prevención de enfermedad tromboembolica venosa luego de un reemplazo total de rodilla o cadera. Se trata de un nuevo agente antitrombótico que tiene la ventaja de ser un comprimido, lo que indu- TROMBOPROFILAXIS NUEVAS DROGAS dablemente reducirá los costos hospitalarios y mejorará la adherencia a la profilaxis prolongada, simplemente por evitar la administración subcutánea de las heparinas. El clearence renal y la dosificación de la droga no son problemas menores. Tanto los pacientes con edad mayor a 75 años, como con un clearence calculado de creatinina menor a 50 ml/minuto deben ajustar la dosis de dabigatran de 220 mg/día a 150 mg/día. Por lo que es posible que en pacientes en los que no se consideró este cambio de dosis tengamos un mayor riesgo de sangrado, justamente con una droga que carece de antídoto. Dado que en los estudios realizados no se consigue una mayor eficacia antitrombótica con la dosis de 220 mg/día versus 150 mg/día, una alternativa posible sería indicar la dosis menor a todos los pacientes y así priorizar la seguridad. RIVAROXABAN Es un inhibidor oral directo del Factor Xa que ya ha sido aprobado para profilaxis antitrombótica en Canadá, Chile, Inglaterra y Alemania y probablemente esté disponible en Argentina para la primera mitad del 2009. Tiene un único efecto en la hemostasia al inhibir en forma competitiva y reversible al factor X activado ya sea libre o, como es mas importante a nivel fisiológico, unido al complejo protrombinasa y a la fibrina. Este pequeño péptido, de apenas 436 Daltons de peso molecular, actúa en un paso temprano de la formación del trombo. Por lo tanto por cada molécula de factor Xa que se inhibe se calcula que se evita la formación de 1000 moléculas de trombina. Por otro lado el rivaroxaban, al no bloquear en forma directa a la trombina, permite que queden circulando trazas de trombina y, al no inactivar a las plaquetas, mantiene indemne la hemostasia primaria. Estos dos elementos, en teoría, le darían un mejor perfil de seguridad que los agentes antitrombínicos directos. Tiene un catabolismo mixto hepático y renal y solo está contraindicado si el paciente presenta una falla renal severa (clearence de creatinina < 15 ml/minuto) o en pacientes con falla hepática severa y coagulopatía asociada. Esta droga pasa a la leche materna y atraviesa la barrera placentaria por lo que también está contraindicada en embarazo y lactancia. El rivaroxaban tiene además una alta biodisponibilidad (80%) por vía oral y una amplia ventana terapéutica. Por interferencia en su catabolismo con inhibidores potentes del Citocromo CYP34A no pue- 59 de usarse con algunos antiretrovirales como el ritonavir o con antimicóticos azólicos como el ketoconazol ya que con estas drogas aumenta hasta 2.6 veces la concentración de rivaroxaban en sangre. Tampoco tiene antídoto con lo que en caso de un sangrado severo, al igual que con los antitrombínicos, debería usarse el concentrado de factores protrombínicos activados o rFVIIa. A diferencia del dabigatran el rivaroxaban por su elevada unión a las proteínas del plasma no es ultrafiltrable. No es necesario el monitoreo de la coagulación con pruebas de laboratorio, sin embargo, algunas pruebas podrían ser útiles para evaluar al rivaroxaban en situaciones clínicas especiales como ante el deterioro de la función renal o ante una hemorragia. Tanto el tiempo de Protrombina (TP) como el TP diluido se pueden prolongar con esta droga pero todavía no hay estudios que correlacionen estas pruebas de hemostasia con un mayor riesgo de sangrados11, 12, 19. Para la profilaxis antitrombótica el uso de cateter para analgesia epidural está permitido, pero no se debe remover el cateter hasta pasadas 18 horas de la última dosis de rivaroxaban y la dosis siguiente de la droga no debe darse antes de 6 horas de retirado el cateter. Se han reportado 9 casos donde hubo incremento de enzimas hepáticas combinado con aumento de bilirrubina sobre más de 6.000 pacientes tratados con esta nueva droga. Siete de estos casos estuvieron posiblemente relacionados con el rivaroxaban según un panel de expertos del estudio. Sin embargo por la baja frecuencia de hepatotoxicidad las autoridades sanitarias no han recomendado el monitoreo de la función hepática en la profilaxis antitrombótica. Los estudios de fase III en profilaxis antitrombótica para cirugía ortopédica mayor fueron cuatro (RECORD 1 al 4) y ya se han publicado20-23. La forma de administración del rivaroxaban fue en una sola dosis oral de 10 mg/día comenzando 6-8 horas luego de terminada la cirugía, independientemente del peso o la edad del paciente. En los 4 estudios RECORD se trataron más de 12.000 pacientes evaluados mediante venografía en donde se comparaba rivaroxaban con enoxaparina para artroplastía de cadera y rodilla. El estudio RECORD 120 comparó en 3.153 pacientes con cirugía de reemplazo de cadera enoxaparina 40 mg/día desde el día previo a la cirugía contra rivaroxaban por 5 semanas. Los resultados mostraron una reducción del objetivo primario de cualquier 60 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 trombosis y muerte de un 70% (3.7% con enoxaparina y 1.1% con rivaroxaban). Incluso los eventos tromboembólicos mayores (TVP proximal, TEP no fatal y muerte de origen vascular) fueron significativamente menores con la nueva droga: 2% con enoxaparina contra 0.2% con rivaroxaban. El RECORD 221 fue un estudio que comparó la profilaxis que habitualmente se realiza en muchos sitios de solo dos semanas con enoxaparina 40 mg/ día contra un mes de rivaroxaban en artroplastía de cadera. Se evaluaron 2.509 pacientes y lógicamente los eventos trombóticos se redujeron en forma muy significativa de 9.3% en la rama enoxaparina a 2% en la rama rivaroxaban. El estudio RECORD 322 se realizó en cirugía de reemplazo de rodilla en 2.531 pacientes que recibieron durante 15 días enoxaparina 40 mg/día desde el día previo a la cirugía o rivaroxaban 10 mg/día desde 8 horas luego de terminada la cirugía. Y los resultados también confirmaron la reducción de eventos trombóticos totales en un 49%, de 18.9% a 9.6% con rivaroxaban. Finalmente el RECORD 423 involucró a 3.148 pacientes con cirugía programada de reemplazo de rodilla y evaluados a los 14 días con una venografía. El régimen de profilaxis se ajustó al esquema Americano donde la enoxaparina comienza 12-24 horas luego de la cirugía pero a una dosis mayor de 30 mg cada 12 horas. El rivaroxaban se administró 8 horas post cirugía como en los otros estudios. Los resultados nuevamente mostraron una menor incidencia de trombosis en la rama de rivaroxaban 6.9% contra 10.1% en la rama enoxaparina. En un meta-análisis de estos 4 estudios publicado en el último Congreso Americano de Hematología (ASH 2008, abstract 36) los pacientes evaluados hasta la segunda semana del post operatorio mostraron una reducción del “endpoint” venográfico de 70% (similar al Fondaparinux y superior a la enoxaparina).Y la reducción total de eventos combinando los cuatro estudios fue de 42% con enoxaparina (ETV en la flebografía y/o trombosis sintomática o muerte) contra contra 19.6% del rivaroxaban. Sin embargo también logró reducir eventos con un alto significado Tabla IV. Meta análisis de 4 estudios con Rivaroxaban evaluados a 12 días de cirugía Rivaroxaban (n:6.183) ETV sintomática y muerte TEP y muerte Sangrado mayor S. clínicamente significativo Sangrado Total 0.8% 0.5% 0.4%(n: 24) 3.19% 7.02% Enoxaparina (n: 200) p 1.6% <0.001 0.8% 0.05 0.3% (n: 13) NS 2.55% NS 6.47% NS Tabla V. Comparación entre los nuevos anticoagulantes orales Nombre Laboratorio Nombre Comercial Prodroga Peso Molecular Efecto Vida media Pico acción Biodisponibilidad Catabolismo Lanzamiento Interferencia drogas Sangrado Profilaxis Ortopedia Dabigatran Rivaroxaban Apixaban Boehringer Ingelheim Pradaxa® Sí 628 Daltons Anti IIa directo 12-17 hs 2 hs 6% 80% renal 2008 Argentina Quinidina/Amiodarona Ultrafiltrable/rFVIIa aCCP 1° dosis 50% 1-4hs post Luego 150-220mg/d BAYER Xarelto® No 436 Daltons ANTI Xa directo 9 hs 3 hs 80 % 66% renal- 33% biliar 2009 Argentina CYP34A No ultrafiltrable/rFVIIa aCCP 1° dosis 6-8 hs post 10mg/d Bristol-Myers-Squibb ¿? No 460 Daltons ANTI Xa directo 9-14 hs 3 hs 50% 25% renal- múltiple 2010 -2011 ? CyP34A Ultrafiltrable/rFVIIa aCCP 1° dosis 12-24 hs post 2.5mg c/12 hs 61 TROMBOPROFILAXIS NUEVAS DROGAS clínico como la trombosis proximal, embolia de pulmón, trombosis sintomática y muerte por causa vascular. Por ejemplo la trombosis sintomática se redujo a las 2 semanas de 0.8% a 0.4% (50%) mientras que también se redujo la muerte y TEP sintomático (Tabla IV). Por otro lado, el sangrado fue ligeramente mayor para el rivaroxaban. El sangrado mayor fue 0.3% en la rama enoxaparina contra 0.4% el rivaroxaban, el sangrado de la herida fue 1.4% para enoxaparina y 1.8% para rivaroxaban y el sangrado clínicamente relevante fue de 3.19% con rivaroxaban y 2.55% con enoxaparina. La infección de la herida fue del 1% en ambos grupos. Si bien la definición de sangrado mayor en los 4 estudios RECORD no incluía el sangrado de la herida quirúrgica (con lo que la incidencia total de sangrado mayor fue notablemente menor que en cualquier otro protocolo de profilaxis antitrombótica), el sangrado de la herida y otros sangrados clínicamente significativos tampoco mostraron una diferencia significativa entre la rama de enoxaparina y la rama de rivaroxaban. En otro trabajo que reporta los resultados de los tres estudios RECORD que utilizaron enoxaparina según el régimen Europeo de 40 mg/día desde el día previo a la cirugía, la curva de Kaplan-Meier (figura 1) sobre la presencia de eventos sintomáticos o muerte se diferencia significativamente a favor del rivaroxaban desde la etapa de tratamiento24. Esta mayor eficacia clínica en eventos sintomáticos comparado con las HBPM parecería ser un punto de inflexión en la terapia de profilaxis antitrombótica. Sin embargo no hubo diferencia en la mortalidad entre las dos ramas de profilaxis y el número de pacientes que es necesario tratar (NNT) con rivaroxaban comparado con enoxaparina para evitar un evento trombótico sintomático es 230. Este valor asciende a 777 pacientes si queremos evitar un TEP sintomático. En definitiva el rivaroxaban es un nuevo anticoagulante oral sintético aprobado hasta el momento en profilaxis de cirugía de reemplazo articular de cadera y rodilla. Tiene la ventaja de la administración oral de comienzo postoperatorio en una dosis fija de 10 mg/día. No provoca trombocitopénia y tiene un mejor perfil para pacientes con insuficiencia renal moderada. Y es más eficiente que la enoxaparina en los estudios realizados25. Queda por demostrar si estos excelentes resultados obtenidos en los pacientes seleccionados de un protocolo se correlacionan con la práctica clínica habitual. Sin duda el costo de la droga y la falta de antídoto serán sus Fig. 1. La incidencia acumulada de ETV sintomática mas muerte en estudios RECORD 1, 2 y 3 versus enoxaparina 24. limitantes como lo son para todos estos nuevos anticoagulantes. Y habrá que esperar los estudios de costo beneficio para definir la verdadera efectividad del rivaroxaban. APIXABAN Es otro agente antagonista del Factor Xa oral directo un poco mas atrasado en la investigación. Tiene características semejantes al rivaroxaban pero se elimina solo el 25% por riñón con lo que prácticamente no se acumula si el paciente tiene algún grado de insuficiencia renal. Los estudios publicados hasta la fecha (ADVANCE 1) en profilaxis de artroplastía de rodilla contra la enoxaparina se realizaron con la primera dosis de la droga según el régimen Americano al día siguiente de la cirugía y con una dosis mayor de enoxaparina de 30 mg cada 12 horas. La dosis de apixaban fue 2.5 mg cada 12 horas y también comenzó en la mañana siguiente de la cirugía. Y los resultados mostraron que con este régimen no se cumplió el objetivo de no inferioridad para la droga. Sin embargo la rama apixaban presentó una significativa reducción en la incidencia de sangrado mayor (2.88% vs 4.28%)12. En este momento están terminando los estudios de fase III denominados ADVANCE 2 y ADVANCE 3 para artroplastía de cadera y rodilla con el esquema Europeo de profilaxis antitrombótica (enoxaparina 40 mg/día desde el preoperatorio) y dando la primera dosis de apixaban 12 a 24 hs luego del cierre quirúrgico. 62 Fig. 2. Larga cadena de sacáridos con carga negativa que no juega ningún papel en la inhibición de trombina ni en la del Factor Xa. . VENTAJAS y DESVENTAJAS DE LA PROFILAXIS CON DROGAS DE USO PARENTERAL 1) Heparina no fraccionada Definitivamente la heparina fue la droga patrón para profilaxis antitrombótica desde su primera publicación en la década del 70, por el profesor V.V. Kakkar 26. En aquel momento ya se demostró que usando heparina 5.000 UI subcutánea cada 12 horas se salvan 7 vidas por cada 1.000 pacientes operados, un número difícil de reproducir aún hoy. La heparina en dosis de profilaxis se elimina del organismo por vía extrarrenal y tiene un antídoto, la protamina, capaz de bloquear al 100% su efecto anticoagulante27. Tiene además otra ventaja: su costo es sumamente accesible. De hecho todavía sigue siendo la profilaxis de elección en un gran número de pacientes con riesgo moderado y alto de ETV. Sin embargo una pobre biodisponibilidad, de apenas el 30% y su enorme carga negativa (por ser una cadena de mucopolisacáridos rica en sulfatos) hace que pierda eficacia y tenga defectos que la han alejado de ser la droga ideal para profilaxis de trombosis venosa de alto riesgo. A tal punto que las guías de consenso internacional sobre profilaxis antitrombótica HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 ya desde el año 2001 recomiendan “en contra” del uso de la heparina no fraccionada en pacientes de muy alto riesgo de trombosis venosa4. Incluso la heparina en dosis ajustada con el aPTT fue 48% menos efectiva para la prevención de trombosis proximal comparado con la heparina de bajo peso molecular (HBPM) en artroplastía de cadera 28 con lo que esta alternativa también quedó abandonada. Cadena de sacáridos con carga negativa que no juega ningún papel en la inhibición de trombina ni en la del Factor Xa. ¿Cuáles son estos problemas de la heparina que la hacen poco eficiente en profilaxis? 1) Unión a proteínas del plasma y a elementos celulares que “distrae” su efecto antitrombótico. Esto, junto con la incapacidad para inhibir trombina cuando está ligada a la fibrina, posiblemente determina una menor efectividad antitrombótica en pacientes de muy alto riesgo. 2) Es captada por los macrófagos del sistema retículo endotelial provocando una rápida desaparición de la sangre, con una vida media corta, que obliga a usar 3 dosis diarias en profilaxis de alto riesgo. 3) Unión al factor plaquetario 4 con inhibición “in situ” de la heparina y formación de complejos heparina-F4 plaquetario que pueden desencadenar autoanticuerpos y finalmente trombocitopenia inmune tipo II. 4) Riesgo de contaminación biológica como ocurrió con la hipersulfatación de un lote de heparina que llegó desde China hace un año. Esta heparina contaminada desencadenaba una brusca liberación de bradiquininas y un shock vasopléjico que resultó fatal en muchos casos29. Incluso las HBPM debieron retirarse transitoriamente del mercado por este lote contaminado. 5) Unión a Factor Von Willebrand y alteración de la función plaquetaria que aumentaría el riesgo de sangrados. Larga cadena de sacáridos con carga negativa que no juega ningún papel en la inhibición de trombina ni en la del Factor Xa. Casi todas estas dificultades de la larga cadena de mucopolisacáridos, que constituye la heparina, desaparecen a medida que se acorta la cadena y con ello reduce su enorme carga negativa (figura 2). De esta forma si la fraccionamos, primero obtendremos las HBPM, luego las heparinas de ultra bajo peso molecular (HUBPM) y finalmente los pentasacáridos. Y todos estos derivados de la heparina tienen venta- 63 TROMBOPROFILAXIS NUEVAS DROGAS jas farmacológicas en la profilaxis antitrombótica si los comparamos con la droga madre. 2) Heparinas de bajo peso molecular En este momento son el patrón de oro para la profilaxis antitrombótica y la mejor recomendación para situaciones de muy alto riesgo: cirugía de reemplazo de rodilla y cadera, fractura de cadera, pacientes con trauma mayor sin riesgo de sangrado y pacientes pléjicos o con lesiones medulares agudas (4). En cuanto a sus ventajas, es un grupo de drogas con una vasta experiencia de manejo y múltiples publicaciones que esta en el mercado hace más de 20 años. Se administran como una sola inyección subcutánea por día y su presentación en jeringas prellenadas permite que en general muchos pacientes aprendan a autoinyectarse. Tiene una alta biodisponibilidad por lo que no requiere monitoreo de coagulación a través de ensayos de laboratorio. Debido a su menor peso molecular se relaciona menos con el factor plaquetario 4, produce menos trombocitopenia inmune y menos osteoporosis que la heparina no fraccionada. Tiene una forma de mo-nitoreo relativamente accesible al poder medir niveles de antiXa, especialmente en el grupo de pacientes obesos, con insuficiencia renal o en embarazadas. Además tiene un antídoto, la protamina, que bloquea todo el efecto antitrombínico y entre el 54 y 74% de la actividad antiXa, dependiendo de la mayor o menor carga de sulfato de la HBPM. Se puede usar en el embarazo, la lactancia y en pediatría y no produce hepatotoxicidad27, 30. En cuanto a sus desventajas, son varios los problemas que tenemos con las heparinas de bajo peso molecular: requieren una inyección subcutánea diaria por 30 días para profilaxis prolongada, el costo de la droga, el costo adicional de enfermería en algunos casos, la necesidad de monitoreo de plaquetas y el riesgo de trombocitopenia inmune. Pero hay 4 puntos especialmente delicados en la profilaxis de cirugía: 1) La dosis preoperatoria: En Argentina la administración de la profilaxis está aprobada para el esquema Europeo de alto riesgo que requiere una dosis 12 hs previa a la cirugía (mayor a 4000 UI anti Xa, Ej: 40 mg de enoxaparina o similar). Esto dice el ANMAT y es lo que deberíamos hacer. Sin embargo el paciente difícilmente se interna el día previo a la cirugía y el traumatólogo y/o anestesista que lo ve antes de la cirugía no tienen incorporada la rutina de indicar la profilaxis del día previo. Lo que ocurre en la práctica es que el paciente recibe la primera dosis, o a la mañana siguiente a la cirugía, o en el mejor de los casos recibe una dosis convencional luego de 6 – 8 horas de la cirugía. El problema es que para el postoperatorio inmediato la dosis de HBPM debiera ser el 50% de la dosis convencional de alto riesgo, tal como lo describiera originalmente Hull31 y como está aprobado en el consenso internacional del ACCP4. Incluso es posible que si utilizamos esta dosis completa (por ejemplo enoxaparina 40 mg luego de 6 horas post cirugía) tengamos una mayor incidencia de sangrados. Por lo tanto muchas veces hacemos MAL la profilaxis y esto nos expone eventualmente a una demanda judicial. 2) Anestesia raquídea y riesgo de hematoma espinal: la anestesia neuroaxial en la artroplastía de cadera y rodilla es una práctica habitual que se utiliza en el 60-80% de los pacientes operados. Tiene ventajas en la recuperación del paciente e incluso resulta menos trombogénica que la anestesia general. Las guías Americanas de Anestesia recomiendan una ventana de 18 horas desde la dosis de HBPM preoperatoria hasta la punción lumbar para la ciru- Tabla VI. Comparación entre las diferentes heparinas hasta el pentasacárido Laboratorio Dosis Peso Molecular Vida media Anti Xa/IIa Trombocitopénia Dosis preoperatoria Sangrado Costo Potencia RTR (flebo) Heparina Enoxaparina Bemiparina Octasacarido Pentasacarido 5000 UIc/8hs 15.000 D 2 hs 1:1 SI SI Mayor + 50% TVP Sanofi-Aventis 4000 UAXa/d 5000 D 3-4 hs 4:1 SI 1/3 menor SI Mínimo +++ 33% TVP ROVI 3500 UAXa/d 3500 D 5.3 hs 8:1 SI /menor NO Mínimo +++ 33% TVP Sanofi-Aventis 20 mg/d 2000 D 11-14 hs 30:1 ? NO ? ? 15% Fase II Glaxo 2.5 mg/d 1700 D 17-21 hs Anti X puro NO NO Mayor si < 6 h ++++ 12.5% 64 gía de alto riesgo tromboembólico. Y en la práctica para muchos anestesistas son 24 hs de ventana. Esto dificulta el esquema de la dosis preoperatoria y como el riesgo de hematoma espinal y paraplejía permanente existe (incluso el prospecto de la enoxaparina tiene un “black box warning” al respecto) no muchos anestesistas se arriesgarán a hacer una punción lumbar si el paciente recibió la dosis prequirúrgica de HBPM32. 3) La producción de HBPM es potencialmente vulnerable. El riesgo de contaminación biológica, pese a todas las precauciones en su síntesis, se puede ver con 2 ejemplos. Hasta hace unos años la fuente de la heparina era el pulmón bovino, sin embargo a partir de la epidemia Europea de la “vaca loca” y por temor a una contaminación con priones, se decidió pasar a una fuente alternativa más segura como el intestino de cerdo. Segundo ejemplo, aún más contundente. En el año 2008 se reportó la muerte de más de 200 pacientes luego del uso de heparina no fraccionada por shock vasogénico posiblemente ligado a la brusca activación del complemento y liberación masiva de bradiquininas. Se ha publicado que esta liberación de agentes vasodilatadores se debió a la contaminación de la heparina con residuos hipersulfatados de condroitin sulfato29. Además por tener una mayor carga negativa se reportó también una mayor incidencia de trombocitopenia inmune secundaria a la heparina no fraccionada. Esta contaminación obligó a retirar del mercado lotes enteros de heparina y en menor medida de heparinas de bajo peso molecular. El problema ya fue resuelto pero nadie nos asegura que no puede repetirse en el futuro. No nos olvidemos que la heparina es un producto biológico. 4) Si bien la enoxaparina ha demostrado su eficacia y seguridad en innumerables estudios clínicos, en Argentina ya tenemos 4 copias de la enoxaparina. A pesar de la aplicación en Europa de la ley de Bioequivalencias por la EMEA, en Argentina el ANMAT no ha tomado aún una determinación a este respecto, por lo que cualquiera de estos agentes esta autorizado para su uso en nuestro medio. Y al no tener estudios adecuados sobre la bioequivalencia no sabemos con certeza si realmente se trata del mismo producto, con la misma eficacia y seguridad, que la droga original33. 3) Heparinas de ultra bajo peso molecular (de segunda generación) Existe toda una línea nueva de investigación con estas moléculas ultrafragmentadas desde la heparina, HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 con propiedades diferentes a las HBPM que prácticamente las convierte en una droga diferente. La Bemiparina es la única heparina de bajo peso molecular denominada de segunda generación o de ultra bajo peso molecular que existe en el mercado. Debido a un procesamiento diferente se logra un mayor fraccionamiento de la molécula de heparina. Así consigue tener un peso molecular medio mas bajo: 3.600 Daltons (Ver tabla VI). Este “ultra bajo peso molecular” permite que tenga propiedades únicas frente a las otras heparinas como una vida media prolongada de 5.3 horas y una mayor relación de actividad anti Xa/anti IIa: 8:134. Es posible incluso, que por el menor peso molecular tenga una menor interacción con el factor plaquetario 4 y genere menos trombocitopenia inmune por heparina. Los estudios realizados con Bemiparina muestran una eficacia y tolerancia semejante a las HBPM pero con la posibilidad de dar la primer dosis 6 horas después de terminada la cirugía 35. Un trabajo que comparó 3.500 UI/día de Bemiparina con enoxaparina 40 mg/ día demostró que la incidencia de trombosis venográfica a 10 días fue semejante entre las dos drogas (32.1% bemiparina vs 36.9% enoxaparina)36. En otro estudio sobre 1.263 pacientes con cirugía de artroplastía de cadera o rodilla la incidencia total de sangrado mayor fue de 1.3%. En definitiva esta HUBPM tiene ciertas ventajas y desventajas: - Es la única HBPM autorizada por el ANMAT para comenzar la profilaxis en el postoperatorio. Esto soluciona el doble problema de tener que dar la dosis preoperatoria cuando el paciente no está internado y evito el riesgo de hematoma espinal por anestesia neuroaxial. - Tiene una mayor actividad anti Xa y parecería ser que esto les da una mayor potencia, aunque no tengamos estudios que lo confirmen. Además tiene una mayor vida media y posiblemente provoca menos trombocitopenia inmune. - Su inhibición por la protamina es posiblemente menor y podría acumularse en pacientes con insuficiencia renal con lo que debemos ser prudentes en este grupo de pacientes. - No está aprobada por la FDA y la cantidad de publicaciones y experiencia mundial con este tipo de heparina aún es escasa. Como grupo, las HUBPM ya se están evaluando en otros estudios, por ejemplo un octasacárido investigado por Sanofi-Aventis que posee un efecto anti Xa 30 veces mayor que el efecto antitrombínico y que se encuentra actualmente en Fase III de investigación (Estudios SAVE HIP, SAVE KNEE y SAVE ABDO). 65 TROMBOPROFILAXIS NUEVAS DROGAS 4) Fondaparinux Es un antagonista del factor X indirecto puesto que actúa por medio de la Antitrombina. De hecho este pentasacárido es la mínima molécula de heparina capaz de transformar a la Antitrombina en un potente inhibidor de la coagulación. Por el momento es uno de los pocos agentes que ha logrado mejores resultados que las HBPM en la profilaxis antitrombótica de alto riesgo: reduce 50% la incidencia de trombosis por venografía en pacientes sometidos a artroplastia de cadera y rodilla comparada con la enoxaparina. También, en otra indicación con alto riesgo tromboembólico como la cirugía abdominal por cáncer, reduce la trombosis venográfica en 40%. Es además un producto sintético que, por lo tanto, no puede contaminarse y al tener más de 80 pasos químicos para su síntesis la hace una molécula muy difícil de copiar. Tiene una vida media de 17 horas que se extiende a 21 horas en los ancianos y se elimina sin cambios por el riñón. No requiere monitoreo de plaquetas y no puede producir trombocitopenia inmune por heparina por su escasa afinidad por el factor plaquetario 4 (37). En la profilaxis de ETV se administra como una inyección de 2.5 mg subcutánea diaria de comienzo 6 horas post operatorio lo que nos evita los problemas de la primera dosis y de la anestesia raquídea. Como todos los nuevos agentes que se usan en profilaxis no tiene antídoto y en el caso de un sangrado grave relacionado al fondaparinux puede usarse rFVIIa, pero a un costo elevado. Para su uso el fondaparinux requiere de una función renal normal, ya que por su clearence renal tiende a acumularse cuando este es menor a 30 ml por minuto. Los estudios con fondaparinux se llevaron a cabo hace casi 10 años37, 38 y pese a tener unos resultados hasta ese momento insuperables, los expertos mundiales le dieron poco crédito a un estudio no clínico como la flebografía. En estos trabajos se redujo la trombosis total 50% por venografía en más de 7000 pacientes evaluados en cirugía de reemplazo o fractura de cadera o en reemplazo de rodilla. Incluso se redujo un 57% la trombosis proximal asintomática. Sin embargo no hubo ventajas en los eventos sintomáticos o clínicamente significativos. El problema fue que el sangrado mayor fue significativamente mas alto con el pentasacárido (2.3% versus 1.5% con enoxaparina) a pe- sar que un análisis “post hoc” demostró que si la primera dosis de profilaxis se da luego de 6 horas del cierre quirúrgico el riesgo de sangrado es equivalente al de la HBPM. De hecho, un estudio posterior (FLEXTRA) comparó un régimen de profilaxis con fondaparinux de comienzo al día siguiente de la cirugía de cadera versus comenzar 6 horas post cirugía. Y los resultados mostraron que con la misma eficacia se reducía el sangrado mayor en 42%. Esto permitió que el fondaparinux sea la única droga de profilaxis autorizada para comenzar “al día siguiente de la cirugía”4. Pese a que se trata de un agente antitrombótico excelente el fondaparinux no llenó las enormes expectativas que había generado en su lanzamiento mundial en el 2004. Con un costo en Argentina 50% mayor que las HBPM, no ha logrado desplazarlas como profilaxis habitual en nuestro medio. De todas formas posiblemente el fondaparinux tenga un lugar en pacientes con muy alto riesgo de tromboembolismo venoso, pacientes con antecedente de trombocito-penia inmune por heparina o cuando por alguna razón no se puede dar la profilaxis en el postoperatorio inmediato y debemos comenzar al día siguiente de la cirugía. CONCLUSION Las nuevas drogas anticoagulantes orales ya están aquí. Hoy con el dabigatran etexilato tenemos la posibilidad de brindar a nuestros pacientes una ventaja con alto impacto psicológico para la profilaxis antitrombótica extendida, como evitar la inyección subcutánea diaria. Pronto tendremos otro agente, el rivaroxaban, con estudios que incluso muestran una mayor eficacia antitrombótica que la droga patrón que usamos hasta el momento, las HBPM. Pero ninguno de ellos tiene antídoto y solo el tiempo nos dirá si la ventaja de ser un comprimido se traduce en una mejor profilaxis anticoagulante. Por el momento el alto costo de estos nuevos medicamentos no nos permite suponer que tendremos un mayor aprovechamiento que el actual para la prevención de la enfermedad tromboembólica venosa. Por eso, en algunas circunstancias, no nos quedará otra alternativa que reconsiderar a los “viejos” anticoagulantes orales. Siempre serán mejores que la aspirina en el grupo de pacientes de alto riesgo tromboembólico. 66 ABSTRACT Venous thromboembolism is the most common preventable cause of death among hospitalised patients and a serious health-care problem all around the world. Parenteral prophylaxis had been the gold standard until now but new antithrombotic oral agents are under investigation and will soon be available in Argentina. Dabigatran Etexilate is an oral antithrombinic with efficacy and safety similar to enoxaparin. It´s drawbacks are the need for dose adjustment and the absence of an antidote. Rivaroxaban is an oral, direct Factor Xa inhibitor that has been superior to enoxaparin in four prophylaxis trials but it also has no antidote. Both drugs are started after surgery, they don’t produce thrombocytopenia and avoid the subcutaneous injection. Their limitations are the high cost of the drug and the scarse clinical experience with these new agents. Only time will confirm that these better drugs result in a better DVT prophylaxis. Key words: Thromboprophylaxis. New anticoagulants. Oral vs parenteral. REFERENCIAS 1. White RH, Zhou H, Romano PS y col. Incidence of symptomatic venous thromboembolism after different elective or urgent surgical procedures. Thromb Hemost 2003; 90: 446-455. 2. Heit JA, O‘Fallon W, Pettersen T y col. Relative impact of risk factors for deep vein thrombosis and pulmonary embolism: a population based study. Arch Int Med 2002; 162: 1245-1248. 3. House of Commons Health Committee. The prevention of venous thromboembolism in Hospitalised patients. Available from www.parliament.UK/parliamentary_committees/ health_committee.cfm.2005 (consultado en abril 2009) 4. Geerts W, Bergqvist D, Pineo G y col. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-based clinical practice Guidelines (8th edition) Chest 2008; 133: 381S-453S. 5. Cohen AT, Tapson V, Bergman J y col. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational cross-sectional study. Lancet 2008; 371: 387-394. 6. Weitz J. Emerging anticoagulants for the treatment of venous thromboembolism. Thromb Hemost 2006; 96: 274-284. 7. Caprini J, Arcelus J y col: The influence of oral anticoagulation therapy on deep vein thrombosis rates four weeks after total hip replacement. J Vasc Surg 1999; 30: 813-820. 8. Prandoni P, Bruchi O y col. Prolonged thromboprophylaxis with oral anticoagulant after total hip arthroplasty: a prospective controlled clinical study. Arch Int Med 2002; 162: 1966-1971. 9. Samama CM, Vray M, Barre J y col. Extended venous thromboembolism prophylaxis after total hip replacement: a comparison of low-molecular-weight heparin with oral anticoagulant. Arch Int Med 2002; 162: 2191-2196. 10. Mismetti P, Laporte S, Zufferey P y col. Prevention of venous thromboembolism in orthopaedic surgery with vitamin K antagonists: a meta-analysis. J Thromb Hemost 2004; 2: 1058-1070. 11. Weitz J Hirsh J Samama M. New antithrombotic drugs: American College of Chest Physicians evidence based Clinical Practice Guidelines (8th edition) Chest 2008; 133: 234-256. HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 12. Bates Sh, Weitz J. The status of new anticoagulants. British J Haematol 2006; 134: 3-19. 13. Boudes P. The Challenges of new drugs benefits and risks analysis: Lessons from the ximelagatran FDA Cardiovascular Advisory Committee. Contemporary Clinical Trials 2006; 27: 432-440. 14. Eriksson B, Dahl O, Rosencher N y col. Oral dabigatran etexilate versus subcutaneas enoxaparin for the prevention of venous thromboembolism after total knee replacement. J Thromb Hemost 2007; 5: 2178-85. 15. Eriksson B, Dahl O, Rosencher N y col. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non inferiority trial. Lancet 2007; 370: 949-956. 16. Eriksson B, Quinlan D. Oral anticoagulants in development. Focus on thromboprophylaxis in patients undergoing orthopaedic surgery. Drugs 2006; 66: 1411-1429. 17. Bottaro F, Ceresetto JM Elizondo M. Efficacy of extended thrombo-prophylaxis in major abdominal surgery: What does the evidence show? Thromb Hemost 2008; 99: 1104-1111. 18. Stangier J. Pharmacokinetics and pharmacodynamics of the direct thrombin inhibitor dabigatran in elderly healthy sibjects. J Thromb Hemost 2005; 3 (suppl 1) P2207 19. Kubitza D, Becka M, Wensing G y col. Safety, pharmacodynamics, and pharmacokinetics of single doses of BAY 59-7939, an oral, direct factor Xa inhibitor. Clin Pharmacol Ther 2005; 78: 412-21. 20. Ericsson BI, Borris LC, Friedman R y col. Rivaroxaban versus enoxaparin for thromboprophylaxis alter hip arthroplasty. N Engl J Med 2008; 358: 2765-75. 21. Kakkar AK, Brenner B, Dahl O y col. Extendedduration Rivaroxaban versus short term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: double blind, randomised, controlled trial. Lancet 2008; 372: 31-39. 22. Lassen MI, Ageno W, Borris L y col. Rivaroxaban versus enoxaparin for thrombo prophylaxis after total knee arthroplasty. N Engl J Med 2008; 358: 2776-2786. 23. Turpie AG, Lassen MR, Davidson BL y col. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD 4): a randomised trial. Lancet 2009;16: 1673-1680. 24. Haas S. Rivaroxaban, an oral, direct Factor Xa Inhibitor: lessons from a broad clinical study programme. Eur J Haematol 2009; 82: 339-349. 25. Eikelboom J, Weitz J. Selective factor Xa inhibition for thromboprofilaxis. The Lancet 2008; 372: 6-8. 26. Kakkar VV, y col. Efficacy of low doses of heparin in prevention of deep-vein trombosis after major surgery. A double- blind randomised trial. Lancet 1975; 2: 45-51. 27. Jeske W, Messmore H Fareed J. Pharmacology of heparin and oral anticoagulants. Thrombosis and Hemorrhage. Loscalzo 1998 Chapter 55 Ed Williams – Wilkins. 28. Rocha E, Paramo JA, Rifon E y col. Profilaxis de tromboembolismo venoso. Clin Med Esp 1996, 1: 89-123. 29. Kishimoto TK, Viswanathan K, Ganeuly T y col. Contaminated heparin associated with adverse clinical events and activation of the contact system. N Engl J Med 2008; 358: 2457-2467. 30. Turpie A. State of the Art. A journey through the world of antithrombotic therapy. Sem Throm Hemost 2002; 28 (suppl 3): 3-11. TROMBOPROFILAXIS NUEVAS DROGAS 31. Hull RD, Pineo GF, Stein H y col. Timing of initial administration of low molecular weight heparin prophylaxis against deep vein thrombosis in patients following elective hip arthroplasty; a systematic review. Arch Int Med 2001; 161: 1952-1960. 32. O‘Shea S, Ortel T. Issues in the utilization of low molecular weigh heparins. Semin Hematol 2002; 39: 172-178. 33. Fareed J, Leong W, Hoppensteald D y col. Generic Low Molecular Weigh Heparins: some practical considerations. Sem Thromb Hemost 2004; 6: 703-713. 34. Planes A. Review of bemiparin sodium- a new second generation low molecular weight heparin and its applications in venous thromboembolism. Expert Opin Pharmacother 2003; 4: 1551-61. 67 35. Harenberg J. Emerging concepts in thromboprophylaxis. Pathophysiol Haemost Thromb 2002; 32: 398-400. 36. Navarro-Quillis A, Castellet E, Rocha E y col. Efficacy and safety of Bemiparin compared with enoxaparin in the prevention of venous thromboembolism after total knee arthroplasty. A randomized, doble blind clinical trial. J Thromb. Hemost 2003; 1: 425-432. 37. Turpie A, Eriksson B y col. New pentasaccharides for prophylaxis of deep vein thrombosis: Clinical Studies. Chest 2003; 124: 371S-78S. 38. Bauer K. Fondaparinux Sodium: The first selective Factor Xa Inhibitor. Clinical Pharmacokinetics 2002; 41: 1-49. 68 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 Diagnóstico y tratamiento de la flegmasia cerulea dolens Andrés Lázaro Brodsky1, Marcelo José Melero2, Carlos Darío Carbia1 1 División Hematología y 2Medicina Interna, Hospital de Clínicas José de San Martín, Universidad de Buenos Aires Dirección postal: Andrés L. Brodsky, Av. Córdoba 2351, 3er piso división Hematología, Sección Hemostasia 1120 Buenos Aires. e-mail: [email protected]. Fax: (5411) 5950-8754. Fecha de recepción: 29/5/09 Fecha de aprobación: 20/7/09 RESUMEN La flegmasia cerulea dolens (FCD) y la gangrena venosa (GV) constituyen una complicación grave y poco frecuente de la trombosis venosa profunda. Si la trombosis es masiva y bloquea completamente el retorno venoso del miembro afectado, se produce isquemia tisular (FCD). De persistir el trastorno circulatorio, el sufrimiento tisular progresa a la necrosis (GV) con pérdida del miembro y/o de la vida del paciente. El reconocimiento clínico precoz de la FCD (caracterizado por dolor extremo del miembro involucrado, edema masivo, eritema y cianosis) permite instituir de inmediato un tratamiento agresivo de desobstrucción venosa que puede salvar el miembro afectado. Sugerimos, además de las medidas de soporte local y general y anticoagulación intravenosa inmediata, la trombolisis química y mecánica endovascular como abordaje de elección, que suele permitir una repermeabilización venosa precoz, con resolución del cuadro clínico. De no ser factible, la fibrinolisis sistémica es la opción preferida para salvar el miembro, aunque la tasa de repermeabilización es menor. Las fasciotomías y la colocación de filtro en vena cava inferior están contraindicados. Palabras clave: trombosis venosa profunda, flegmasia cerulea dolens, gangrena venosa, trombofilia, filtro en vena cava inferior, trombolisis. DIAGNÓSTICO Y TRATAMIENTO DE LA FLEGMASIA CERULEA DOLENS La flegmasia cerulea dolens (FCD) como complicación isquémica y la gangrena venosa (GV) como evolución a necrosis tisular constituyen una complicación grave e infrecuente de la trombosis venosa profunda1. La fase isquémica (FCD) –potencialmente reversible– no suele ser diagnosticada ni tratada como una emergencia médica, lo que contribuye a su mal pronóstico, con evolución a gangrena y su consecuente morbimortalidad. ARTÍCULO ESPECIAL HEMATOLOGIA, Vol. 13 Nº 2: 68-72 Mayo-Agosto 2009 Dada la rareza de esta patología, no existen recomendaciones terapéuticas basadas en la evidencia médica. En esta revisión buscamos destacar y alentar un diagnóstico precoz y proponer estrategias terapéuticas adaptadas a diferentes disponibilidades asistenciales. UNA PATOLOGÍA POCO RECONOCIDA “Una paciente de 72 años fue derivada al Hospital de Clínicas, procedente de otro instituto universitario, por una trombosis venosa profunda (TVP) íleofemoral derecha, para colocación de filtro en VCI. Presentaba como antecedentes una metaplasia mieloide agnogénica con mielofibrosis de larga evolución e hidronefrosis por cálculos renales bilaterales con insuficiencia renal aguda que motivó su internación. Como consecuencia de la profilaxis antitrombótica desarrolló una trombocitopenia inducida por heparina (HIT) con TVP. Al ingreso la paciente presentaba un miembro inferior edematoso, eritematoso y con dolor de reposo difuso de intensidad extrema, que obligó al uso de opiáceos, sin ser interpretada como FCD…” Cuando la TVP es oclusiva, suele ser sintomática y presentarse con edema, cianosis y/o eritema y dolor localizado en el trayecto venoso comprometido, originado por la inflamación de la pared venosa con trombosis. En la FCD, a diferencia de la TVP convencional, el bloqueo del retorno venoso es masivo y completo. El aumento de la presión venocapilar hace desaparecer 2 gradientes de presiones: 1º el de arteriolas-capilares-vénulas que mantiene la perfusión de los tejidos y 2º el gradiente intersticio-extremo venular del lecho capilar que permite el drenaje del líquido extracelular. Las consecuencias son 1º la isquemia FLEGMASIA CERULEA DOLENS tisular por detención del flujo capilar, 2º la aparición de edema masivo y 3º el aumento de la presión intersticial que genera el colapso arteriolar cuando se supera el valor crítico de cierre de las arteriolas1, lo que agrava aún más la isquemia tisular. El paciente presenta dolor intenso de reposo, extendido a todo el miembro involucrado, edema masivo de instalación brusca, eritema (por vasodilatación refleja por anoxia) y cianosis distal, que preanuncia la inminente necrosis tisular2. La Flegmasia Cerulea Dolens es a la Gangrena Venosa lo que el Angor Prolongado es al Infarto Agudo de Miocardio. Los factores predisponentes más frecuentes son las trombofilias adquiridas (enfermedades malignas3, HIT4, 5, síndrome antifosfolipídico6) y más raramente las congénitas. Los factores precipitantes (que desencadenan y/o agravan la TVP inicial) son la inmovilidad prolongada, la inserción de filtros en vena cava inferior7,8 y el inicio de la anticoagulación con dicumarínicos4, 9,10. 69 Fig. 1.– El edema y cambio de coloración del miembro izquierdo de la paciente Nº 2 son evidentes. Se destaca la presencia de pequeñas áreas oscuras alrededor del dedo gordo, correspondientes a áreas de gangrena venosa inicial. UNA URGENCIA MÉDICA DE GRAVES CONSECUENCIAS “…Tras colocación del filtro en VCI y de un catéter de hemodiálisis, la paciente presentó necrosis masiva de miembro inferior derecho con acidosis metabólica fatal sin poder ser compensada con hemodiálisis ni bicarbonato i.v., lo que impidió el tratamiento fibrinolítico sistémico indicado”. La FCD librada a su evolución progresa rápidamente (en horas) con necrosis progresiva de los tejidos afectados (GV), compromiso hemodinámico –por el gran edema y el empleo de opiáceos– y alteraciones metabólicas (acidosis láctica). No sólo se encuentra amenazada la viabilidad del miembro, sino la vida del paciente. El diagnóstico requiere el reconocimiento de esta entidad, basado en la tríada clínica dolor insoportable de reposo no limitado al trayecto venoso + edema masivo + eritema con tinte cianótico. El eco doppler venoso muestra habitualmente la presencia de una trombosis extensa oclusiva total. En el presente caso no se debió haber insertado un filtro en VCI dado el estado trombofílico severo (por HIT + Sme. Mieloproliferativo). Se debería haber iniciado una desobstrucción venosa por cateterismo con trombolisis combinada mecánica y química o en su defecto una trombolisis sistémica y posterior tratamiento anticoagulante del HIT con 1 antitrombínico directo (no disponible en ese momento en la Argentina). “Una paciente de 60 años con diagnóstico de T.V.P. femoropoplítea izquierda fue tratada con Fig. 2.– Tomografía computada abdominal de la paciente Nº 2. Se destaca el engrosamiento difuso de la pared gástrica (flechas blancas) y las imágenes nodulares hipodensas múltiples en hígado (flechas negras) sugestivos de neoplasia gástrica avanzada heparina i.v. y luego con acenocumarol oral. Ingresa por aumento del edema, eritema y dolor lancinante de reposo en todo el miembro inferior y relleno capilar enlentecido bajo anticoagulación adecuada (R.I.N.: 2,21). Un ecodopler mostró conservación de la circulación arterial y trombosis venosa profunda oclusiva total íleo-femoral-poplítea-tibiales izquierda y suboclusiva fémoropoplítea derecha. Se diagnosticó una FCD y se efectuaron 2 propuestas terapéuticas: 1.fibrinolisis sistémica vs. 2.-fasciotomía descompresiva…” 70 HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 Tratamiento de la flegmasia cerulea dolens OBJETIVOS 1) Corregir la hipoperfusión sistémica y local - Soporte hemodinámico - Elevación del miembro afectado 2) Frenar la propagación del trombo y prevenir la embolia - Anticoagulación agresiva con heparina i.v. 3) Restaurar a la brevedad la circulación del miembro afectado - Tratamiento endovascular multimodal De no ser factible - Fibrinolisis regional por catéter intraarterial ó - Fibrinolisis sistémica De estar contraindicada - Evaluar trombectomía quirúrgica 4) Medidas Contraindicadas - Fasciotomías descompresivas - Colocación de Filtro en VCI - Tratamiento anticoagulante oral hasta resolución de la FCD - Anticoagulación por vía subcutánea Fig. 3.– Algoritmo terapéutico sugerido para la flegmasia cerulea dolens Ante la sospecha diagnóstica el tratamiento debe ser inmediato y agresivo, con un abordaje multidisciplinario. Las primeras medidas están orientadas a mejorar el estado hemodinámico del paciente (expansión con fluidos i.v. para corregir el shock/hipotensión arterial), reposo en cama con elevación importante (≥45°) del miembro afectado –para mejorar el retorno venoso–, y anticoagulación i.v. inmediata de alto rango11, 12, con dosis de heparina no fraccionada (HNF) superiores a las habituales (bolo de 10.000 U y dosis de mantenimiento para obtener valores de anti Xa > 0,6 U/mL) –rango terapéutico de anti Xa para HNF de 0,3 a 0,7 U antiXa/mL– para detener en forma inmediata la extensión del proceso trombótico. No es recomendable el empleo de heparina de bajo peso molecular ni de pentasacárido dados el requerimiento de un efecto anticoagulante inmediato (por ello el bolo i.v. de 10.000 U), la inestabilidad hemodinámica de estos paciente que puede alterar la función renal y/o la absorción subcutánea de fármacos y la frecuente necesidad de procedimientos invasivos (por ej. cateterismos) que requieren la reversión inmediata de la anticoagulación. De no haber mejoría del cuadro clínico en las 6 horas siguientes, y dada la gravedad de estos pacientes, lo ideal es poder emprender un tratamiento multimodal por vía endovascular, cateterizando el sistema venoso para abordar el trombo y efectuar fibrinolisis química local, administrando un goteo prolongado del fibrinolítico directamente dentro del trombo por el catéter (rtPA 1 a 2 mg/hora con o sin bolo inicial)13,14 + trombolisis mecánica con fragmentación y aspiración del trombo + angioplastia con balón y/o colocación de stent en los sitios de obstrucción venosa parcial residual15,16. La desobstrucción veloz del sistema venoso evita la necrosis tisular, alivia el dolor por isquemia venosa y quita al paciente de la situación de riesgo vital. En caso de no disponibilidad de un servicio de cirugía vascular que pueda afrontar dicho tratamiento, debe optarse por la fibrinolisis sistémica, como alternativa accesible para intentar desobstruir velozmente el sistema venoso (como ocurrió en el presente caso). “…Se administró estreptokinasa i.v. (500.000 U en bolo y luego infusión i.v. continua de 100.000 U/ hora). Tras una mejoría sintomática inicial en las primeras 12 hs., el dolor recidiva y se extiende al otro miembro. Simultáneamente la FCD progresa a GV en dedos del miembro inferior izquierdo (foto 1). Un nuevo ecodoppler venoso muestra progresión de la trombosis venosa derecha a una oclusión completa. La paciente presenta disnea súbita, constatándose 1 T.E.P. por aparición de defectos nuevos de perfusión en una 2° centellografía pulmonar respecto a una previa. Se le coloca un filtro en V.C.I. y se administran altas dosis de heparina i.v. La paciente mejora lentamente, delimitando las áreas de necrosis por gangrena venosa, con resolución paulatina del dolor y de los síntomas de obstrucción venosa. Una T.C. de abdomen (foto 2) muestra engrosamiento de la pared gástrica e imágenes nodulares hipodensas en hígado, sugestivas de metástasis de un cáncer gástrico, que no pudo ser confirmado mediante en-doscopía y biopsia. Es rotada luego a heparina de bajo peso molecular, tratamiento con el cual fue dada de alta”. La fibrinolisis sistémica, como nos ilustra el caso anterior, lisa el trombo en no más del 60% de los casos de TVP16. Pese a ello, permite salvar el miembro afectado en la mayoría de los pacientes18, 2, 19, probablemente al permeabilizar la circulación colateral por pequeñas venas18. Las dosis de fibrinolíticos sistémicos han sido muy variables en diferentes trabajos, pero las sugeridas son 100 mg de rtPA i.v. en 2 horas o estreptokinasa, 250.000 a 500.000 U en 30 a 60 minutos y luego en infusión continua de 100.000 U/hora por un lapso de 12 a 72 hs (según respuesta)20. Otras alternativas para desobstruir velozmente el sistema venoso son la fibrinolisis regional por catéter intraarterial21 o la trombectomía quirúrgica22,23 (con alto riesgo dado el estado crítico del paciente). La fasciotomía descompresiva no está indicada como terapéutica en la FCD. Las amputaciones y resecciones de tejidos necróticos deben ser tardías, cuando el daño se ha delimitado, con el objetivo de conservar tejidos y segmentos viables del miembro. 71 FLEGMASIA CERULEA DOLENS Tampoco está indicada la colocación de un filtro en V.C.I., dado el riesgo de progresión a GV y de obstrucción trombótica del filtro. Una excepción es con el tratamiento endovascular multimodal, donde algunos equipos de cirugía vascular colocan el filtro para prevenir embolias pulmonares asociadas al procedimiento. Finalmente la anticoagulación oral, dado que genera inicialmente un estado protrombótico por descenso precoz de la proteína C, puede desencadenar una FCD y/o precipitar la progresión a GV en estos pacientes24. Su inicio debe postergarse hasta que el paciente resuelva la FCD en forma completa y superponerse al empleo de anticoagulantes parenterales. damage evolves to necrosis, with limb and/or life loss. Early clinical recognition of PCD (characterized by excruciating pain, massive edema, erythema and cyanosis of involved limb) allows an immediate and aggressive limb saving treatment to restore venous outflow. We suggest –besides local and general support therapy and immediate intravenous anticoagulation of PCD– chemical and mechanical endovascular thrombolysis should be the first approach. This generally leads to a quick venous repermeabilization with clinical resolution. If endovascular thrombolysis is unavailable, systemic fibrinolysis seems the best option to save the limb, although patency rates are lower. In this setting, fasciotomies and vena cava filters are contraindicated. Key words: deep vein thrombosis, phlegmasia cerulea dolens, venous gangrene, thrombophilia, inferior vena cava filter, thrombolysis. CONCLUSIONES La FCD y la GV son manifestaciones sucesivas de una forma grave y poco frecuente de TVP. Constituyen una emergencia médica cuyo reconocimiento precoz puede salvar el miembro y aún la vida del paciente. Ocurren habitualmente en pacientes con trombofilias adquiridas (especialmente neoplasias y H.I.T). Su tratamiento es idealmente multidisciplinario e incluye medidas de soporte hemodinámico, cuidados locales, anticoagulación agresiva, y trombolisis química y/o mecánica (ver cuadro 1). El objetivo terapéutico es restablecer de inmediato, en la etapa de Flegmasia Cerulea Dolens, la circulación venosa, para evitar el infarto venoso de los territorios afectados con pérdida del miembro amenazado. Idealmente la trombolisis debe hacerse por vía venosa endovascular, combinando fibrinolíticos locales, trombolisis mecánica, angioplastia venosa y colocación de stents (abordaje multimodal) que permite una alta tasa de repermeabilizaciones (superior al 70-80%)5,25. En su defecto, creemos que la fibrinolisis regional por catéter intraarterial es la opción preferible21. En caso de no disponerse de opciones endovasculares, la fibrinolisis sistémica es la terapéutica a indicar. Finalmente, en situaciones en que los fibrinolíticos estén contraindicados, puede considerarse efectuar una trombectomía quirúrgica con o sin trombolisis mecánica endovascular como último recurso para salvar el miembro amenazado 26. ABSTRACT Diagnosis and treatment of phlegmasia cerulea dolens. Phlegmasia cerulea dolens (PCD) and venous gangrene (VG) are infrequent and severe complications of deep vein trombosis. If thrombosis is massive, completely occluding the venous outflow of the affected limb, tissue ischemia ensues (PCD). With ongoing circulatory impairment, tissue BIBLIOGRAFÍA 1. Perkins JMT, Magee TR, Galland RB. Phlegmasia caerulea dolens and venous gangrene. Br J Surg. 1996; 83: 19-23. 2. Elliot MS, Immelan EJ, Jeffery P, et al. The role of thrombolytic therapy in the management of phlegmasia caerulea dolens. Br J Surg. 1979; 66: 422-4. 3. Yang M-H, Fan FS, Chen P-M, et al. Venous gangrene in a patient with adenocarcinoma of the lung. Jpn J Clin Oncol. 2000; 30 (6): 276-8. 4. Srinivasan AF, Rice L, Bartholomew JR et al.Warfarin-induced skin necrosis and venous limb gangrene in the setting of heparin-induced thrombocytopenia. Arch Intern Med. 2004; 164: 66-70. 5. Warkentin TE, Elavathil LJ, Hayward CEM, et al. The pa-thogenesis of venous limb gangrene associated with heparin-induced thrombocytopenia. Ann Intern Med. 1997; 127: 804-12. 6. Baethge BA, Payne, DK. Phlegmasia cerulea dolens associated with the lupus anticoagulant. West J Med.1991; 211-13. 7. Aruny JE, Kandarpa K. Phlegmasia caerulea dolens, a complication after placement of a bird’s nest vena cava filter. Am J Roentgenol. 1990; 154: 1105-6. 8. Shem K. Phlegmasia cerulea dolens: rare complication of vena cava filter placement in man with paraplegia. J Spinal Cord Med. 2008; 31: 398-402. 9. Warkentin TE. Venous limb gangrene during warfarin treatment of cancer-associated deep venous thrombosis. Ann Intern Med. 2001; 135: 589-93. 10. Georgin S, Pouchot J, Raschilas F, Barete S, Lebret Lerolle D, Vinceneux P. Paradoxical venous limb gangrene complicating oral anticoagulation in a patient with cancer-associated deep venous thrombosis. Arch Dermatol. 2003; 139: 1126-8. 11. Hood BD, Weaver FA, Modrall JG, Yellin AE. Advances in the treatment of Phlegmasia cerulea dolens. Am J Surg. 1993; 166: 206-10. 12. Patel KR, Paidas CN. Phlegmasia cerulea dolens: the role of non-operative therapy. Cardiovasc Surg. 1993; 1 (5): 518-23. 13. Jackson LS, Wang XJ, Dudrick SJ et al. Catheter-directed thrombolysis and or thrombectomy with selective endovascular stenting as alternatives to systemic anticoagulation for treat-ment of acute deep vein thrombosis. Am J Surgery. 2005; 190: 864-68. 14. Sillesen H, Just S, Jorgensen M, et al. Catheter-directed thrombolysis for treatment of ilio-femoral deep vein thrombosis is durable, preserves venous valve function and may prevent 72 15. 16. 17. 18. 19. 20. HEMATOLOGIA ● Volumen 13 - Nº 2, 2009 chronic venous insufficiency. Eur J Vasc Endovasc Surg. 2005; 30: 556-62. Dayal R, Bernheim J, Clair DG, et al. Multimodal percutaneous intervention for critical venous occlusive disease. Ann Vasc Surg. 2005; 19: 235-40. Chaer RA, Dayal R, Lin SC, et al. Multimodal therapy for acute and chronic venous thrombotic and occlusive disease. Vasc Endovasc Surg. 2005; 39 (5): 375-80. Tapson V. Fibrinolytic (thrombolytic) therapy in pulmonary embolism and deep vein thrombosis. Up to Date. Febrero 2009. Schweizer J, Kirch W, Koch R, et al. Short- and long-term results after thrombolytic treatment of deep vein thrombosis. JACC. 2000; 36: 1336-43. Tardy B, Moulin N, Mismetti P, Decousus H, Laporte S. Intravenous thrombolytic therapy in patients with phlegmasia caerulea dolens. Haematologica. 2006; 91: 281-2. Paquet KJ, Popov S, Egli H. Richtlinien und ergebnisse der konsequenten fibrinolytischen therapie der phlegmasia caerulea dolens. Dtsch Med Wochenschr. 1970; 16: 903-4. 21. Wlodarczyk ZK, Gibson M, Dick R, Hamilton G. Low-dose intra-arterial thrombolysis in the treatment of phlegmasia caerulea dolens. Br J Surg. 1994; 81: 370-2. 22. Eklof B, Arfvidsson B, Kistner R, Masuda EM. Indication for surgical treatment of iliofemoral vein thrombosis. Hematol Oncol Clin North Am. 2000; 14 (2): 471-82. 23. Abid A, Denguir R, Kaouel K, et al. [Venous thrombectomy. Six case reports]. Tunis Med. 2003; 81 (1): 67-71. 24. Cahill RA, Redmond HP. Postoperative phlegmasia caerulea dolens: a case report and consideration of potential iatrogenic factors. J Med Case Reports. 2007; I:163-67. 25. Mewissen MW, Seabrook GR, Meissner MH, Cynamon J, Labropoulos N, Haughton SH. Catheter-directed thrombolysis for lower extremity deep venous thrombosis: report of a national multicenter registry. Radiology. 1999; 211 (1): 39-49. 26. Gociman B, Castillo-Sang M, Margni M, Almaroof B, Nazzal M. Successful treatment of phlegmasia cerulea dolens with combination surgical and catheter-assisted thrombectomy. Vascular. 2009; 17 (2): 108-11. 74 La Revista Hematología es el órgano oficial de difusión de la Sociedad Argentina de Hematología (SAH). En ella se publicarán trabajos relacionados con la especialidad, siempre que se ajusten a los requerimientos científicos y técnicos establecidos por el Comité Editor quien tendrá la facultad de aceptar o rechazar los trabajos enviados para la publicación. Se admitirá la publicación de trabajos de autores de habla no hispana en idioma inglés. Esta revista está constituida sobre la base de diversas secciones a desarrollar: 1) Editorial 2) Artículos originales 3) Actualizaciones y/o revisiones 4) Artículos especiales (compuestos por Comunicaciones breves, Ateneos Anatomoclínicos, Resolución de problemas clínicos, Reporte de casos) 5) Imágenes en Hematología 6) Correo de lectores 7) Información General (Comentarios de libros, revistas o material informativo, congresos, jornadas, información sobre las actividades de interés científico de la Sociedad). HEMATOLOGIA ● Volumen 10 - Nº 3, 2006 REGLAMENTO DE PUBLICACIONES HEMATOLOGIA, Vol. 13 Nº 2: 74-76 Mayo-Agosto, 2009 Las Editoriales serán solicitadas únicamente por el Comité Editor. Tendrán título y texto con características de monografía, en lo posible con una extensión no mayor de 2 páginas, con un máximo de 5 citas bibliográficas, figurando al final el nombre del autor, su dirección, código postal, TEL/FAX. Los Artículos originales deberán ser presentados por triplicado, impresos en papel tamaño A4, con fuentes tamaño 10, 70 caracteres por renglón, 25 líneas por página, numeradas en forma correlativa, incluyendo tablas y bibliografía. Deben ser originales e inéditos en el país. Se podrán publicar en este ítem aquellos trabajos que fueron presentados en reuniones de la SAH, así como también en Reuniones Nacionales o Internacionales. La evaluación del contenido científico será efectuada por dos o más árbitros seleccionados, quienes recibirán el trabajo, conservándose su anonimato. Los trabajos se desarrollarán según el siguiente ordenamiento: a) Título; b) Resúmenes (en hoja aparte); c) Introducción; d) Material y métodos; e) Resultados; f) Discusión; g) Bibliografía. Título: Deberá ser consignado con mayúsculas y sin abreviaturas, será breve y preciso. En renglón aparte se detallará la nómina de autores, separados por comas, comenzando por el primer nombre, iniciales de los segundos nombres y apellido completo. A continuación el nombre de la institución u hospital donde se realizó el trabajo, la dirección, TEL/FAX y el código postal del autor a quien dirigir la correspondencia. Resumen: Cada trabajo deberá presentar un resumen en castellano y otro en inglés (incluyendo título en dicho idioma) los cuales proporcionarán por sí mismos una idea concisa de cada uno de los puntos antes mencionados; y no deben ser más extensos de 200 palabras cada uno. Deberán consignarse 3 a 5 palabras clave en inglés y en castellano al pie del resumen utilizando términos del Medical Subjects Headings del Index Medicus. Introducción: Explicará los fundamentos y objetivos del trabajo Material y métodos: Detallará las características del material, la metodología empleada y el método estadístico utilizado. Resultados: Deberán estar expresados con claridad. Discusión: Analiza los resultados y los hechos que tengan relación directa con los mismos, las relaciones entre éstos y el objetivo inicialmente propuesto y su confrontación con los conocimientos establecidos previamente. Bibliografía: Sólo se incluirán las referencias que hayan sido consignadas en el artículo, ordenadas numéricamente en forma correlativa. Se hará figurar inicialmente la nómina de autores separados por comas, comenzando por el apellido, seguido por las iniciales de los nombres. Cuando el número de autores sea mayor de 6, se hará mención sólo a los primeros 3 seguidos de la sigla “y col.”; a continuación se consignará el título del trabajo seguido del nombre de la revista en forma abreviada, según lo establezca por el «Index Medicus»; año de publicación, punto y coma, número de Volumen dos puntos, página inicial, guión, página final. 75 REGLAMENTO DE PUBLICACIONES Ejemplo: Kaldor JM, Day EN, Clarke EA y col. Leukemia following Hodgkin’s disease. N Engl J Med 1990; 322: 7-13. Cuando se trate de libros se harán figurar el nombre del autor/es, título del capítulo, título del libro, editor/es, año de aparición, páginas separadas por guión, agregando el número de edición si no fuera la primera edición, editorial, y ciudad. Ejemplo: Hughes TP and Goldman JM. Chronic myeloid leukemia. Hematology: Basic Principles and Practice. R. Hoffman, EI Benz, SJ Shatill, B Furie y EJ Cohen 1991, p 854-869. Churchill Livingstone, Edinburgh Las ilustraciones correspondientes al trabajo como las radiografías, dibujos, registros, etc., deberán presentarse en forma de fotos en blanco y negro, con adecuado contraste, en tamaño de 9 x 12 cm o mayor, numeradas en forma correlativa al dorso, en caracteres arábigos. En hoja aparte se consignarán las leyendas o epígrafes correspondientes. Al dorso de cada fotografía deberá agregarse el nombre del primer autor y título del trabajo. Las tablas deberán presentarse en hojas individuales, confeccionadas en forma clara, numeradas en caracteres romanos y con un título. No se aceptarán tablas que ocupen un espacio mayor que el de una página de la Revista. Las abreviaturas y símbolos deberán estar especificados en el texto o al pie de las tablas. Las Actualizaciones y/o revisiones serán solicitadas por el Comité Editor. El título, autores, lugar donde se realizó, así como las tablas e ilustraciones guardarán las mismas formas que en los artículos originales. La sección de Artículos especiales estará compuesta por Ateneos Anatomoclínicos, Reporte de casos, Resolución de problemas clínicos y las Comunicaciones breves. Las comunicaciones de casos no deberán exceder de 3 páginas, con un máximo de 3 ilustraciones y de 4 autores. No deberán exceder de 8 citas. En el caso de los ateneos anatomoclínicos se procederá de la misma forma que en los artículos originales. Las Comunicaciones breves no deberán exceder 3 páginas de tamaño oficio mecanografiadas a doble espacio, incluyendo en las mismas texto, figuras, tablas y bibliografía. Se desarrollarán de la misma forma que en los artículos originales. Hasta doce citas bibliográficas. Imágenes en Hematología: estará constituido por material fotográfico en colores de excelente calidad destinado a exponer claramente temas de diversa índole, con especial objetivo docente. Ocuparán 1 página y se desarrollarán según el orden siguiente: Título, texto conciso, imagen, nombre del autor/es. Podrá agregarse 1 cita bibliográfica haciendo constar sólo el nombre de la revista y su identificación. En el Correo de lectores se publicarán opiniones sobre situaciones clínicas y experiencias que puedan relacionarse o no con los artículos publicados en la Revista, con sentido crítico, objetivo y/o educativo, aceptándose derecho a réplica en caso de opinar sobre algún trabajo publicado. Su extensión máxima será de 2 páginas de tamaño oficio mecanografiadas a doble espacio, aceptándose hasta 4 citas bibliográficas. El Comité Editor acusará recibo de los artículos presentados, informando acerca de la aceptación, modificación o devolución dentro de los 90 días de la recepción. La responsabilidad por el contenido y afirmaciones de los artículos publicados pertenece exclusivamente a sus autores. Estos deberán retener una copia del original pues la Revista no acepta responsabilidad por daños o pérdidas del material enviado. Los trabajos deberán remitirse acompañados por una solicitud de publicación firmada por uno de los autores, por correo o personalmente a: Sociedad Argentina de Hematología Comité Editor de Hematología Julián Alvarez 146 C1414DRD E-mail: [email protected] Prohibida la reproducción total o parcial del contenido por medios electrónicos o mecánicos, incluyendo fotocopias, grabación magnetofónica y cualquier sistema de almacenamiento de información sin autorización escrita del editor. Hematología se distribuye cuatrimestralmente en forma gratuita a los miembros de la Sociedad Argentina de Hematología. Suscripción anual para no socios $ 55.- Números sueltos: para el exterior $ 70.- $ 25 c/u. $ 30 c/u.