Métodos de inoculación - Departamento de Protección Vegetal
Anuncio

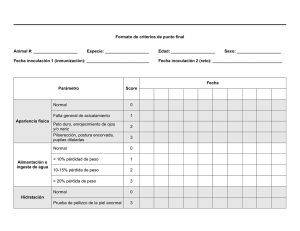
Inoculación en plantas Métodos de inoculación Curso: Métodos en fitopatología Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. La inoculación en plantas la realizamos con el fin de producir enfermedad a las mismas o, en el caso de controladores biológicos, para protegerlas del ataque de patógenos. Debemos disponer de inóculo viable. Debemos poner ese inóculo en contacto con la planta. La planta debe estar en un estadio susceptible. Debemos dar las condiciones necesarias para que ese inóculo colonice la planta y se produzca la enfermedad. Dr. Pedro Mondino 24 de abril al 5 de mayo de 2012 Inoculación de plantas Inoculación de plantas El inóculo de hongos puede ser: Esporas o Es muy importante conocer cual es la cantidad micelio, mientras que en el caso de bacterias es la propia célula bacteriana. En general se debe tener en cuenta cual es la manera en que naturalmente penetra a la planta dicho inóculo. Por ejemplo: en aquellos casos en que el patógeno penetra por heridas será conveniente depositar el inóculo en una herida. mínima de inóculo necesaria para producir infección. En un ensayo en que inoculamos una serie de plantas es necesario que todas sean inoculadas de la misma manera y con cantidades similares de inóculo. Luego de la inoculación es común mantener a las plantas en condiciones de humedad y temperatura apropiadas para que el patógeno pueda desarrollarse. Inoculación de plantas Podemos inocular para probar patogenicidad. En ese caso, si no lo hacemos de manera correcta podemos llegar a resultados erróneos en el diagnóstico. Podemos inocular plantas para evaluar el efecto de alguna medida de control. Por ejemplo evaluar el efecto de un fungicida o de un producto biológico. Inoculación de plantas En los ensayos es esperable que las plantas testigo manifiesten la enfermedad, mientras que las plantas tratadas (si el tratamiento es efectivo) los niveles de enfermedad sean menores. 1 Inoculación de bacterias Inoculación de bacterias Las bacterias pueden inocularse mediante la aspersión de los órganos de la planta con una suspensión de células bacterianas. Es necesario saber ajustar la concentración en la suspensión de bacterias. Inoculación de hojas con una suspensión bacteriana. Mediante carborundum se producen pequeñas heridas. Inoculación de bacterias Resultado de la Inoculación de hojas. Inoculación de bacterias Inoculación de bacterias Embolsado para mantener la humedad de los brotes inoculados. Inoculación de bacterias Inoculación de Pseudomonas syringae pv papulans en frutos Aparición de síntomas. de manzana mediante aspersión con una suspensión de esporas. 2 Inoculación de bacterias Inoculación de bacterias Papa infectada por Ralstonia solanacearum mostrando la El racimo de frutos luego de inoculados son embolsados para evitar zooglea. inoculaciones naturales. Inoculación de bacterias Planta de papa inoculada con Ralstonia solanacearum mostrando marchitamiento de la hoja. La inoculación se realizó mediante punción en una yema lateral. Inoculación de bacterias Planta de papa inoculada con Ralstonia solanacearum mostrando marchitamiento de la hoja. Inoculación de bacterias Planta de papa inoculada con Ralstonia solanacearum mostrando marchitamiento de la hoja. La inoculación se realizó mediante punción en una yema lateral. Inoculación de bacterias Inoculacion de Xanthomonas campestris pv cucurbitae mediante aspersion de cotiledones 3 Test de hipersensibilidad en NO Huésped Inoculación de suelo Ralstonia inoculada mediante riego con suspension bacteriana Método de inoculación mediante infiltración del mesófilo.. Test de hipersensibilidad en NO Huésped Test de hipersensibilidad en NO Huésped Resultado de la inoculación (mesófilo infiltrado) izq. Resultado positivo (reacción de hipersensibilidad) der. Diferentes tipos de inoculación Resultado positivo Inoculación de frutos Inoculación en plantas de olivo de hojas, tallos, raíces y cuello A partir de una colonia esporulada se realiza una suspensión de conidios en suero fisiológico estéril. Tallos Pequeñas heridas de 1 a 2 mm de profundidad se practican con un objeto punzante en la zona ecuatorial de los frutos. Cada herida es inoculada con 10 microlitros de una suspensión de esporas de 104 esporas/ml Cuello Raíz Hojas 4 Inoculacion de frutos Inoculación de frutos Inoculación de frutos cítricos con 10 µl una suspensión de esporas de Penicillium digitatum (104 conidios/ml) Frutos de manzana inoculados Inoculación de frutos Desinfección superficial Secado a temp. ambiente (2hs) Inoculación de heridas con suspensión de antagonista Almacenamiento 1 mes a 5ºC Inoculación de heridas con suspensión de patógeno Inoculación de frutos Inoculación de frutos de kiwi con una suspensión de Herida control Herida protegida Inoculación de frutos Inoculación se zapallos con Fusarium spp. esporas de Botrytis cinerea 5 Inoculación de frutos Inoculación de zapallos con Fusarium spp. Inoculación de hojas mediante aspersión de suspensión de esporas Manchas de las hojas y fruto de manzanos causados por Glomerella cingulata en Río Grande do Sul, Brasil. Método: aspersión con una suspensión de 106 conidios/ml Inoculacion con discos de micelio Botryosphaeria spp. Mediante sacabocado se marcan los discos de micelio sobre la placa Inoculacion con discos de micelio Los discos son colocados sobre la rama previamente herida superficialmente. Posteriormente se cubre con film Inoculación con discos de micelio Inoculación con discos de micelio Cada rama se identifica. Resultado de la inoculación con diferentes aislamientos de Botryosphaeria spp. 6 Inoculación con discos de micelio Resultado de la inoculación en plántulas de arándano con discos de micelio de Botryosphaeria clavispora. Inoculación de suelo Pseudocercosporella herpotrichoides (Fron.) Deighton, agente causal de la mancha ocular del trigo. Inoculación de suelo estéril mezclando con trozos de tallos afectados, y sembrando semillas de una variedad susceptible, desinfectadas superficialmente. Inoculación del sustrato Inoculación en bandejas Inoculación con discos de micelio de Pythium Inoculación de lechuga con discos de micelio de Sclerotinia sclerotiorum Inoculación de tallos mediante discos de micelio Inoculación al suelo. Mediante riego de una suspensión de conidios (haciendo heridas o no) 7 Inoculación de semillas Inoculación de semillas Inoculación de plantines de citrus Resultado Inoculación de semillas Cuantificación de esporas Uso de la cámara de Neubauer Bacterización de semillas Cámara de Neubauer Se trata de un portaobjetos con una depresión en el centro. en el fondo de la cual se ha marcado con la ayuda de un Cámara de Neubauer Esquema diamante una cuadrícula . Es un cuadrado de 3 x 3 mm, con una separación entre dos lineas consecutivas de 0.25 mm. Así pues el área de un cuadrado corresponde a 1 milimetro cuadrado. La depresión central del cubreobjetos está hundida 0.1 mm respecto a la superficie. De forma que cuando se cubre con un cubreobjetos éste dista de la superficie marcada 0.1 milímetro, y el volumen comprendido entre la superficie L y el cubreobjetos es de 0.1 milímetro cúbico, es decir 0.1 microlitro. 8 Cámara de Neubauer Si contamos las cuatro áreas sombreada (L) observando un total de 20 esporas (en las cuatro áreas sumadas) la concentración en la suspensión será : concentración en la suspensión (esporas / mL) = (20/4) y eso multiplicado por 10.000 5 x 104 esporas por mililitro. Cámara de Neubauer En la cámara de Neubauer el límite mínimo de conteo es de 1 x 104 esporas/ml. 5 esporas por cada 0,1 microlitro 50 por microlitro 50.000 por mililitro Recuento en placa Recuento en placa Consiste en sembrar en placas con medio de cultivo Se preparan diluciones sucesivas de 1 en 10. alícuotas de la suspensión de microorganismos. las condiciones óptimas de conteo se dan cuando se desarrollan entre 30 y 300 colonias por placa. Como las colonias pueden originarse tanto de una célula como de un grupo de células, se utiliza el término: UNIDADES FORMADORAS DE COLONIAS (u.f.c.). Para la segunda dilución se toma 1 mL de la primer dilución y se descarga en 9 mL de diluyente y así sucesivamente Las diluciones a sembrar se eligen según la carga esperada o permitida. Generalmente, se siembran no menos de tres diluciones consecutivas. Diluciones Ej.: 1:10 (10-1), 1:100 (10-2), 1:1000 (10-3). Diluciones 9 Recuento en placa Recuento en placa Este método permite determinar sólo las células microbianas viables Esquema Siembra en superficie Se deposita 0.1 mL de cada dilución en la superficie de las placas que ya contienen el medio de cultivo. Se realiza duplicado para cada dilución. Se emplea la misma pipeta para todas las diluciones comenzando por la más diluida. Se debe extender sobre toda la superficie de la placa usando un rastrillo estéril. Se usa un único rastrillo para todas las diluciones en el mismo orden (de la más diluida a la más concentrada) Escala de Mc Farland Uso de la filtración Cuando la concentración es baja mediante filtración y siembra del filtro se pueden medir la concentración de bacterias en medio liquido. Escala de Mcfarland Tubo Cl2Ba al 1% SO4H2 al 1% u.f.c./ml. 1 0,1 9,9 3,0 x 108 2 0,2 9,8 6,0 x 108 3 0,3 9,7 9,0 x 108 4 0,4 9,6 1,2 x 109 5 0,5 9,5 1,5 x 109 6 0,6 9,4 1,8 x 109 7 0,7 9,3 2,1 x 109 8 0,8 9,2 2,4 x 109 9 0,9 9,1 2,7 x 109 10 1.0 9,0 3,0 x 109 10