Lab gases
Anuncio

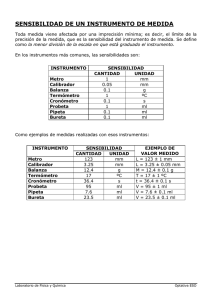
Química General e Inorgánica Ingeniería Ambiental Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando las leyes de los gases. Cuando en una reacción el o los productos son gases por lo general se recogen sobre agua; el gas se capta en un recipiente que inicialmente está lleno de agua y se ha invertido sobre una bandeja también llena de agua. Cuando se produce el gas, este desplaza al agua contenida en el recipiente y queda atrapado en él. La presión dentro del recipiente es igual a la presión atmosférica del exterior, así, la presión total en el interior es la suma de la presión del gas obtenida, con la presión de vapor de agua y la presión de la columna de agua que esté por encima del nivel de la bandeja. Para realizar el cálculo de los moles de gas (nO2) obtenidos en cada experimento, se debe tener en cuenta lo siguiente: nO2 = PO2*V / RT Donde: PO2 es la presión parcial del oxígeno expresada en atmósferas; V es el volumen medido de oxígeno y T es la temperatura en Kelvin. PO2= Patm – Pv-H20 – Ph Donde: Ph es la presión debida a la columna de agua expresada en atmósferas; Pv-H2O es la presión de vapor de agua en atmósferas a la temperatura medida y Patm es la presión atmosférica. 1 atmósfera = 760 mmHg = 10332,3 mm H2O Objetivos: Determinar experimentalmente la masa molar de un metal aplicando las leyes de los gases ideales y la estequiometría de una reacción. Introducir los conceptos de error de medición, propagación de errores y su aplicación en la elección de instrumentos. Química General e Inorgánica Ingeniería Ambiental Fundamentos El magnesio reacciona con ácido clorhídrico produciendo cloruro de magnesio e hidrógeno gaseoso. La reacción ajustada es la siguiente: Mg ( s ) + 2 HCl(ac ) → Mg Cl2 (s ) + H (2 ) (g ) El práctico consiste en pesar una masa conocida de Mg, hacerla reaccionar totalmente con HCl (reactivo en exceso) a temperatura constante y medir el volumen y la presión del gas hidrógeno desprendido, que se recoge sobre agua. El dispositivo usado para ello es el siguiente: Considerando que el gas se comporta como ideal, podemos calcular la cantidad de H2 desprendido conociendo la temperatura, presión y volumen. PH 2 V = n H 2 R T El número de moles de hidrógeno es: nH2 = PH 2 V RT (1) La estequiometría de la reacción indica que se forma un mol de hidrógeno gaseoso por cada mol de Mg que reacciona. n H 2 = n Mg (2) Química General e Inorgánica Ingeniería Ambiental Entonces podemos calcular el peso atómico del Mg y compararlo con tablas. m Mg Masa molarMg = n Mg (3) La masa de Mg se conoce pesando la cinta de Mg. La temperatura es la del ambiente, se mide con un termómetro de laboratorio. El volumen de hidrógeno gaseoso se mide por el desplazamiento que produce en la bureta invertida (ver figura final). La presión parcial de hidrógeno se mide de manera indirecta. Sobre la superficie del agua del vaso de precipitado actúa la presión atmosférica que es igual a la presión que ejercen los gases y la columna de agua que se encuentran dentro de la bureta. Patm = PH 2 + PvaporH2O + Pcolumna H 2O (4) Podemos medir la presión atmosférica con un barómetro; la presión de vapor de agua a la temperatura del experimento se obtiene a partir de tablas (Handbook of Chemistry and Physics). Para conocer la presión de la columna de agua expresada en mm de Hg se mide su altura con una regla milimetrada, se la multiplica por la densidad del agua a esa T y se divide por la densidad del mercurio (13,6 g/cm3). Pcolumna H 2O = hcolumna H 2O x densidad H 2O (5) densidad Hg De la ecuación (4) despejamos la PH2: PH 2 = Patm − PvaporH2O − Pcolumna H2O (6) Materiales: Cinta limpia de magnesio; Alambre de cobre; Ácido clorhídrico concentrado; Vaso de precipitado de 500 mL o 1000 mL; Bureta de 50 mL; Soporte; Pipeta volumétrica de 10 mL; Termómetro. Regla milimetrada Procedimiento: • Pesar en balanza analítica la cinta de Mg (mMg). • Colocar agua destilada en el vaso de precipitado Química General e Inorgánica Ingeniería Ambiental • • • • • • • Medir la temperatura del agua (T) con un termómetro. Averiguar la presión atmosférica (Patm). En toda medición anotar la mínima división de la escala. Buscar en tablas la PVapor H2O a la temperatura T. Determinar el volumen del extremo no graduado de la bureta. Con el robinete cerrado, agregar con una pipeta volumétrica 5,0 ml de agua destilada. Restar a estos 10,0 mL el volumen graduado llenado con agua en la bureta. Atar la cinta de Mg con un alambre de cobre al extremo superior de la bureta. Armar el dispositivo de la figura 1. Primero colocar en la bureta 10 mL de ClH concentrado y completar con agua hasta llenar totalmente la bureta (Figura 1 inicial). Introducir la cinta de Mg en el interior del tubo. Obstruyendo la entrada de aire con el dedo pulgar, dar vuelta la bureta e introducirla en un vaso de precipitados con agua, de manera que quede apoyada en el fondo del vaso de precipitado. Sujetar la bureta al soporte de hierro (Figura 1 final). Precaución: previamente practique varias veces dar vuelta la bureta. Medir el volumen de gases V en la bureta, cuando termina la reacción. V = Vzona no graduada de la bureta +V zona graduada de la bureta ( • Medir la altura de la columna de agua con una regla milimetrada h columna H 2O • Calcular la masa molar de Mg. ) Tratamiento de resultados: cálculo de error. Considerando que la masa molar del Mg de tablas es el valor verdadero, se puede calcular el error relativo porcentual cometido con el valor obtenido del práctico. Er % Peso atómicoMg = Peso at. Mg tablas − Peso at. Mg calculado Peso at. Mg tablas x 100 Este error se puede deber a muchos factores (discutir cuáles) pero uno importante es la elección de los instrumentos de medición usados. En este práctico se midieron varias magnitudes, y todas ellas tienen un error de apreciación, que es la mínima división de la escala del instrumento de medición. El Er% de apreciación se calcula como: Er % de apreciación = error de apreciación valor medido x 100 Los errores de apreciación de magnitudes calculadas se propagan siguiendo ciertas reglas que dependen de la operación aritmética que se realiza. (TABLA 1) Química General e Inorgánica Ingeniería Ambiental Completar el siguiente cuadro: Magnitud medida Valor medido Error del instrumento mMg T VH2 Patm Altura columna agua . Magnitudes calculadas Magnitud calculada Pcolumna H2O Valor calculado Magnitudes Valor medido …. h columna H2O Pcolumna H2O PH2 Patm P vapor H2O PH2 nH2 = nMg V T mMg masa molar Mg nMg Calcular el volumen de HCl concentrado que reacciona estequiométricamente con la cantidad de magnesio pesada.