13. cinética química
Anuncio

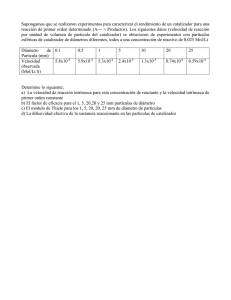
13. CINÉTICA QUÍMICA Ley de velocidad y ecuaciones cinéticas integradas 1.- Si las concentraciones se expresan en mol/L y el tiempo en segundos, ¿Cuál será la unidad de la constante de velocidad en una reacción de: (a) orden cero; (b) primer orden; (c) segundo orden; (d) orden ½. 2.- La constante de velocidad de la reacción de primer orden ciclopropano(g) propeno(g) es 5.5 x 10-4 s-1 a 500 ºC. ¿Cuál es la vida media del ciclopropano a 500 ºC? 21 min 3.- La reacción SO 2 Cl 2 (g) SO 2 (g) + Cl 2 (g) es de primer orden. A 320 ºC, la constante de velocidad es 2.2 x 10-5 s-1. Si una muestra de SO 2 Cl 2 se calienta a 320 ºC durante 5 h, ¿qué fracción quedará sin descomponer? 0.67 4.- La hidrólisis ácida de la sacarosa en disolución acuosa C 12 H 22 O 11 (aq) + H 2 O(l) Sacarosa C 6 H 12 O 6 (aq) + C 6 H 12 O 6 (aq) Glucosa Fructosa es una reacción de seudoprimer orden cuya constante de velocidad es 6.34 x10-5 s-1, a 25 ºC. Calcular: (a) El tiempo necesario para hidrolizar el 75 % de sacarosa de una disolución de 1.2 mol/L. ¿Y si la concentración fuese el doble? (b) La velocidad inicial de reacción en ambos casos. (c) Las concentraciones de sacarosa, glucosa y fructosa al cabo de 1 hora. (a) 21800 s; (b) 7.61 x 10-5 mol L-1 s-1 y 1.52 x 10-4 mol L-1 s-1; [sacarosa] = 0.955 mol/L Determinación de la ley de velocidad 5.- Para la reacción de isomerización de ciclopropano (C 3 H 6 ,g) a propeno (C 3 H 6 ,g), se han obtenido los datos siguientes, a 500 ºC: t / min [C 3 H 6 ] / mol L-1 0 1,5 x 10-3 5 1,24 x 10-3 10 1,00 x 10-3 15 0,83 x 10-3 Determinar el orden de reacción y la constante de velocidad, a 500 ºC. k = 0,040 min-1 6.- Se han obtenido los siguientes datos para la hidrólisis de la sacarosa (C 12 H 22 O 11 ) en disolución acuosa, a 27 ºC: t / min c / mol L-1 0 1 60 0.807 130 0.630 180 0.531 (a) Calcular el orden de reacción y la constante de velocidad. (b) ¿Cuánto tiempo tardará en hidrolizarse el 90 % del azúcar? 3.55 x 10-3 min-1 7.- Para la reacción de descomposición del yoduro de hidrógeno 2HI(g) H 2 (g) + I 2 (g) se han obtenido los datos siguientes a 580 ºC t/s [HI]/(mol L-1) 0 1.00 1000 2000 3000 4000 0.112 0.061 0.041 0.031 (a) Determinar el orden de reacción y la constante de velocidad. (b) ¿Cuál es la vida media de la reacción? 3.9 x 10-3 L mol-1 s-1 8.- Se ha estudiado la cinética de la reacción 2 NO(g) + 2 H 2 (g) N 2 (g) + 2 H 2 O (g) a volumen y temperatura constantes, midiendo la velocidad de reacción inicial en varios experimentos. La tabla siguiente muestra los resultados, a 850 ºC: Experimento 1 2 3 (P NO ) 0 / Torr 450 320 260 Determinar la ley de velocidad. (P H2 ) 0 / Torr 305 450 450 v 0 = Torr s-1 3.09 2.30 1.52 9.- Para determinar la ley de velocidad de la reacción BrO 3 -(aq) + 5 Br-(aq) + 6 H+(aq) 3 Br 2 (aq) + 3H 2 O(l) se realizaron varios experimentos, cuyos datos son los siguientes: Determinar el orden de reacción respecto a cada reactivo, calcular la constante de velocidad y escribir la ley de velocidad de la reacción. v = k [BrO 3 -] [Br-] [Η+]2 Influencia de la temperatura. Ecuación de Arrhenius. 10.- La reacción 2N 2 O 5 (disol) 2N 2 O 4 (disol) + O 2 (g) tiene lugar en tetracloruro de carbono (disolvente) a temperatura ambiente. La constante de velocidad es 2.35 x 10-4 s-1 a 293 K y 9.15 x 10-4 s-1 a 303 K. Calcular: (a) La energía de activación; (b) La constante de velocidad a 313 K (a) 100 kJ/mol 11.- La constante de velocidad de la reacción CH 3 CHO(g) CH 4 (g) + CO(g), cuya 3/2 ley de velocidad es v = k[CH 3 CHO] , se determinó a varias temperaturas: T/K k / mol-1/2 L1/2 s-1 700 730 760 790 810 0.011 0.035 0.105 0.343 0.789 Calcular la energía de activación de la reacción. 174 kJ/mol 12.- Se ha determinado la constante de velocidad de la reacción C 2 H 5 Br(aq) + OH-(aq) C 2 H 5 OH(aq) + Br-(aq) a varias temperaturas. Los resultados son: T / ºC k / L mol-1 s-1 25 8,8x10-5 30 35 1,6x10-4 2,8x10-4 40 45 5,0x10-4 8,5x10-4 50 1,40x10-3 Determinar los parámetros de Arrhenius para la reacción y calcular la constante de velocidad a 60 ºC. E a = 90,2 kJ/mol Mecanismos de reacción 13.- Experimentalmente se ha encontrado que la ley de velocidad de la descomposición del N 2 O en N 2 y O 2 es v = k[N 2 O]. Se cree que la reacción transcurre por el mecanismo siguiente: (1) N 2 O → Ν 2 + Ο (2) Ν 2 Ο + Ο → Ν 2 + Ο 2 ¿Qué puede decirse de las velocidades relativas de las etapas 1 y 2? 14.- La ley de velocidad de la reacción 2 NO(g) + O 2 (g) → 2 NO 2 (g) es v = k[NO]2[O 2 ]. Deducir si el mecanismo siguiente es compatible con esta ecuación cinética. (1) 2 NO N 2 O 2 (rápida) (2) N 2 O 2 + O 2 → 2 NO 2 (lenta) 15.- Para la reacción de descomposición del ozono, 2 O3 (g) → 3 O2 (g), se ha propuesto el siguiente mecanismo (1) (2) O3 O2 + O O 3 + O → 2O 2 (rápida) (lenta) Deducir la ley de velocidad y explicar por qué la velocidad disminuye cuando se aumenta la concentración de O 2 . v = k[O3]2/[O2]. 16.- La ley de velocidad de la reacción H 2 (g) + Br 2 (g) → 2HBr(g) es v = k[H 2 ][Br 2 ]1/2. Un mecanismo posible es: (1) Br 2 2Br (2) Br + H 2 → HBr + H (3) H + Br 2 → HBr + Br (equil. rápido) (lenta) (rápida) Comprobar que este mecanismo es consistente con la ley de velocidad observada. Catálisis 17.- La ley cinética de la reacción 2 NO(g) + O 2 (g) → 2 NO 2 (g) es v = k[NO]2[O 2 ]. ¿Cuáles de los siguientes cambios provocará un cambio en el valor de k?: (a) Se duplica la presión de NO. (b) Se duplica el volumen del recipiente. (c) La reacción se realiza en un disolvente orgánico. (d) Se disminuye la temperatura. (e) Se añade un catalizador. 18.- Determinar cuáles de las siguientes afirmaciones acerca de los catalizadores son ciertas. (a) En un proceso en equilibrio, un catalizador aumenta la velocidad de la reacción directa, pero no cambia la velocidad de la reacción opuesta. (b) El mecanismo de una reacción es el mismo en presencia de un catalizador o en su ausencia, pero cambian las constantes de velocidad. (c) La constante de equilibrio de una reacción es mayor en presencia de un catalizador. (d) Un catalizador desplaza el equilibrio hacia los productos. (e) Un catalizador no se consume durante el curso de una reacción. (f) Un catalizador heterogéneo actúa mediante la unión de una o más moléculas de reactivos a la superficie del catalizador. (g) Los enzimas son proteínas que actúan como catalizadores en los sistemas biológicos. (h) Un catalizador cambia el mecanismo de reacción de manera que la reacción sea más exotérmica. 19.- La descomposición del N 2 O catalizada por el cloro, 2N 2 O(g) → 2N 2 (g) + O 2 (g), es una reacción de primer orden. Un posible mecanismo de la reacción es el siguiente: (a) Cl 2 2Cl (b) N 2 O + Cl → N 2 + ClO (c) N 2 O + ClO → N 2 + O 2 + Cl (rápida) (lenta) (rápida) (a) Demostrar que este mecanismo es compatible con la ley de velocidad experimental. (b) ¿Cuál es el orden de reacción respecto al catalizador?