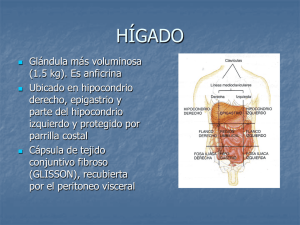
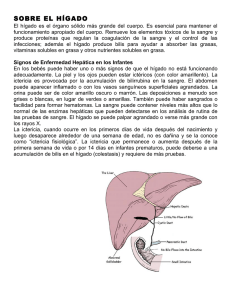
HÍGADO ANATOMÍA - Presentación del curso
Anuncio

HÍGADO M en C Juan Sebastian Barrientos Padilla Profesor de Asignatura Patología General ANATOMÍA Generalidades Anatómicas. El hígado es la glándula mayor del cuerpo. Está situado oblicuamente sobre la superficie abdominal del diafragma. Se mantiene en esta posición mediante la presión de las otras vísceras y por su estrecha unión al diafragma. El hígado está dividido en lóbulos mediante una serie de fisuras. El hígado está cubierto por una serosa externa y una capa fibrosa más profunda. La capa serosa cubre la glándula, a excepción del sitio donde se une con el páncreas y en la fisura portal, desde donde se refleja para formar los ligamentos y el omento menor. La capa fibrosa es por lo general delgada, envía láminas dentro de los ligamentos y también trabéculas a la parte profunda de la glándula. En la fisura portal, se continúa con el tejido conectivo abundante que rodea los vasos y los conductos y les acompaña en los canales portales de la sustancia glandular. Dicha sustancia está compuesta por parénquima y tejido intersticial. El parénquima está formado por lóbulos poligonales, que se mantienen juntos por una pequeña cantidad de tejido conectivo interlobular. Los lóbulos están compuestos por las células hepáticas poliédricas, un retículo muy delicado, los canales biliares, un plexo de grandes capilares, llamados sinusoides, y una vena central. La consistencia del hígado es firme-elástica, aunque es friable y adopta por sí misma posiciones in situ a los tejidos que la rodean. Se adhiere estrechamente al diafragma. Función. La función más aparente del hígado es la secreción de bilis, aunque ésta solamente es una de las numerosas facetas de este órgano. Es un importante órgano de almacenamiento para el almidón y glucógeno, que se sintetiza a partir de los hidratos de carbono que recibe el intestino a través de la vena porta; también es capaz de almacenar grasas y proteínas. Realiza las funciones excretoras y sintetiza los productos de degradación que contienen nitrógeno, procedentes de las proteínas, y los convierte en urea y ácido úrico; entonces, se excretan a través de los riñones. Durante la vida embrionaria participa en la hematopoyesis, pero posteriormente elimina los productos de degradación de los hematíes que proceden del bazo. Asimismo, elimina las sustancias tóxicas de la corriente sanguínea. Conducto biliar. Los conductos biliares forman el conducto hepático que después de recibir el conducto excretor de la vesícula biliar (conducto que no se encuentra en el caballo por carecer de vesícula) constituye el conducto colédoco. Se continúa después hasta la porción inicial del duodeno y se vacía en la papila duodenal. Vesícula. La vesícula biliar (no presente en el caballo) tiene forma de pera. Una parte de su cuello y una de su cuerpo están unidas firmemente al hígado. En el lugar donde no se une con esta glándula, existe un recubrimiento peritoneal. Durante los períodos de descanso digestivo, sirve como órgano de almacenamiento para la bilis. Recibe la bilis a través del conducto cístico, que está conectado con el conducto hepático y, por tanto, la bilis puede fluir a través del conducto cístico en ambas direcciones. HÍGADO DE EQUINOS El hígado es la glándula más voluminosa del organismo. Se halla situada sobre la superficie abdominal del diafragma. Su punto más alto se encuentra a nivel del riñón derecho y el más bajo en el lado izquierdo, en general a unos 8 ó 10 cm del suelo abdominal, opuesto al extremo ventral de la VII u VIII costillas. La parte mayor del hígado asienta sobre la derecha del plano medio, a excepción de cuando el lóbulo derecho está atrofiado. Es de color pardo rojizo y su consistencia es más bien friable. Su peso medio es de unos 5 kg, pero, en los caballos de razas mayores, puede llegar a pesar unos 10 kg. Cuando se observa en el cadáver, o si ha indurado 1 in situ, está fuertemente curvado y adaptado con perfección a la superficie abdominal del diafragma. Cuando se separa de su lugar sin haberlo indurado, se aplasta y adquiere una forma de pastel muy diferente a su configuración original. 1 De endurecer, de poner algo duro. Presenta para su descripción dos superficies y cuatro bordes.La superficie diafragmática (parietal) es convexa, asienta contra el diafragma (figura 18-52) y está dirigida dorsal y cranealmente. Su parte más craneal se halla opuesta al tercio ventral del sexto espacio intercostal o VII costilla. Presenta inmediatamente a la derecha del plano medio, un surco sagital, el sulcus venae cavae2, en el que asienta la vena cava caudal. 2 Surco de la vena cava La superficie visceral se encuentra situada, en general, ventral y caudalmente, es cóncava e irregular, moldeada por los órganos que asientan sobre ella (figs. 18-53 y 18-54). Presenta las siguientes características: 1) Fisura portal (porta hepatis), que es una depresión por encima de la mitad de la superficie y un poco a la derecha del plano medio; por esta fisura penetran, en el hígado, la vena porta, la arteria hepática y el plexo de nervios hepáticos y abandonan la víscera, el conducto hepático y los vasos linfáticos. Los nódulos linfáticos hepáticos también están situados en ella. El páncreas se fija en esta fisura a la derecha, así como el omento menor alrededor de ella. Por encima de la fisura, se halla el lóbulo caudal, que se continúa a la derecha con la prolongación caudal. 2) La impresión gástrica es una zona cóncava extensa o superficie de contacto con el estómago. 3) La impresión duodenal está a la derecha de la fisura hepática y dorsal a la fisura anterior. 4) La impresión cólica está situada ventral y a la derecha de las impresiones gástrica y duodenal, a partir de la cual se separa del borde; corresponde al contacto intenso de la flexura diafragmática y parte dorsal derecha del colon. 5) La impresión cecal, que se halla dorsal a la precedente y se corresponde con la parte craneal de la base del ciego. Sobre esta superficie pueden aplicarse también asas intestinales procedentes del intestino delgado y el vértice del bazo alcanza esta superficie cuando el estómago está vacío. Fig. 18-54. Hígado de un potro reciénnacido, endurecido in situ; superficievisceral.Si se compara con el hígado deladulto,lasdiferencias son muy marcadas. El borde dorsal es grueso en su mayor parte y presenta de derecha a izquierda: 1) el ligamento triangular derecho (lateral); 2) la Impresión renal para el riñón derecho; 3) una escotadura, que es el extremo dorsal de la fosa de la vena cava; 4) una impresión esofágica profunda, que está ocupada en parte por el extremo del esófago, pero fundamentalmente por el borde grueso del hiato esofágico, y 5) el ligamento triangular izquierdo (lateral). El borde ventral es delgado y está marcado por tres fisuras interlobulares profundas, que parcialmente dividen al órgano en cuatro lóbulos: derecho, caudal, cuadrado e izquierdo. Está marcado por varias pequeñas fisuras y por la escotadura del ligamento redondo (fisura umbilical) (incisura lig. teres); este último contiene la vena umbilical en el feto, que se transforma en el ligamento redondo después del nacimiento. El borde derecho es largo y delgado en posición caudal, en general hasta la XVI costilla, ligeramente ventral a su plano medio. El borde izquierdo, delgado y convexo, comienza en el lado respectivo de la impresión esofágica, a unos 10 cm ventral a la XIV vértebra torácica. Se curva ventral de la IX costilla, para cranealmente seguir paralelo al arco costal, hasta un extremo tan ventral como es la VII costilla. La forma y tamaño del hígado varía mucho y, por tanto, existen amplias diferencias de relaciones de la glándula por este hecho. En los jóvenes y adultos, el borde dorsal del lóbulo derecho es casi paralelo a la mitad dorsal de la XVI costilla; en tales casos, la superficie visceral del lóbulo, usualmente, presenta una impresión cecal que se corresponde con la parte más craneal de la base del ciego. En muchos animales, especialmente en los viejos, el lóbulo derecho tiene una atrofia más o menos marcada y una porción de él se hace fibrosa (appendix fibrosa hepatis); en ciertos casos, no existe impresión cecal. La reducción del lóbulo cuadrado es también común y la gran masa glandular puede estar formada por el lóbulo izquierdo. Este está más o menos en contacto con el suelo abdominal; es muy rara la atrofia de este lóbulo. El hígado se mantiene en posición mediante la presión de las otras vísceras y por su íntima unión y contacto con el diafragma. Presenta seis ligamentos; El ligamento coronario, que lo une al diafragma y está formado de dos láminas fuertes. La derecha se une al lado respectivo de la fosa de la vena cava; la izquierda comienza en dicho lado de la vena cava y pasa dorsal y lateralmente y llega a continuarse con el ligamento triangular izquierdo en el borde izquierdo de la impresión esofágica; de él surge un pliegue medio que se extiende a la impresión esofágica y se continúa con el omento menor. Las dos láminas se unen por debajo de la vena cava para formar el ligamento que describimos a continuación. El ligamento falciforme es un pliegue concéntrico que une los lóbulos cuadrado e izquierdo a la parte esternal del diafragma y al suelo abdominal en una distancia que es variable. El ligamento redondo (lig. teres hepatis) es un cordón fibroso, situado en el borde cóncavo del ligamento falciforme y que se extiende desde la escotadura al ligamento redondo (fisura umbilical) hasta el ombligo; es el vestigio de la vena umbilical que en el feto lleva la sangre de la placenta al hígado. El ligamento triangular derecho une el borde dorsal del lóbulo derecho a la parte costal del diafragma. El ligamento triangular izquierdo es unpliegue triangular que une el borde dorsal del lóbulo izquierdo con el centro tendinoso del diafragma. El ligamento hepatorrenal o caudado une la parte caudal al riñón derecho y base del ciego. El omento menor y la primera parte del mesoduodeno están formados por el peritoneo que deja la cara visceral de la fisura portal, a lo largo de una línea curva que se extiende desde la fisura hasta la escotadura esofágica. Desde estos puntos se dirigen a la curvatura menor del estómago y a la parte craneal del duodeno. Como ya se ha indicado antes, el hígado está dividido por fisuras en cuatro lóbulos: derecho, caudado, cuadrado e izquierdo. El lóbulo derecho tiene forma cuadrilátera irregular. Sobre su parte dorsal está el lóbulo caudal, que termina en una prolongación posterior dirigida lateralmente y contribuye a la formación de la cavidad para el riñón derecho. El lóbulo cuadrado está localizado entre el lóbulo derecho y el ligamento falciforme, que le separa del lóbulo izquierdo. El lóbulo izquierdo se halla formado por una porción media y otra lateral; la lateral es oval y más gruesa centralmente. En los animales viejos o en los que han sobrepasado la edad media de vida, este lóbulo excede en general las dimensiones del lóbulo derecho y, en muchos casos, constituye la masa principal de la glándula. El conducto común hepático está formado, en la parte ventral de la fisura portal, por la unión de los conductos hepáticos derecho e izquierdo. Tiene una longitud de unos 5 cm y 1 a 1,5 cm de ancho. Pasa entre las dos capas del mesoduodeno y perfora la pared del duodeno a 12 ó 15 cm del píloro, cerca del conducto pancreático. El conducto pasa en sentido oblicuo a través de la pared del duodeno aproximadamente a 1 cm antes de abrirse en la ampolla hepatopancreática. Esta disposición forma una válvula, que previene la regurgitación desde el intestino; no existe vesícula biliar. El potro recién nacido presenta, en el hígado, notables diferencias en comparación con la glándula del adulto. Es relativamente grande, pesa alrededor de 1,25 kg, es grueso y muy curvado; una parte considerable de la superficie diafragmática está en contacto con el suelo del abdomen. La fisura umbilical es grande y contiene la vena umbilical, que es muy larga, ya que lleva sangre de la placenta, y se une con la vena porta a la masa hepática, en el borde del ligamento falciforme, que en este período se extiende hasta el ombligo. La superficie visceral es profundamente cóncava y se halla en contacto, fundamentalmente; con el estómago y el duodeno. Estructura.El hígado está cubierto por una capa serosa externa y por una fibrosa interna. La capa serosa cubre la glándula, a excepción de la unión del páncreas y de la fisura portal; está reflejada desde él para formar los ligamentos y el omento menor. La cápsula fibrosa es, en general, delgada y envía láminas dentro de los ligamentos y trabéculas a la glándula. En la fisura portal es muy abundante y rodea vasos y conductos, a los que acompaña en los canales portales de la sustancia glandular. La sustancia glandular está compuesta del parénquima y el tejido intersticial. El parénquima está constituido por lóbulos poligonales de 1,5 mm de diámetro, que se mantienen juntos mediante pequeñas cantidades de tejido conectivo interlobular. Debido a la pequeña porción de este último tejido, la lobulación del hígado del caballo no es normalmente tan marcada; por la misma razón, el órgano es también muy friable. Los lóbulos están compuestos de células hepáticas poliédricas, un delicado retículo, los capilares biliares, un plexo de capilares sanguíneos y una vena central. Vasos y nervios. La vena porta entra en la fisura portal y transporta la sangre del estómago, intestino y bazo, con lo que contiene varios productos de la digestión y numerosos leucocitos. La arteria hepática también entra en la fisura portal y puede ser considerada como el vaso nutricio. Toda la sangre retorna del hígado a la vena cava caudal por las venas hepáticas. La vena porta y la arteria hepática se dividen en ramas interlobulares, que van juntas en los canales portales del tejido interlobular. Las ramas de la vena porta (venae interlobulares) proporcionan ramas intralobulares, que forman un plexo de capilares (sinusoides) en los lóbulos y convergen a una vena central. Las ramas interlobulares de la arteria hepática (arteriae interlobulares) son de un tamaño relativamente pequeño, irrigan con preferencia (si no exclusivamente) el tejido interlobular, la cápsula y las paredes de los vasos y conductos. Las venas hepáticas se vacían en la vena cava caudal, a nivel de la fosa de la glándula. Sus últimas divisiones son las venas lobulares centrales, que emergen de las bases de los lóbulos y unen las venas sublobulares; estas últimas se unen para formar las venas hepáticas. Las venas hepáticas mayores, tres o cuatro, desembocan en la cava caudal inmediatamente antes que ésta abandone el hígado para pasar a través del diafragma. Los vasos linfáticos llegan hasta los nódulos hepáticos de la fisura portal y de aquí a la cisterna del quilo; otros pasan por los ligamentos al diafragma y, a través del hiato esofágico, a los nódulos mediastínicos. Los nervios proceden del plexo hepático, que está compuesto de ramas del vago y simpático. HÍGADO DE RUMIANTES El hígado de los rumiantes asienta casi totalmente en el lado derecho del plano medio, después de rotar 90° desde su posición en el embrión en la mayoría de los mamíferos, de modo que el lóbulo derecho es dorsal y el izquierdo es ventral (fig. 29-57). Este desplazamiento está causado por el gran desarrollo del estómago en el lado izquierdo de la cavidad abdominal. El eje mayor se dirige craneoventralmente desde el riñón derecho a la última costilla, hasta el plano del tercio ventral del sexto espacio intercostal. En esta descripción, los bordes, lóbulos, vasos y conductos serán indicados en términos comparativos con el de todas las especies, mientras que los términos de dirección utilizados por la anatomía topográfica del hígado se refieren a su posición actual en el cuerpo del rumiante. El peso medio del hígado de los bovinos es de 4,5 a 5,5 kg; el de la oveja y la cabra pesa entre 550 a 700 g. La superficie diafragmática (fig. 29-56) está, en su mayor parte, moldeada al hueco de la mitad derecha del diafragma, pero una pequeña parte está en contacto con las dos o tres últimas costillas y algunas veces con el costado en el ángulo lumbocostal. Mira dorsal, craneal y hacia la derecha. El ligamento falciforme está unido a esta superficie a lo largo de una línea, desde la impresión esofágica a la escotadura del ligamento redondo. Una zona triangular grande (área nuda), sobre la parte dorsal de la superficie, se encuentra provista de una capa serosa de recubrimiento dada su íntima unión con el diafragma. Esta zona está incluida por dos capas separadas de la rama derecha del ligamento coronario. Fig. 29-57.Lobulación hepática de rumiantes La superficie visceral es cóncava (figs. 29-57 y 29-61). Su característica más importante es la porta hepatis, una depresión limitada por la proyección papilar, la prolongación caudal y la zona de unión del páncreas y por la que entran la vena porta y la arteria hepática y el conducto hepático común abandona el hígado. También están presentes aquí varios nódulos linfáticos hepáticos. La fosa de la vesícula biliar se extiende desde la porta al borde ventral del hígado; es más distinguible en la oveja y la cabra (fig. 29-59) que en el vacuno. También se distingue en la oveja y en la cabra una fisura para el ligamento redondo (fissuralig. teretis), que se extiende transversalmente y cruza la superficie visceral desde la escotadura existente para el ligamento redondo. La línea de inserción del omento menor pasa oblicuamente desde la impresión esofágica a la porta. Cuando el hígado se fija in situ, la superficie visceral muestra una impresión omasal central grande, que produce la mayor parte de la concavidad del hígado en el vacuno. Es mucho más pequeña en la oveja y la cabra. Ventral a la impresión omasal se encuentra la del retículo. La impresión abomasal está presente en la zona ventral derecha (fig. 29-59) El borde derecho es caudal, corto y grueso. Presenta una impresión profunda formada por el lóbulo derecho y el proceso caudal del riñón derecho y la glándula adrenal (figura 29-58). Los bordes ventral e izquierdo son delgados. El borde izquierdo es una curva suave continua con los bordes dorsal y ventral. El borde ventral presenta la fosa de la vesícula biliar (fossa vesicae felleae) y una escotadura para el ligamento redondo (fissuralig. teretis). El borde dorsal está prácticamente en posición media (fig. 29-58). Aloja la vena cava caudal en el sulcus venae cavae. En el extremo craneal del surco se encuentra la impresión esofágica y, por detrás de éste, el hígado se extiende a unos 2,5 a 5 cm a la izquierda del plano medio. Las lobulaciones del hígado de los rumiantes se distinguen mejor en la oveja y la cabra que en el vacuno. Existe una línea desde la escotadura del ligamento redondo a la impresión esofágica, sobre la superficie visceral y otra línea de inserción del ligamento falciforme en la superficie diafragmática, que marca la división entre el lóbulo izquierdo (ventral en los rumiantes) y los lóbulos caudado y cuadrado. El lóbulo caudado está ubicado entre la vena cava y la rama izquierda de la vena porta y el lóbulo cuadrado está situado entre la rama izquierda y el borde ventral del hígado (fig. 29-59). El lóbulo caudado tiene dos prolongaciones; la más pequeña, proceso papilar, se proyecta dentro del vestíbulo de la bolsa omental y se solapa con la rama izquierda de la vena porta; la mayor, proceso caudal elongado, que se extiende a la derecha, cubre gran parte de la superficie visceral del lóbulo derecho y parte de la impresión renal. El lóbulo derecho está limitado por una línea desde la fosa de la vesícula biliar, a través de la porta, hasta el surco de la vena cava. Este es más corto y grueso. La inserción del ligamento falciforme al hígado ya ha sido descrita (fig. 29-56). Su inserción diafragmática está sobre una línea extendida desde el agujero de la vena cava a la séptima unión costocondral derecha. Esta inserción diafragmática es una unión secundaria que resulta del desplazamiento del hígado. En otros mamíferos y en el embrión de los rumiantes, el ligamento falciforme asienta en el plano medio. El ligamento redondo del hígado es un engrosamiento del borde caudal libre del ligamento falciforme. Es el vestigio de la vena umbilical. En muchos rumiantes adultos ambos ligamentos han desaparecido. El ligamento triangular derecho se une al ángulo caudolateral del lóbulo derecho hasta la pared abdominal dorsal. El ligamento triangular izquierdo se extiende desde la impresión esofágica al diafragma, ventral al hiato esofágico. El ligamento coronario une el hígado con el diafragma, en una línea que va desde el ligamento triangular derecho, a lo largo del lado derecho de la vena cava y alrededor de la porción ventral del foramen de la vena cava, hasta el ligamento triangular izquierdo. No existen vestigios de la corona que da el nombre a la anatomía humana. El ligamento hepatorrenal pasa desde el proceso caudado a la superficie ventral del riñón derecho. La inserción del omento menor se describió ya con la superficie visceral (fig. 29-57). Fig. 29-61. Localización de la fosa paralumbar Anatomía superficial. Aunque el hígado está en contacto con la pared abdominal derecha, desde el extremo ventral de la VII costilla hasta la última, no es muy accesible para el proceso diagnóstico, dado que está en gran parte cubierto por el pulmón. La percusión del hígado normal, en el vacuno, está limitada a los últimos cuatro espacios intercostales, caudoventral al pulmón. En algunos individuos, el hígado se puede palpar en el ángulo craneal de la fosa paralumbar (fig. 29-61). En la oveja y la cabra, la zona del hígado expuesta caudoventral al borde basal del pulmón es mayor. Ocupa los espacios intercostales del séptimo al noveno, entre el pulmón y las uniones costocondrales. A partir de la décima unión costocondral, el borde del hígado ovino se extiende caudodorsalmente al riñón derecho en la última costilla. El fondo de la vesícula biliar está en contacto con el diafragma, opuesto a la parte ventral de la X u XI costilla. Vasos y nervios. La vena porta se divide, inmediatamente, al entrar en el hígado, en una rama muy corta derecha y una mayor izquierda. Las ramas secundarias asientan, en su mayor parte, unidas a la superficie visceral, aunque forman un arco a través del hígado y cursan cerca de la superficie diafragmática. La rama derecha se divide, inmediatamente, en cuatro o cinco ramas secundarias; estas ramas van a la prolongación caudada, rama dorsal derecha, una o más ramas intermedias derechas y la rama ventral derecha. La distribución de estas ramas está indicada por sus nombres. La rama dorsal derecha irriga la parte dorsal del lóbulo derecho y proporciona también, cerca de su origen, una rama al lóbulo caudal. La rama ventral derecha cursa a lo largo de este lado de la fosa de la vesícula biliar, irriga la parte ventral del lóbulo derecho y proporciona también, cerca de su origen, una rama central a la mitad de la superficie diafragmática del hígado, que irriga asimismo las partes de los lóbulos derecho, caudado y del cuadrado. La rama izquierda va, al principio, a lo largo del eje mayor del hígado, desde la porta hacia el lóbulo izquierdo (fig. 29-59). Asienta muy unida a la superficie visceral, entre los lóbulos caudado y cuadrado, cubierta por un proceso papilar, por grasa y nódulos linfáticos hepáticos. En el límite entre los lóbulos cuadrado e izquierdo se arquea entre 45 a 90° hacia la escotadura para el ligamento redondo y, después de unos 5 ó 6 cm de trayecto entre los lóbulos cuadrado e izquierdo, termina abruptamente. La rama izquierda se divide en parte transversa, desde la porta a la flexura, y parte umbilical desde la flexura hasta el final (donde las venas umbilicales del feto se unen). La parte transversa proporciona muchas ramas al lóbulo caudado y unas cuantas al cuadrado. La parte umbilical proporciona cuatro grandes vasos, que irradian dentro del lóbulo izquierdo: la rama dorsal izquierda, ramas intermedias izquierdas y rama ventral izquierda. Además de estos vasos, que asientan sobre la superficie visceral, existe una rama diafragmática izquierda, que procede del lado diafragmático del extremo de la parte umbilical y se arquea hacia el borde dorsal del lóbulo izquierdo. La parte umbilical proporciona también varias ramas al lóbulo cuadrado, que asientan inmediatamente a la superficie visceral, y una rama cuadrada diafragmática, que gira hacia el borde dorsal y que se puede extender en el lóbulo caudado. En la ternera recién nacida, el hígado es relativamente mucho mayor que en el adulto. La superficie visceral presenta, a la izquierda de la porta, una eminencia redondeada producida por un gran seno venoso, dentro del cual se vacían las venas umbilical y porta, que es la parte transversa en el adulto. El conducto venoso (ductus venosus) es un gran vaso que va directamente desde el seno a la vena cava caudal. No existen vestigios de este conducto venoso en el adulto. En el recién nacido, la fisura umbilical es profunda. La arteria hepática (fig. 29-57), normalmente, proporciona una gran rama izquierda y dos más pequeñas derechas. Estas se ramifican con las ramas de la vena porta. Las tres venas hepáticas (vena hepática dextra, media, sinistra) van generalmente perpendiculares a las ramas de la vena porta y arteria hepática y se extienden desde la vena cava hacia el borde ventral del hígado. Asientan en la profundidad del parénquima hepático y sus aberturas, dentro de la vena cava, se pueden ver muy bien a partir de la luz (fig. 29-56). La vena hepática derecha se une a la cava entre los lóbulos caudado y derecho y proporciona dos ramas al lóbulo derecho y una al proceso caudado. La vena hepática media se une a la cava, inmediatamente a la izquierda de la hepática. Cursa oblicua a través de los lóbulos cuadrado y caudado y proporciona ramas a ambos lados. La vena hepática izquierda se une a la cava cerca de la impresión esofágica. Proporciona tres a cuatro ramas al lóbulo izquierdo. Los nervios alcanzan el hígado procedentes del plexo celiaco, y sobre la arteria hepática. La rama hepática del tronco vagal, ventral al omento mayor, va a la porta. Conducto biliar. Los conductos biliares pequeños (ductuli biliferi) acompañan a las ramas de la vena porta. Se unen de manera muy variable para formar los conductos hepáticos derecho e izquierdo (ductus hepaticus dexter, sinister) y asientan sobre la superficie diafragmática de las ramas correspondientes de la vena porta y ligeramente ventral a ella. El conducto hepático común procede de la unión de los conductos hepáticos izquierdo y derecho, proporciona el conducto hepático y continúa con el conducto biliar (ductus choledochus). Este entra en el segundo arqueamiento de la flexura sigmoidea del duodeno a unos 60 cm del píloro en el vacuno adulto y a unos 25 a 40 cm en la oveja y la cabra. No existe ampolla hepatopancreática en el vacuno, a causa de que el conducto pancreático está ausente y el conducto pancreático accesorio no se une al conducto biliar. En los rumiantes menores, el conducto pancreático se une al de la bilis antes de que éste alcance el duodeno y no existe tampoco dilatación en la pared duodenal. Varios conductos hepáticos pequeños se abren directamente en la vesícula (ductus hepato cystici). Vesicula biliar. La vesícula biliar (vesica fellea) es un saco en forma de pera, de 10 a 15 cm de longitud en el vacuno, que está parcialmente en contacto con la superficie visceral del hígado, a la que se une, pero también a la pared abdominal en la parte ventral de la X u XI costilla. Puede ser considerada como un divertículo del conducto biliar, alargado, para formar un reservorio. Su cuello continúa por el conducto cístico. La pared de la vesícula está formada por tres capas: serosa, muscular y mucosa. El tejido muscular está formado por fibras que van en varias direcciones, muchas de las externas son longitudinales, mientras que las internas, y en especial en el cuello, son fundamentalmente circulares. La mucosa está cubierta por un epitelio columnar y contiene gran número de glándulas tubulares ramificadas. HÍGADO DE CERDOS El hígado (hepar) es relativamente grande; el peso medio, en el adulto, es de 1,5 a 2 kg. Es grueso centralmente y delgado en su circunferencia. Está dividido por tres incisuras interlobulares profundas en cuatro lóbulos principales: lateral derecho, medial derecho, medial izquierdo y lateral izquierdo; el último es normalmente el mayor. En la parte dorsal del lóbulo lateral derecho está el lóbulo caudado, claramente marcado por una fisura y a menudo parcialmente subdividido por una fisura secundaria. La apófisis caudada se proyecta a la derecha y dorsalmente. No existe apófisis papilar. El lóbulo cuadrado asienta ventral a la fisura portal y a la izquierda de la vesícula y conducto cístico. La superficie diafragmática (parietal) es extremadamente convexa, conforme a la curvatura del diafragma, al cual está íntimamente relacionado(fig. 40-24). Fig. 40-24. Lóbulos del hígado de cerdo cara parietal. Una pequeña parte de la superficie hepática está en contacto con el suelo abdominal, en la región xifoidea y ventral al arco costal derecho. Su parte más craneal alcanza un plano transverso a través de la parte ventral de la VI costilla o espacio intercostal. La superficie visceral es profundamente cóncava; la mayor parte está relacionada con el estómago, donde existe una depresión gástrica profunda y grande. Puede haber también una depresión o concavidad duodenal en la parte dorsal del lóbulo lateral derecho, pero no existe aparentemente depresión renal, dado que el riñón derecho no llega a tocar el hígado. La fosa para la vesícula (fossa vesicae fellae) asienta, fundamentalmente, en el lóbulo medial derecho, pero también en parte de la superficie adyacente del lóbulo medial izquierdo. La vena cava caudal entra por elborde dorsal del lóbulo caudal y pronto se introduce en la sustancia glandular, para emerger sólo a su paso por el diafragma (figura 40-25). Fig. 40-25. Lóbulos del hígado de cerdo cara visceral. La impresión esofágica es grande y está situada en el pilar derecho del diafragma. El borde lateral derecho se extiende caudalmente hasta la parte dorsal del último espacio intercostal. El borde lateral izquierdo está opuesto al noveno espacio intercostal y X costilla. El borde ventral asienta sobre el suelo abdominal a una corta distancia (unos 3 a 5 cm) caudal al cartílago xifoides. El ligamento coronario recuerda al del caballo. El ligamento falciforme es muy corto o puede que no esté presente en el adulto, cuando existe está unido al diafragma inmediatamente ventral al foramen de la vena cava. El ligamento redondo está presente en el animal joven, no presenta ligamento triangular ni ligamento caudado. Dada la abundancia de tejido interlobular que posee el hígado, las superficies externas de sus lóbulos se hallan como enmarcadas en formas poliédricas de 1 a 2.5 mm de diámetro. Por la misma razón la glándula es menos friable que la de otras especies. HIGADO DE CARNÍVOROS El hígado es relativamente grande, el 3 % del peso total del cuerpo. Se divide en cinco lóbulos principales mediante fisuras que convergen a la fisura portal. Cuando la glándula se examina en estado fresco puede extenderse de forma que se hacen muy visibles (figura 51-24); sin embargo, cuando el órgano se ha endurecido in situ, los lóbulos se solapan entre sí en una considerable extensión (figuras 51-25 y 51-26). Fig. 51-24. Lóbulos del hígado de carnívoros. El lóbulo lateral izquierdo es el mayor y tiene un contorno oval. El lóbulo medial izquierdo es más pequeño y prismático. El lóbulo medial derecho es el segundo en tamaño y presenta un lóbulo cuadrado, en forma de lengua, marcado por una fosa profunda en la que asienta la vesícula. El lóbulo lateral derecho es el tercero en tamaño y tiene un contorno oval. En su superficie visceral está el lóbulo caudado, formado por dos partes; a la derecha la apófisis caudada y a la izquierda la papilar, ambas subdivididas por fisuras secundarias. Cuando se encuentra endurecido in situ, el hígado presenta las siguientes características: La superficie diafragmática (parietal) es muy convexa y se adapta a la curvatura del diafragma y parte adyacente de la pared ventral del abdomen, con las cuales está en contacto. La superficie visceral, en general es cóncava, pero se adapta irregularmente a las vísceras que contactan con él. La mayor de ellas es el estómago y la configuración del hígado varía considerablemente de acuerdo con su grado de repleción. Cuando el estómago está lleno, hay una cresta, en el hígado que se corresponde con la curvatura menor. En la izquierda de ésta existe una gran concavidad adaptada al cuerpo y fondo del estómago y en la derecha una impresión más pequeña debida a la parte pilórica del estómago, la primera parte del duodeno y la porción craneal del lóbulo derecho del páncreas. Dorsal a la cavidad para la parte pilórica del estómago está una depresión profunda, en el fondo de la cual está la fisura portal. Para ver esta última debe de retirarse la apófisis papilar y el lóbulo caudado. La arteria hepática entra en el hígado por la parte dorsal de la fisura, la vena porta entra ventralmente y el conducto hepático emerge de la parte ventral. La vesícula no es visible hasta que se han separado los lóbulos lateral y medio. Cuando el estómago está vacío y contraído, la superficie visceral del hígado es muy diferente. Entonces existe una impresión poco profunda para la parte izquierda del estómago en el lóbulo izquierdo y una zona convexa grande, relacionada con el intestino delgado y una masa de epiplón. Las impresiones pilórica y duodenal no cambian mucho. El borde dorsal presenta una impresión renal profunda en su parte derecha. La vena cava caudal pasa ventral y cranealmente, al principio en un surco profundo del lóbulo caudado, luego insertada en la superficie diafragmática del lóbulo lateral derecho; recibe dos o tres venas hepáticas inmediatamente antes de atravesar el diafragma. La impresión esofágica es grande y está ocupada, en la parte derecha, por el borde grueso del hiato esofágico. El resto de la circunferencia es delgada y cortada por una fisura profunda que separa los lóbulos. El borde ventral asienta sobre la pared abdominal, a una distancia variable caudal al cartílago xifoides. El borde izquierdo es también variable, pero lo normal es que se extienda por detrás hasta el décimo espacio intercostal u XI costilla. El borde derecho se corresponde más o menos, en dirección con el arco costal; el extremo de la apófisis caudal es ventral al riñón derecho, opuesto y ligeramente caudal a la última costilla. El ligamento coronario y triangular derecho están bien desarrollados, pero el triangular izquierdo y el falciforme son pequeños; hay otro ligamento que se extiende desde la apófisis caudada hasta el riñón derecho. Vesícula. La vesícula (vesica fellea) asienta en la fosa vesicae felleae, entre las dos partes del lóbulo medial derecho; usualmente no alcanza el borde ventral del hígado. El conducto cístico se une al conducto hepático en la parte ventral de la fisura portal, y forma con él el conducto biliar común (ductus choledochus); este último pasa a la derecha y se abre en el duodeno, a unos 5 a 8 cm del píloro. HISTOLOGÍA Generalidades histológicas. El hígado es la más grande de las glándulas y la víscera más voluminosa del organismo. Pesa alrededor de 1 500 g y corresponde más o menos al 2.5% del peso corporal total del adulto. Está ubicado principalmente en la región del abdomen llamada hipocondrio derecho aunque en parte también se extiende un poco hacia el hipocondrio izquierdo y está protegido por la parrilla costal. El hígado está revestido por una cápsula de tejido conjuntivo fibroso (cápsula de Glisson); una cubierta serosa (peritoneo visceral) rodea la cápsula excepto donde la glándula se adhiere directamente al diafragma o a otros órganos. El hígado está dividido anatómicamente por surcos profundos en dos lóbulos grandes (derecho e izquierdo) y en otros dos más pequeños (lóbulo cuadrado y lóbulo caudado o de Spiegel) (fig. 18.1). Esta división anatómica sólo tiene importancia topográfica porque relaciona los lóbulos hepáticos con otros órganos abdominales. La división en segmentos funcionales o quirúrgicos que corresponden a la irrigación sanguínea y el drenaje biliar tiene una importancia clínica mayor. En el embrión el hígado se desarrolla como una evaginación endodérmica de la pared del intestino anterior (específicamente, a la altura de la porción que luego se convertirá en el duodeno) para formar el divertículo hepático. El divertículo prolifera y da origen a los hepatocitos que se organizan en láminas o trabéculas (de Remak) para formar el parénquima del hígado. El pedículo original del divertículo hepático se convierte en el conducto biliar común (colédoco). Un brote de este conducto forma el divertículo cístico que da origen a la vesícula biliar y al conducto cístico. Irrigación hepática. Para entender las múltiples funciones del hígado que se acaban de mencionar primero hay que conocer su irrigación singular y cómo se distribuye la sangre en los hepatocitos. En el hígado hay una irrigación doble que tiene un componente venoso dado por la vena porta y un componente arterial dado por la artería hepática Ambos vasos se introducen en el hígado a través del hilio o porta hepatis, el mismo sitio por el que salen las vías biliares y los vasos linfáticos. El hígado es singular entre los órganos porque recibe su irrigación principal (alrededor del 75%) de la vena porta, que conduce sangre venosa con poca concentración de oxígeno. La sangre que llega al hígado porla vena porta proviene del tubo digestivo y de órganos abdominales importantes como el páncreas y el bazo. La sangre de la porta que entra en el hígado contiene: • Sustancias nutritivas y materiales tóxicos absorbidos en el intestino. • Eritrocitos y productos de degradación de los eritrocitos provenientes del bazo. • Secreciones endocrinas del páncreas y de las células enteroendocrinas del tubo digestivo. Por ende, el hígado está interpuesto directamente en el trayecto de los vasos sanguíneos que transportan las sustancias absorbidas en el tubo digestivo. Si bien el hígado es el primer órgano que recibe sustratos metabólicos y sustancias nutritivas, también es el primero que está expuesto a las sustancias tóxicas que se han absorbido. La arteria hepática, que es una rama del tronco celíaco, lleva sangre oxigenada al hígado y provee el 25% restante de su irrigación. Dado que la sangre de las dos fuentes se mezcla justo antes de irrigar los hepatocitos del parénquima hepático, estos nunca quedan expuestos a una sangre oxigenada por completo. Dentro del hígado las ramas de distribución de la vena porta y de la arteria hepática (que entregan sangre a los capilares sinusoidales o sinusoides que irrigan los hepatocitos) y las ramas de drenaje de la vía biliar (que desembocan en el conducto hepático común) transcurren juntas en lo que se ha dado en llamar tríada portal Aunque es una denominación conveniente, en realidad no es estrictamente correcta porque siempre hay vasos linfáticos eferentes y filetes nerviosos que transcurren con la vena, la arteria y el conducto biliar (Fig. 18.2). Los sinusoides están en contacto estrecho con los hepatocitos y sirven para el intercambio de sustancias entre la sangre y las células hepáticas. Estos sinusoides desembocan en una vena central o centrolobulillar (vénula hepática terminal, vénula hepática postsinusoídal) que a su vez drena en las venas sublobulillares. La sangre abandona el hígado a través de las venas hepáticas, que desembocan en la vena cava inferior. Organización estructural del hígado. Como ya se mencionó, entre los componentes estructurales del hígado se encuentran los siguientes: • Parénquima, que consiste en trabéculas de hepatocitos bien organizadas que en el adulto normalmente tienen una sola célula de espesor y están separadas por capilares sinusoidales. En los niños de hasta 6 años los hepatocitos se distribuyen en trabéculas de dos células de espesor • Estroma de tejido conjuntivo que se continúa con la cápsula fibrosa de Glisson. En el estroma hay vasos sanguíneos, nervios, vasos linfáticos y conductos biliares. • Capilares sinusoidales (sinusoides), que son los vasos que hay entre las trabéculas hepatocíticas. • Espacios perisinusoidales (espacios de Disse), que están situados entre el endotelio sinusoidal y los hepatocitos. Con esta información como base ahora podemos considerar varias formas de describir la organización de estos elementos estructurales para comprender las funciones principales del hígado. Lobulillos hepáticos. Hay tres maneras de describir la estructura del hígado en términos de una unidad funcional: el lobulillo clásico, el lobulillo portal y el ácino hepático. El lobulillo clásico es el modo tradicional de considerar la organización del parénquima hepático y puede verse con relativa facilidad. Tiene su fundamento en la distribución de las ramas de la vena porta y de la arteria hepática dentro del órgano y en el trayecto que sigue la sangre proveniente de ellas al irrigar finalmente los hepatocitos. El lobulillo hepático clásico se ve en los cortes como una masa de tejido más o menos hexagonal(Fig. 18.3), consiste en pilas de trabéculas hepatociticas anastomosadas de una célula de espesor, separadas por el sistema interconectado de sinusoides que irriga las células con una mezcla de sangre venosa (portal) y arterial. Cada lobulillo mide alrededor de 2.0 x 0,7 mm. En el centro hay una vénula de tamaño relativamente grande, la llamada vena central o vena centrolobulillar (vénula hepática terminal, vénula hepática postsinusoidal), en la cual desembocan los sinusoides. Las trabéculas de hepatocitos, al igual que los sinusoides, adoptan una disposición radial desde la vena centrolobulillar hacia la periferia del lobulillo. En los ángulos del hexágono están los espacios portales o espacios de Kiernan, que consisten en un tejido conjuntivo laxo estromal caracterizado por la presencia de las tríadas portales. Este tejido conjuntivo finalmente se continúa con la cápsula fibrosa que rodea el hígado. El espacio portal está limitado por los hepatocitos más periféricos del lobulillo. En los bordes del espacio portal, entre la estroma de tejido conjuntivo y los hepatocitos hay un intersticio pequeño denominado espacio de Mall. Se cree que este espacio es uno de los sitios en los que se origina linfa en el hígado. Figura 18.3. Lobulillo clásico. En algunas especies, por ejemplo en el cerdo (Fig. 18.4a), el lobulillo clásico se identifica con facilidad porque los espacios portales están conectados entre sí por capas bastante gruesas de tejido conjuntivo. En cambio, en los seres humanos lo normal es que haya muy poco tejido conjuntivo interlobulillar y es necesario que, cuando se examinan cortes histológicos de hígado, se tracen líneas imaginarias entre los espacios portales que rodean una vena centrolobulillar para darse una idea del tamaño del lobulillo clásico (Fig. 18.4b). El lobulillo portal pone de relieve las funciones exocrinas del hígado, la principal función exocrina del hígado es la secreción de bilis. En consecuencia, el eje morfológico del lobulillo portal es el conducto biliar interlobulillar de la tríada portal del lobulillo “clásico". Sus bordes externos son líneas imaginarías trazadas entre las tres venas centrolobulillares más cercanas a esa tríada portal (fig. 18.5). Estas líneas definen un bloque de tejido más o menos triangular que incluye aquellas porciones de los tres lobulillos clásicos que secretan la bilis que drena en su conducto biliar axial. Este concepto permite una descripción de la estructura parenquimatosa hepática comparable con la de otras glándulas exocrinas. El ácino hepático es la unidad estructural que provee la mejor concordancia entre perfusión sanguínea, actividad metabólica y patología hepática, el ácino hepático tiene forma romboidal y es la unidad funcional más pequeña del parénquima hepático. El eje menor del ácino está definido por las ramas terminales de la tríada portal que siguen el límite entre dos lobulillos clásicos. El eje mayor es una línea perpendicular trazada entre las dos venas centrolobulillares más cercanas al eje menor. Por lo tanto, en una vista bidimensional (fig. 18.6), elácino hepático ocupa partes de dos lobulillos clásicos contiguos. Este concepto permite una descripción de la función secretora éxocrina del hígado comparable con la del lobulillo portal. Los hepatocitos de cada ácino hepático se describen dispuestos en tres zonas elípticas concéntricas que rodean el eje menor (fig. 18.6). • La zona 1 es la más cercana al eje menor y a la irrigación proveniente de las ramas penetrantes de la vena porta y de la arteria hepática. Esta zona corresponde a la periferia de los lobulillos clásicos. • La zona 3 es la que está más lejos del eje menor y más cerca de la vena centrolobuhllar (vénula hepática terminal o postsinusoidal). Esta zona corresponde al centro del lobulillo clásico cuyos hepatocitos rodean la vena centrolobulillar. • La zona 2 está entre las zonas 1 y 3 pero no tiene límites nítidos. Figura 18.6. Ácino hepático. La división en zonas es importante en la descripción y la interpretación de los modelos de degeneración, regeneración y efectos tóxicos específicos del parénquima hepático en relación con el grado o la calidad de la perfusión vascular de los hepatocitos. A causa del flujo sanguíneo sinusoidal en las tres zonas varían el gradiente de oxígeno, la actividad metabólica de los hepatocitos y la distribución de las enzimas hepáticas. La distribución de las lesiones hepáticas por isquemia y exposición a sustancias tóxicas puede explicarse mediante el uso de esta interpretación en zonas. Las células de la zona 1 son las primeras en recibir oxígeno, nutrientes y toxinas desde la sangre sinusoidal y son las primeras en sufrir alteraciones morfológicas después de la obstrucción de la vía biliar (estasis biliar). Estas células también son las últimas en morir si hay trastornos de la circulación y son las primeras en regenerarse. En cambio, las células de la zona 3 son las primeras en sufrir necrosis isquémica (necrosis centrolobulillar) en las situaciones en las que disminuye la perfusión y las primeras en acumular lípidos. Son las últimas en responder a sustancias tóxicas y a la estasis biliar. Entre las zonas 1 y 3 también se comprueban variaciones normales de la actividad enzimática, la cantidad y las dimensiones de los organelos citoplasmáticos y el tamaño de los depósitos celulares de glucógeno. Las células de la zona 2 tienen características morfológicas y funcionales y respuestas que son intermedias entre las de las células de las zonas 1 y 3. Vasos sanguíneos del parénquima. Los vasos sanguíneos que están en los espacios portales se denominan vasos interlobulillares. Sólo los vasos interlobulillares que forman las triadas portales más pequeñas envían sangre hacia los sinusoides. Los vasos interlobulillares mayores se ramifican en vasos de distribución que están situados en la periferia del lobulillo. Estos vasos de distribución emiten vasos de entrada hacia los sinusoides (fig. 18.8). En los sinusoides la sangre fluye en forma centrípeta hacia la vena centrolobulillar. La vena centrolobulillar transcurre a lo largo del eje central del lobulillo hepático clásico, aumenta su calibre conforme avanza a través del lobulillo y desemboca en una vena sublobulillar. Varias venas sublobulillares convergen para formar las venas hepáticas, que son mayores y desembocan en la vena cava inferior. La estructura de la vena porta y sus ramas dentro del hígado es la típica de las venas en general. Su luz es mucho más grande que la de la arteria asociada. La estructura de la arteria hepática es como la de otras arterias, o sea que tiene una pared muscular gruesa Además de proveer sangre arterial directamente a los sinusoides, la arteria hepática provee sangre oxigenada al tejido conjuntivo y a otras estructuras en los espacios portales más grandes. Los capilares presentes en estos espacios portales grandes devuelven la sangre a las venas interlobuhllares antes de que estas se vacíen en el sinusoide. La vena centrolobulillar es un vaso de pared delgada que recibe la sangre de los sinusoides hepáticos. Su revestimiento endotelial está rodeado por cantidades pequeñas de fibras de tejido conjuntivo dispuestas enespiral. La vena centrolobulillar, denominada así por su posición central en el lobulillo clásico, en realidad es la vénula que sigue a los capilares sinusoidales en el circuito de la sangre a través del hígado y, por lo tanto, sería más correcto llamarla vénula hepática postsinusoidal (aunque es válida la denominación vénula hepática terminal). La vena sublobulillar, que es el vaso que recibe la sangre de las vénulas hepáticas postsinusoidales o terminales, posee una capa bien definida de fibras de tejido conjuntivo, tanto colágenas como elásticas, justo por fuera del endotelio. Las venas sublobulillares, así como las venas hepáticas en las que desembocan, viajan solas. Dado que son vasos solitarios, en los cortes histológicos pueden distinguirse con facilidad de las ramas de la vena porta que son miembros de las tríadas. En las venas hepáticas no hay válvulas. Los sinusoides hepáticos están revestidos por un delgado endotelio discontinuo, una lámina basal también discontinua que falta en muchos sitios. La discontinuidad del endotelio es obvia por dos razones: a) Hay fenestraciones grandes, sin diafragma, en las células endoteliales. b) Hay brechas anchas entre las células endoteliales contiguas. Los sinusoides hepáticos difieren de otros sinusoides porque un segundo tipo celular, el llamado macrófago sinusoidal estrellado (más conocido como célula de Kupffer) (fig. 18.9), es un componente habitual del revestimiento vascular. Las células de Kupffer pertenecen al sistema fagocitico mononuclear, al igual que otros integrantes del sistema fagocítico mononuclear, las células de Kupffer derivan de los monocitos. El microscopio electrónico de barrido (MEB) y el microscopio electrónico de transmisión (MET) permiten comprobar de manera irrefutable que las células de Kupffer forman parte del revestimiento del sinusoide Antes se consideraba que estaban situadas sobre la superficie luminal de las células endoteliales. Es probable que esta concepción histológica antigua tuviera su origen en el hecho de que las prolongaciones de las células de Kupffer a veces se superponen con extensiones citoplasmáticas endoteliales en el lado luminal del vaso. Las células de Kupffer no están unidas a las células endoteliales vecinas. Las prolongaciones de las células de Kupffer con frecuencia parecen atravesar toda la luz del sinusoide e incluso pueden obstruirla parcialmente. La presencia de fragmentos de eritrocitos y de hierro en la forma de ferritina en el citoplasma de las células de Kupffer indica que participan en la degradación final de algunos eriocitos dañados o envejecidos que llegan al hígado desde el bazo. Un poco del hierro ferritínico puede convertirse en gránulos de hemosiderina y almacenarse en estas células. Esta función aumenta mucho luego de la esplenectomía y entonces se torna indispensable para la eliminación de los eritrocitos desgastados. Espacio perisinusoidal (espacio de Disse). El espacio perisinusoidal es el sitio de intercambio de materiales entre la sangre y los hepatocitos, está situado entre las superficies básales de los hepatocitos y las superficies básales de las células endoteliales y de las células de Kupffer que tapizan los sinusoides. Desde la superficie de los hepatocitos en este espacio se proyectan pequeñas microvellosidadesirregulares (fig.18.10). Las microvellosidades aumentan hasta seis veces la extensión de la superficie disponible para el intercambio de sustancias entre los hepatocitos y el plasma. A causa de las grandes brechas en el revestimiento endotelial y la falta de una lámina basal continua no hay una barrera importante entre el plasma sanguíneo sinusoidal y la membrana plasmática de los hepatocitos. Lasproteínas y las lipoproteínas sintetizadas en el hepatocito se transfieren a la sangre a través del espacioperisinusoidal; todas las secreciones hepáticas, excepto la bilis, siguen esta vía. En el hígado fetal el espacio entre los vasos sanguíneos y los hepatocitos contiene islotes de células hematopoyéticas. En los casos de anemia crónica en los adultos pueden reaparecen células hematopoyéticas en el espacio perisinusoidal. El otro tipo celular que hay en el espacio perisinusoidal es la célula estrellada hepática o lipocito perisinusoidal (que comúnmente se llama célula de Ito). Estas células de origen mesenquimático son el sitio principal de depósito de la vitamina A hepática en la forma de esteres retinílicos dentro de inclusiones lipidicas citoplasmáticas. La vitamina A se libera de las células estrelladas hepáticas como retinol (la forma alcohólica) unido a RBP. Luego se transporta desde el hígado hasta la retina, donde su estereoisómero11-cis retinal se une a la proteína opsina para formar rodopsina, el pigmento visual de los bastones retiníanos. Durante muchos años los aceites de hígado de pescado (p. ej., de aceite de hígado de bacalao) fueron fuentes alimentarias de vitamina A importantes tanto desde el punto de vista médico como económico. En algunas patologías hepáticas, como la inflamación crónica o la cirrosis, las células de Ito pierden su capacidad de almacenar lípidos y vitamina A y se diferencian en células con características de mioflbroblastos. Estas células parecen desempeñar un papel importante en la fibrogénesis hepática; sintetizan y depositan colágenos de los tipos l y III en el espacio perisinusoidal, lo que provoca fibrosis hepática. Este colágeno es continuo con el tejido conjuntivo del espacio portal y con el conjuntivo que rodea la vena centrolobulillar. Un aumento de la cantidad de estroma fibrosa perisinusoidal es un signo inicial de respuesta hepática a sustancias tóxicas. El citoplasma de las células estrelladas hepáticas contiene elementos de aparato contráctil, como los filamentos de actina de célula muscular, además de filamentos intermedios de desmina. Durante la contracción de estas células aumenta la resistencia vascular en los sinusoides por reducción de la luz de estos vasos, lo que conduce a hipertensión portal. Además, las células de lto participan en la remodelación de la matriz extracelular durante la restauración de las lesiones hepáticas. Vasos linfáticos. La linfa del hígado se origina en el espacio perisinusoidal, el plasma que permanece en el espacio perisinusoidal drena hacia el tejido conjuntivo periportal donde se describe un pequeño intersticio, el espacio de Mall (fig. 18.11b), entre la estroma del espacio portal y los hepatocitos más periféricos del lobulillo. Desde este sitio de recolección el líquido se introduce en capilares linfáticos que transcurren junto con los otros componentes de la triada portal. La linfa circula en vasos cada vez mayores en el mismo sentido que la bilis, es decir, desde los hepatocitos primero hacia los espacios portales y luego hacia el hilio hepático. Alrededor del 80% de la linfa hepática sigue esta vía y drena en el conducto torácico, donde forma la mayor parte del volumen linfático contenido en ese conducto. Hepatocitos. Los hepatocitos forman las trabéculas celulares anastomosadas del lobulillo hepático, son células poliédricas grandes que miden entre 20 y 30 Mm en cada dimensión. Constituyen alrededor del 80% de la población celular del hígado. Los núcleos de los hepatocitos son grandes y esferoidales y ocupan el centro de la célula. En el hígado del adulto muchas células son binucleadas; la mayoría de los hepatocitos son tetraploides, es decir que contienen el doble (4d) de la cantidad de DNA normal. La heterocromatina se ve como grumos dispersos en el nucleoplasma y como una banda bien definida bajo la membrana interna de la envoltura nuclear. En cada núcleo hay un nucléolo bien desarrollado o más. Los hepatocitos son células asociadas con el aparato digestivo que viven por un tiempo bastante prolongado; su vida media es de alrededor de 5 meses. Además, estas células del hígado tienen una capacidad de regeneración considerable luego de la pérdida de parénquima hepático por procesos tóxicos, enfermedades o cirugía. El citoplasma hepatocítico en general es acidófllo, los componentes citoplasmáticos específicos pueden identificarse por técnicas de coloración comunes y especiales. Por ejemplo: • Las regiones basófilas corresponden al retículo endoplásmico rugoso (RER) y a ribosomas libres. • Las mitocondrias abundantes, entre 800 y 1 000 por célula, pueden detectarse con colorantes vitales (verde Jano) o con enzimohistoquímica. • Los múltiples complejos de Golgi pequeños se ven con tinciones específicas. • La gran cantidad de peroxisomas se detecta con inmunocitoquímica. • Los depósitos de glucógeno se tiñen con la técnica del PAS (ácido peryódico- reactivo de Schiff). No obstante, en los cortes teñidos con hematoxilina y eosina (H-E) de muestras bien conservadas los sitios donde se hallaba el glucógeno se ven como espacios claros irregulares que le imparten un aspecto granular fino al citoplasma. • Las inclusiones lipídicas de diversos tamaños se identifican luego de una fijación adecuada y con colorantes como sudán (lll, IV o negro) o el azul de toluidina. En los preparados de rutina a veces se ven espacios redondeados que corresponden al sitio donde se hallaban las inclusiones lipídicas antes de disolverse durante la técnica histológica. La cantidad de estas inclusiones aumenta después de la inyección o la ingestión de ciertas hepatotoxinas, entre las que se incluye el etanol. • El pigmento lipofuscina de los cuerpos residuales se ve en los preparados teñidos con H-E en cantidades variables. Con la técnica del FAS también puede detectarse en la forma gránulos pardos bien delineados. Como ya se mencionó, el hepatocito es poliédrico; por conveniencia se lo describe con seis superficies, aunque puede tener más. En la figura 18.12 se muestra un esquema del corte transversal de dos hepatocitos cuboides. Dos de las superficies dan a espacios perisinusoidales. La membrana plasmática de otras dos superficies mira hacia la membrana de un hepatocito vecino y a un canalículo biliar. Si se supone que la célula es cuboide las dos superficies restantes, que no aparecen en el diagrama, también mirarán a hepatocitos contiguos y a canalículos biliares. Las superficies que miran al espacio perisinusoidal son el equivalente de la superficie basal de otras células epiteliales; las superficies que miran hacia hepatocitos vecinos y canalículos biliares equivalen a las superficies lateral y apical, respectivamente de otras células epiteliales. Los peroxisomas son abundantes en los hepatocitos, hay entre 200 y 300 por hepatocito. Su tamaño es relativamente grande y su diámetro varia de 0.2 a 1.0 Mm (fig. 18.13a). Los peroxisomas son sitios importantes de consumo de oxígeno y de esta forma realizan una función similar a la de las mitocondrias. Contienen una gran cantidad de oxidasa que genera peróxido de hidrógeno (H2O2), un compuesto tóxico. La enzima catalasa que también está en los peroxisomas, degrada el peróxido de hidrógeno a oxígeno y agua. Estos tipos de reacciones participan en muchos procesos de desintoxicación que ocurren en el hígado por ejemplo, la desintoxicación del alcohol. En efecto, más o menos la mitad del etanol ingerido se convierte en acetaldehído por la acción de enzimas contenidas en los peroxisomas hepatocíticos. En los peroxisomas humanos hay catalasa. Daminoácido oxidasa y alcohol deshidrogenasa. Además, los peroxisomas también intervienen en la degradación de los ácidos grasos (ß-oxidación) así como en la gluconeogénesis y en el metabolismo de las purinas. El retículo endoplasmico liso (REL) puede ser extenso en los hepatocitos, pero varía según la actividad metabólica (fig. 18.13b). El REL contiene enzimas que participan en la degradación y la conjugación de toxinas y fármacos así como enzimas encargadas de la síntesis del colesterol y del componente lipídico de las lipoproteínas. En condiciones de sobrecarga hepatocítica por fármacos, toxinas o estimulantes metabólicos el REL puede convertirse en el organelo predominante de la célula. Además de estimular su actividad, ciertos fármacos y algunas hormonas inducen la síntesis de nuevas membranas del REL y de sus enzimas asociadas. El REL sufre hipertrofia luego de la administración de alcohol, fármacos (p. ej., fenobarbital, esteroides anabólicos y progesterona) y ciertos agentes quimioterápicos utilizados en el tratamiento del cáncer. La estimulación del REL por el etanol aumenta su capacidad de desintoxicar otros compuestos farmacológicos, ciertos carcinógenos y algunos pesticidas. Por otro lado, el metabolismo que ocurre en el REL puede acrecentar los efectos lesivos sobre los hepatocitos que ejercen ciertos compuestos tóxicos, como el tetracloruro de carbono (CCl4) y el 3,4-benzopireno. El gran aparato de Golgi de los hepatocitos puede contener hasta 50 dictiosomas, la inspección de los hepatocitos con el microscopio electrónico permite comprobar que el aparato de Golgi es mucho más complejo de lo que parece en los cortes histológicos para la microscopía óptica, la tinción con metales pesados (técnicas de impregnación metálica de Golgi) de cortes hepáticos gruesos da indicios sobre la extensión de la red del aparato de Golgi. Cada dictiosoma de Golgi tiene tres a cinco cisternas apiladas, más muchas vesículas de pequeño y gran tamaño. Estos dictiosomas en realidad son componentes del aparato de Golgi tortuoso que se ve en los preparados teñidos con metales pesados. Se cree que los elementos del aparato de Golgi concentrados cerca del canalículo biliar están asociados con la secreción exocrina de bilis. En cambio, las cisternas y las vesículas del Golgi que están cerca de las superficies sinusoidales de la célula contienen gránulos electrondensos de 25 a 80 nm de diámetro que se cree que corresponden a precursores de lipoproteínas. Estas sustancias se liberan ulteriormente hacia la sangre como parte de la función secretora endocrina de los hepatocitos. En las porciones dilatadas del REL (y a veces en los extremos distendidos de las cisternas del RER donde se sintetizan) se ven glóbulos electrondensos similares. Los lisosomas hepatocíticos son tan heterogéneos que sólo pueden identificarse con certeza, incluso en el nivel microscópico electrónico, por medios histoquímicos. Además de las enzimas lisosómicas normales con el microscopio electrónico se identifican otros componentes: • Gránulos de pigmento (lipofuscina). • Organelos citoplasmáticos con digestión parcial. • Figuras de mielina. Los lisosomas de los hepatocitos también pueden ser sitios de almacenamiento normal de hierro (en la forma de un complejo de ferritina) y sitios de acumulación férrica en ciertas enfermedades por depósito excesivo (tesaurismosis). La cantidad de lisosomas aumenta en varias situaciones patológicas que van desde la simple estasis biliar obstructiva hasta la hepatitis por virus y la anemia. Sin embargo, aunque el espectro de funciones hepáticas normales en particular el ritmo de la secreción biliares bastante amplio, en el aparato de Golgi o en los lisosomas del citoplasma peribiliar no se producen cambios morfológicos significativos desde el punto de vista estadístico que concuerden con el ritmo de la secreción biliar. Vías biliares. Las vías biliares (también conocidas como árbol biliar) están formadas por un sistema de conductos de calibre cada vez mayor por los que fluye la bilis desde los hepatocitos hacia la vesícula biliar y desde esta última hacia el intestino. Las ramas más pequeñas de todo el sistema son los canalículos biliares hacia los cuales los hepatocitos secretan la bilis. El canalículo biliar es un conducto pequeño formado por surcos opuestos en la superficie de hepatocitos contiguos; Los canalículos biliares forman un anillo completo alrededor de las cuatro caras de los hepatocitos hexaédricos idealizados (fig. 18.14). El diámetro de su luz es de más o menos 0,5 Mm y están aislados del resto del compartimiento intercelular por uniones estrechas (zonulae occludentes), que forman parte de los complejos de unión que también comprenden zonulae adherentes y desmosomas. En la luz del canalículo hay microvellosidades que se extienden desde la superficie de hepatocitoscontiguos y en la membrana plasmática que las forma se detectan adenosina trifosfatasa (ATPasa) y otras fosfatasas alcalinas, lo que indica que la secreción de bilis hacia este espacio es un proceso activo. El flujo biliar es centrífugo, o sea que se dirige desde la región de la vena centrolobulillar hacia el espacio portal (un sentido opuesto al del flujo sanguíneo). Cerca del espacio portal pero todavía dentro del lobulillo los canalículos biliares se reúnen para formar los denominados conductillos biliares, colangiolos o conductos de Hering (fig. 18.11a), que son cortos y están revestidos por células cúbicas diferentes de los hepatocitos. El epitelio de estos conductos se apoya sobre una lámina basal completa, lo mismo que el resto de la vía biliar. La reconstrucción tridimensional reciente de las reacciones colangiolares en la necrosis hepática indica que las células epiteliales que forman los conductos de Hering proliferan profusamente y migran hacia el parénquima hepático. En consecuencia, se ha esgrimido que el conducto de Hering está compuesto por células madre hepáticas específicas o las alberga. La vía biliar intrahepática lleva la bilis hasta los conductos hepáticos; Los colangiolos tienen un diámetro aproximado de 1.0 a 1.5 Mm y conducen la bilis a través de los límites del lobulillo hacia los conductos biliares interlobulillares que forman parte de la tríada portal (fig. 18.11b). El diámetro de estos conductos oscila entre 15 y 40 Mm y el epitelio que los forma es simple cúbico cerca de los lobulillos y gradualmente se torna cilíndrico conforme los conductos se acercan al hilio hepático. Las células cilíndricas tienen microvellosidades bien desarrolladas, al igual que las células de las vías biliares extrahepáticas y de la vesícula. A medida que los conductos aumentan de calibre se rodean en forma progresiva de una cubierta de tejido conjuntivo denso con fibras elásticas abundantes. Cuando el conducto se aproxima al hilio en este tejido conjuntivo aparecen células musculares lisas. Los conductos interlobulillares se reúnen para formar los conductos hepáticos derecho e izquierdo, que a su vez se unen para formar el conducto hepático común a la altura del hilio (fig. 18.15). En algunos individuos en el tejido conjuntivo que hay entre el hígado y la vesícula biliar, cerca del cuello vesicular, se hallan los conductos de Luschka. Estos conductos se comunican con el conducto cístico y no con la luz de la vesícula. Desde el punto de vista histológico son similares a los conductos biliares intrahepáticos y serían restos de conductos biliares embrionarios aberrantes. La vía biliar extrahepática conduce la bilis hacia la vesícula biliar y el duodeno; el conducto hepático común tiene unos 3 cm de longitud y está revestido por células epiteliales cilindricas altas que se parecen mucho a las de la vesícula biliar (que se describirá más adelante). En este conducto están representadas todas las capas del tubo digestivo excepto la muscular de la mucosa. El conducto cístico conecta el conducto hepático común con la vesícula biliar y permite la entrada de la bilis en ella, así como su salida otra vez hacia la vía biliar. Catando el conducto cístico se une al conducto hepático común pasa a llamarse colédoco (o conducto biliar común) y se extiende por unos 7 cm hasta la pared del duodeno para terminar en la ampolla de Vater. Un engrosamiento de la muscular externa duodenal a la altura de la ampolla forma el esfínter de Oddi, que rodea los orificios del colédoco y del conducto pancreático principal y actúa como válvula para regular el flujo de la bilis y del jugo pancreático hacia el duodeno. El hígado humano adulto secreta un promedio de alrededor de 1 I. de bilis por día, muchos componentes de la bilis participan en la llamada circulación enterohepática, que sirve para reciclarlos. Alrededor del 90% de las sales biliares se reabsorbe en el intestino y retorna al hígado con la sangre de la vena porta. Luego los hepatocitos reabsorben las sales biliares y vuelven a secretarlas. Los hepatocitos también sintetizan sales biliares nuevas para reemplazar las que se pierden. El colesterol y el fosfolípido lecitina, así como la mayoría de los electrólitos y el agua que llegan al intestino con la bilis, también se reabsorben y se reciclan. El glucurónido de bilirrubina, el producto desintoxicado final de la degradación de la hemoglobina, no se recicla. En última instancia se excreta con la materia fecal, a la que le da su color. Una falla en la absorción de la bilirrubina o la incapacidad de conjugarla o de secretar glucurónido puede causar ictericia. El flujo biliar desde el hígado está regulado por mecanismos hormonales y nerviosos. La velocidad del flujo sanguíneo hepático y la concentración de sales biliares en la sangre ejercen efectos reguladores sobre el flujo biliar. Este flujo aumenta cuando durante la digestión las células enteroendócrinas liberan hormonas como la colecistocinina (CCK), la gastrina y la motilina. Las hormonas esteroides (p. ej., los estrógenos durante la gestación) disminuyen la secreción biliar hepática. Además, la estimulación parasimpática aumenta el flujo biliar al incitar la contracción de la vesícula y la relajación del esfínter de Oddi. La bilis que abandona el hígado a través del conducto hepático común fluye hacia la vesícula biliar a través del conducto cístico. La vesícula almacena la bilis y puede aumentar su concentración hasta diez veces. Luego de su estimulación la vesícula biliar se contrae y envía la bilis hacia el duodeno a través del colédoco. El hígado tiene inervación simpática y parasimpática. El hígado (y la vesícula biliar) recibe nervios de las divisiones simpática y parasimpática del sistema nervioso autónomo. Los nervios se introducen por el hilio y se ramifican por todo el hígado siguiendo los espacios portales junto con los integrantes de las tríadas portales. Se cree que las fibras simpáticas inervan los vasos sanguíneos y que las fibras parasimpáticas hacen lo mismo con los conductos de gran calibre (los que tienen músculo liso en sus paredes) y quizá también con los vasos sanguíneos. Cerca del hilio con frecuencia se hallan los somas de neuronas parasimpáticas. Vesícula biliar. La vesícula biliar es un saco distensible con forma de pera que en los seres humanos contiene un volumen de alrededor de 50 ml. de bilis (fig. 18.15). Está adherida a la superficie visceral del hígado y es un derivado secundario del intestino embrionario porque se origina como una evaginación del conducto biliar primitivo que comunica el primordio hepático con el intestino en desarrollo. La vesícula biliar es un saco ciego que desde su región denominada cuello se continúa con el conducto cístico. A través de este conducto recibe bilis diluida desde el conducto hepático común. Ciertas hormonas secretadas por las células enteroendócrinas del intestino delgado en respuesta a la presencia de grasas en la región proximal del duodeno estimulan las contracciones del músculo liso vesicular Como consecuencia de estas contracciones la bilis concentrada se expulsa hacia el colédoco (conducto biilar común), que la conduce hasta el duodeno. La mucosa de la vesícula biliar tiene varías características distintivas; vacía o con llenado parcial tiene muchos pliegues profundos de la mucosa (fig. 18.16). La superficie de la mucosa consiste en un epitelio simple cilíndrico. Las células epiteliales altas poseen las características siguientes: • Abundantes microvellosidades apicales cortas y poco desarrolladas. • Complejos de unión apicales que unen células contiguas y forman una barrera entre la luz y el compartimiento intercelular. • Concentraciones de mitocondrias ubicadas en el citoplasma basal y apical. • Pliegues laterales complejos (fig. 18.17). Estas células se parecen mucho a las células absortivas intestinales; ambas células comparten las características mencionadas, así como la localización de ATPasa de Na*/K’ en sus membranas plasmáticas laterales y vesículas de secreción con contenido de glucoproteínas en su citoplasma apical. La lámina propia de la mucosa está particularmente bien provista de capilares fenestrados y vénulas pequeñas pero no tiene vasos linfáticos. Esta capa también es muy celular y contiene una gran cantidad de linfocitos y plasmocitos. Las características de la lámina propia la hacen semejante a la del colon, otro órgano especializado en la absorción de electrólitos y agua. En la lámina propia de la vesícula biliar humana normal a veces hay glándulas mucosecretoras, en especial cerca del cuello del órgano, pero son más comunes en las vesículas inflamadas. En estas glándulas también hay células de aspecto idéntico al de las células enteroendócrinas del intestino. La pared de la vesícula biliar carece de muscular de la mucosa y de submucosa; Por fuera de la lámina propia está la muscular externa, que posee fibras colágenas y elásticas abundantes entre los haces de células musculares lisas. A pesar de su origen en un divertículo derivado del intestino anterior, la vesícula biliar no posee muscular de la mucosa ni submucosa. Los haces de células musculares lisas están orientados un poco al azar, a diferencia de lo que ocurre en el intestino, donde se organizan en capas. La contracción del músculo liso reduce el volumen de la vesícula, que fuerza la expulsión de su contenido hacia el conducto cístico. Por fuera de la muscular externa hay una capa gruesa de tejido conjuntivo denso (fig. 18.16). Esta capa contiene vasos sanguíneos de gran calibre, una red linfática extensa y nervios autónomos que inervan la muscular externa y los vasos sanguíneos (en la pared del conducto cístico hay somas de neuronas parasimpáticas). En el tejido conjuntivo también hay muchas fibras elásticas y adipocitos abundantes. En donde la vesícula está adherida al hígado esta capa recibe el nombre de adventicia. La superficie vesicular que no está en contacto con el parénquima hepático está cubierta por una serosa (peritoneo visceral) que consiste en un mesotelio apoyado sobre una fina capa de tejido conjuntivo laxo. Además, a veces se extienden a través de todo el espesor de la muscular externa profundos divertículos o invaginaciones del revestimiento epitelial de la mucosa, los llamados senos de Rokitansky-Aschoff. Se cree que representan un presagio de alteraciones patológicas futuras y se originan como consecuencia de hiperplasia (proliferación celular excesiva) y herniación de las células epiteliales a través de la muscular externa. Asimismo, en estos senos pueden acumularse bacterias causantes de inflamación crónica, lo que constituye un factor de riesgo de formación de cálculos biliares. La concentración de la bilis necesita el transporte acoplado de sales y agua; Las células epiteliales de la vesícula biliar transportan activamente tanto Na + como Cl(y HCO3-) desde el citoplasma hacia el compartimiento intercelular del epitelio. En la membrana plasmática lateral de las células epiteliales hay ATPasa. Este mecanismo de transporte activo en esencia es idéntico al descrito en el capítulo 17 para losenterocitos del intestino delgado y las células absortivas del colon. El transporte activo de Na+, Cl- y HCO3- a través de la membrana plasmática lateral hacia el compartimiento intercelular (paracelular) determina que aumente la concentración de electrólitos en este compartimiento. El aumento de la concentración electrolítica crea un gradiente osmótico entre el espacio intercelular y el citoplasma y entre el espacio intercelular y la luz del órgano. El agua se mueve desde el citoplasma y desde la luz hacia el espacio intercelular a causa del gradiente osmótico, es decir que se desplaza a favor de su gradiente de concentración (fig. 18.17b). Aunque el espacio intercelular puede distenderse hasta un grado que con frecuencia es visible con el microscopio óptico, esta capacidad es limitada. El movimiento de electrólitos y agua hacia el espacio crea una presión hidrostática que expulsa un líquido casi isotónico fuera del compartimiento intercelular epitelial y lo introduce en el tejido conjuntivo subepitelial (lámina propia). El líquido que ingresa en la lámina propia pasa rápidamente a los abundantes capilares fenestrados y a las vénulas que están justo debajo del epitelio. Los autores de los estudios del transporte líquido en la vesícula biliar fueron los primeros en demostrar el papel esencial del compartimiento intercelular en el transporte transepitelial de un líquido isotónico desde la luz hacia los vasos. Regeneración hepática. El hígado tiene una gran capacidad para regenerarse después de una agresión hepatotóxica o incluso cuando se extirpan tres cuartas partes del órgano. Los hepatocitos son células de vida prolongada con un periodo de vida cercano a 150 días; en consecuencia sólo rara vez se encuentran figuras mitóticas. Sin embargo, cuando se administran medicamentos hepatotóxicos o se extirpa una porción del hígado, los hepatocitos proliferan y el hígado regenera su arquitectura y tamaño previos normales. La capacidad de regeneración del hígado de roedores es tan grande que si se extirpa 75% del órgano, éste se regenera hasta su tamaño normal en el transcurso de cuatro semanas. La capacidad regenerativa del hígado del hombre es mucho menor que la de los ratones y las ratas. Factor de transformación del crecimiento alfa, factor de transformación del crecimiento beta, factor de crecimiento epidérmico, interleucina 6 y factor de crecimiento del hepatocito controlan el mecanismo de regeneración. Muchos de estos factores son liberados por las células estrelladas que almacenan grasa (células Ito) localizadas en el espacio de Disse, aunque también se encuentra factor de crecimiento del hepatocito, unido a heparina, en la matriz extracelular escasa del hígado. En la mayor parte de los casos la regeneración se debe a la capacidad de replicación de los hepatocitos restantes; sin embargo, la regeneración del hígado depende de la actividad mitótica de las células ovales de los colangiolos y los conductos de Hering cuando la agresión hepatotóxica es considerable. Histofisiología del hígado. El hígado tiene funciones tanto exocrinas como endocrinas y también la función protectora de destoxificar toxinas y eliminar eritrocitos muertos. El hígado puede tener hasta 100 funciones diferentes, la mayor parte de las cuales la llevan a cabo los hepatocitos. Cada una de estas células hepáticas no sólo produce la bilis, que es la secreción exocrina, sino también varias secreciones endocrinas. Los hepatocitos metabolizan los productos finales de la absorción del tubo alimenticio, los almacenan como productos de inclusión y los liberan en respuesta a señales hormonales y nerviosas. Asimismo las células hepáticas destoxifican medicamentos y toxinas para proteger al cuerpo de sus efectos perjudiciales), y transfieren IgA secretoria del espacio de Disse a la bilis. Además, las células de Kupffer fagocitan material particulado extraño de origen sanguíneo y eritrocitos muertos. Elaboración de bilis. La bilis, un líquido elaborado por el hígado, se compone de agua, sales biliares, fosfolípidos, colesterol, pigmentos biliares e IgA. El hígado produce alrededor de 600 a 1 200 ml de bilis al día. Este líquido, que es principalmente agua, contiene sales biliares (ácidos biliares), glucurónido de bilirrubina pigmento biliar), fosfolípidos, lecitina, colesterol, electrólitos del plasma (en especial sodio y bicarbonato) e IgA. Absorbe grasa, elimina cerca de 80% del colesterol sintetizado por el hígado y excreta productos de desecho de origen sanguíneo como la bilirrubina. Las sales biliares constituyen casi la mitad de los componentes orgánicos de la bilis. La mayor parte de las sales biliares se reabsorbe de la luz del intestino delgado, penetra al hígado a través de la vena porta, es endocitada por hepatocitos y se transporta a los canalículos biliares para su liberación subsecuente de nuevo al duodeno (recirculación enterohepática de sales biliares). El restante 10% de las sales biliares se produce por primera vez en el REL de los hepatocitos mediante la conjugación de ácido cólico, un producto accesorio metabólico del colesterol, con taurina (ácido taurocólico) o glicina (ácido glucocólico). La bilirrubina, un pigmento verde amarillento insoluble en agua, es el producto de la degradación tóxica de la hemoglobina. Conforme los eritrocitos muertos son destruidos por macrófagos en el bazo y por las células de Kupffer en el hígado, se libera bilirrubina al torrente sanguíneo y se une a la albúmina del plasma. En esta forma, que se conoce como bilirrubina libre, es endocitada por hepatocitos. La enzima transferasa de glucuronilo, que se localiza en el REL del hepatocito, cataliza la conjugación de bilirrubina con glucurónido para formar glucurónido de bilirrubina (bilirrubina conjugada) hidrosoluble. Una parte del glucurónido de bilirrubina se libera al torrente sanguíneo, pero la mayor parte se excreta a los canalículos biliares a fin de llevarse al tubo digestivo para su eliminación subsecuente con las heces (fig. 18-18). Puesto que las sales biliares son moléculas anfifáticas, sus regiones hidrofílicas están disueltas en medios acuosos y sus regiones hidrofóbicas (lipofílicas) rodean gotitas de lípidos. Por tanto, en la luz del duodeno las sales biliares emulsifican grasas y facilitan su digestión. La falta de sales biliares impide la digestión y la absorción de grasas, lo que da por resultado heces grasosas. Metabolismo de lípidos. Los hepatocitos eliminan quilomicrones del espacio de Disse y los degradan en ácidos grasos y glicerol; Los quilomicrones liberados por las células de absorción de la superficie del intestino delgado penetran en el sistema linfático y llegan al hígado a través de ramas de la arteria hepática. Dentro de los hepatocitos se degradan en ácidos grasos y glicerol. Los ácidos grasos se desaturan después y se utilizan para sintetizar fosfolípidos y colesterol o se degradan en acetilcoenzima A. Dos moléculas de esta última se combinan para formar ácido acetoacético. Gran parte de éste se convierte en ácido hidroxibutírico beta y parte en acetona. Estos tres compuestos se conocen como cuerpos cetónicos. Los fosfolípidos, el colesterol y los cuerpos cetónicos se almacenan en hepatocitos hasta que se liberan al espacio de Disse. Además el hígado produce lipoproteínas de muy baja densidad, que también se liberan al espacio de Disse como gotitas de 30 a 100 nm de diámetro. La coloración amarillenta de la piel, que es la característica de la ictericia, resulta de concentraciones muy altas de bilirrubina libre o conjugada (que son verde amarillento) en el torrente sanguíneo. Los dos tipos principales de ictericia tienen causas diferentes. Una disminución de la conjugación de la bilirrubina, por mal funcionamiento del hepatocito (como en la hepatitis) o con mayor frecuencia por obstrucción de los conductos biliares, causa ictericia obstructiva. El incremento de la hemolisis de eritrocitos, que produce tanta bilirrubina libre que los hepatocitos no pueden eliminarla con la suficiente rapidez aunque no estén deteriorados, ocasiona ictericia hemolítica. La cetosis ocurre cuando la concentración de cuerpos cetónicos en la sangre aumenta de manera considerable (como en individuos que padecen diabetes o inanición). Se identifica por el aliento característico de acetona de las personas afectadas. Cuando no se trata, la cetosis origina una disminución del pH sanguíneo (acidosis), que puede conducir a la muerte. Metabolismo de carbohidratos y proteínas. Las funciones adicionales del hígado incluyen la conservación de los valores normales de glucosa en sangre, la desaminación de aminoácidos y la síntesis de muchas proteínas hematológicas; El hígado conserva los valores normales de glucosa en sangre mediante el transporte de esta última de la sangre a los hepatocitos y su almacenamiento en forma de glucógeno. Cuando las concentraciones sanguíneas de glucosa disminuyen de lo normal, los hepatocitos hidrolizan glucógeno (glucogenólisis) en glucosa y la transportan fuera de las células al espacio de Disse (fig. 18-18). Los hepatocitos también pueden sintetizar glucosa a partir de otros azúcares (como fructosa y galactosa) o de fuentes no carbohidratos (p. ej., aminoácidos), un proceso que se conoce como gluconeogénesis. Una de las funciones esenciales del hígado consiste en eliminar el amoniaco de origen sanguíneo mediante su conversión en urea. Existen dos fuentes mayores de amoniaco en sangre: la desanimación de aminoácidos por hepatocitos y la síntesis de amoniaco por acción bacteriana en el tubo digestivo. El hígado elabora alrededor de 90% de las proteínas sanguíneas (fig. 18-18). Estos productos incluyen 1) factores necesarios para la coagulación (como fibrinógeno, factor III, globulina aceleradora y protrombina), 2) proteínas necesarias para las reacciones del complemento, 3) proteínas que actúan en el transporte de metabolitos y 4) albúmina. Con excepción de las globulinas gamma ) todas las globulinas también se sintetizan en el hígado. Asimismo los hepatocitos pueden sintetizar todos los aminoácidos no esenciales que el cuerpo requiere. Las concentraciones sanguíneas excesivas de amoniaco, indicativas de deterioro de la función hepática o de una reducción súbita del flujo sanguíneo al hígado, pueden originar coma hepático, un trastorno incompatible con la vida. Depósito de vitaminas. La vitamina A se deposita en mayor cantidad en el hígado, pero también se encuentran cantidades importantes de vitaminas D y B12. El hígado contiene depósitos suficientes de vitamina para evitar la deficiencia de vitamina A durante cerca de 10 meses, la de vitamina D unos cuatro meses y la de vitamina B12 por más de 12 meses. Degradación de hormonas y destoxificación de fármacos y toxinas. El hígado endocita y degrada hormonas de las glándulas endocrinas. Las hormonas endocitadas se transportan a los canalículos biliares en su forma natural para digerirse en la luz del tubo digestivo o se llevan a endosomas tardíos para su degradación mediante enzimas lisosómicas. Las oxidasas microsómicas de función mixta en los hepatocitos inactivan fármacos como los barbituratos y los antibióticos, y toxinas. Estos medicamentos y toxinas suelen inactivarse en la cisterna del REL por metilación, conjugación u oxidación. En ocasiones la destoxificación ocurre en peroxisomas en lugar de en el retículo endoplásmico liso. El uso prolongado continuo de ciertos fármacos, como los barbituratos, disminuye su efectividad y se requiere prescribir dosis mayores. Esta toleranciafarmacológica se debe a hipertrofia del complemento de REL de los hepatocitos y un aumento concomitante de sus oxidasas de función mixta. El incremento en el tamaño de los organelos y la concentración de enzima es inducido por el barbiturato, que se destoxifica por desmetilación oxidativa. Además, estos hepatocitos se vuelven de manera concurrente más eficaces en la destoxificación de otros fármacos y toxinas. Función Inmunitaria. Los hepatocitos forman un complejo de IgA con componente secretorio y liberan la IgA secretoria a los canalículos biliares. La mayor parte de los anticuerpos IgA elaborados por células plasmáticas en la mucosa del tubo digestivo penetra al sistema circulatorio y se transporta al hígado. Los hepatocitos forman un complejo de IgA con el componente secretorio y liberan el complejo a la bilis, que a continuación pasa a la luz del duodeno. Por consiguiente, gran parte de la IgA luminal penetra en el intestino a través del colédoco, junto con la bilis. El resto de la IgA luminal se transporta por la mucosa intestinal a la luz mediante las células de absorción de la superficie. Las células de Kupffer, que derivan de precursores monocitos, tienen receptores Fe y para complemento, y por tanto pueden fagocitar material particulado extraño. La importancia de estas células es apreciable porque la sangre de la vena porta contiene un gran número de microorganismos que penetran en el torrente sanguíneo de la luz del tubo digestivo. Estas bacterias se opsonizan en la luz o la mucosa del intestino, o en el torrente sanguíneo. Las células de Kupffer reconocen y endocitan cuando menos 99% de estos microorganismos; también eliminan de la sangre desechos celulares y eritrocitos muertos. Bibliografía - Getty, Robert. (2001). Anatomía de los animales domésticos. MASSON, S.A. (5ta. edición). Barcelona, España. - Konig, Horst. (2008). Anatomía de los animales domésticos. Texto y atlas en color. Editorial Médica Panamericana (2da. Edición). Buenos Aires, Argentina. - Roos, Michael., Pawlina, Wojciech. (2008). Histología Texto y Atlas color con Biología Celular y Molecular.Editorial Médica Panamericana (5ta. Edición). Buenos Aires, Argentina. - Gartner, Leslie., Hiatt, James. (2002) Texto Atlas de Histología. McGraw-Hill Interamericana (2da. Edición). México