GUÍA “QUÍMICA NUCLEAR” NÚCLEO ATÓMICO Y RADIOACTIVIDAD
Anuncio

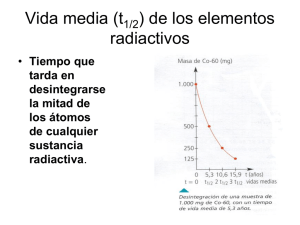
Página 1 de 9 Departamento Química 4º año medio 2014 Profesora Paola A. Lizama Vergara. GUÍA “QUÍMICA NUCLEAR” NÚCLEO ATÓMICO Y RADIOACTIVIDAD Nombre: ______________________________________________________________________________ 4º_____ D ESCU BRIM IENTO D E LAS PARTICU LAS RAD IO ACTIVAS Las reacciones químicas en general implican cambios en la estructura electrónica externa de los átomos o moléculas. Por otra parte, los núcleos atómicos cambian de posición uno respecto a otro, pero no cambia estructura interna. También hay reacciones químicas en que los componentes de los núcleos participan en algunas transformaciones en los cuales los productos finales no contienen los mismos elementos en los núcleos reactivos. Estos cambios se estudian en el área de la denominada Química Nuclear. En 1896 el fisicoquímico; Antoine Henry Bequerel, científico francés, mientras estudiaba las propiedades de algunos minerales, entre ellos sales de uranio, encontró que emitían cierta radiación con mayor poder de penetración que los rayos X, los cuales velaban una placa fotográfica aun cuando estuvieran cubiertas y a oscuras. En un comienzo, Becquerel pensó que las sales de uranio eran fosforescentes, es decir, que después de ser expuestas a los rayos solares, emitían los rayos que acababa de descubrir Roentgen. Para verificar esta hipótesis, mantuvo en la oscuridad, durante varios meses, las sales de uranio y comprobó que no había disminuido la capacidad de éstas de ennegrecer las emulsiones fotográficas. De esto dedujo que la radiación emitida por las sales de uranio no era debida a un fenómeno de fosforescencia y que no dependía en absoluto de excitaciones previas. Observó también que el aire que rodea a las sales se hacía más conductor, como lo mostraba el hecho de que un electroscopio próximo a las sales se descargase. En el año 1898, G. C. Schmidt y M. Curie, independientemente, encontraron que el Torio emitía radiaciones del mismo tipo que el uranio. En Julio del mismo año Marie y Pierre Curie, pudieron aislar de una tonelada de pechblenda (contiene 80% de óxido de uranio U3O8) un gramo de un nuevo elemento que era más radiactivo que el uranio, al cual bautizaron con el bautizaron con el nombre de Polonio. Seis meses más tarde el matrimonio Curie descubrió otro elemento radioactivo hasta entonces desconocido que era 300 000 veces más radioactivo que el Uranio, al cual llamaron Radio. Actualmente se conocen unos treinta elementos radiactivos y todos ellos tienen su origen o en el uranio o en el torio. Pero ¿y qué son las radiaciones emitidas por estas sustancias que implican el cambio espontáneo de átomos de esas sustancias en otros átomos? E. Rutherford identificó y separó este tipo de radiaciones, mostró que aplicando un campo magnético, perpendicular a la dirección de la emisión, la radiación podía ser desviada, y que una componente de la radiación total era muy penetrante y no se la podía desviar ni con campos eléctricos o magnéticos. A esta componente se la llamó "radiación y, demostrándose que ésta es radiación electromagnética de muy alta frecuencia. Los rayos desviados corresponden a partículas α y β , y se demuestra que éstas son de naturaleza eléctrica. N ATU R ALEZA D E LAS PAR TICU LAS R AD IO ACTIVAS Partículas alfa (α): Corriente de partículas cargadas positivamente y que llevan una carga +2 y una masa de 4. Son núcleos de Helio (42He+2). Se mueven a una velocidad de 20 000 (m/s) Presentan una penetración en los tejidos de 0,01 cm. Pueden ser detenidas por una hoja de papel. Poseen gran poder ionizante. Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 2 de 9 Partículas beta (β): Corriente de partículas cargadas negativamente que tiene todas las propiedades de los electrones de alta energía. Se mueven a velocidades cercanas a la luz. Penetran hasta 1cm, atraviesan una hoja de papel pero son detenidos por una lámina de aluminio de 1cm. Su poder ionizante es 1000 veces menor que las partículas alfa. Partículas gamma (γ): Es radiación electromagnética de muy alta energía (longitud de onda de 0,005 a 1 Aº), mayor que la de los rayos X. Como se trata de energía no posee ni carga ni masa. Penetración hasta 100 cm, atraviesan el cuerpo humano pero son detenidos por una lámina de plomo de 5 cm. La Radioactividad presenta características, como: 1. La emisión de las radiaciones es independiente del hecho de encontrarse el elemento radioactivo en libertad como sustancia simple, o formar parte de un compuesto químico. 2. La radiación es independiente de los factores que producen y aceleran otras reacciones químicas como el calor, luz, presión, catalizadores, etc) 3. Las radiaciones emitidas por los elementos radiactivos, además de impresionar placas fotográficas y de atravesar capas de materiales opacos, tienen la propiedad de ionizar gases, excitare la fluorescencia y producir reacciones químicas. ISO TO PO S O N U CLEO S RAD IO ACTIVO S El elemento radiactivo es aquel que tiene una proporción de átomos con núcleos inestables, es decir que se va desintegrando sucesivamente hasta llegar a formar núcleos estables. En esta categoría están todos aquellos elementos cuyo número atómico es superior a 85. Esta situación ocurre principalmente en núcleos de gran masa, que poseen un exceso de neutrones o un exceso de protones: 1) Los neutrones están formados por la unión de protones y electrones, por lo tanto cuando existe un exceso de neutrones en el núcleo, experimenta un fenómeno radioactivo caracterizado por un aumento en la cantidad de protones. Esto lo realiza transformando una parte de los neutrones en protones con la liberación de partículas negativas, o sea a través de la emisión de rayos beta β negativos. 135 135 0 → 53I 54Xe + -1e El núcleo al liberar una partícula beta: El número atómico aumenta en una unidad y el número másico no varía 2) Si el núcleo posee un exceso de protones, debe estabilizarse con la transformación de protones en neutrones, así se disminuye la cantidad de protones y aumenta la de neutrones, lográndose una proporción entre los protones y neutrones que llevan a un núcleo estable. Se postula que la transformación de un núcleo en neutrones, se debe a la liberación de positrones, que poseen la misma masa que la de la partícula beta negativa, pero difiere en su carga. Un haz de positrones corresponde a rayos beta β positivos. 118 54Xe → 118 53I + 0 +1e 3) Cuando los núcleos atómicos poseen un número atómico > 83, llamados núcleos pesados, tienden a experimentar una emisión de tipo alfa (42He), produciéndose una disminución en el número atómico y el número de neutrones en dos unidades. 235 92Xe → 231 90Th + 4 2He Cuando un núcleo emite una partícula alfa, su número atómico (Z) disminuye en dos unidades y su número másico (A) en cuatro unidades. Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 3 de 9 4) Si existe una emisión gamma por parte del núcleo, al ser ésta una radiación del tipo electromagnética, no produce ningún efecto sobre el número másico ni atómico del elemento. La desintegración espontanea de los núcleos radioactivos es fenómeno que se realiza en una serie de etapas sucesivas, el cual finaliza cuando se llega a un núcleo estable como el plomo. 238 92U→ 234 90Th →23491Pa →23490U →23090Th →22688Ra →......20682Pb Los núcleos con 2, 8, 20, 28, 50 u 82 protones o 2, 8, 20, 28, 50, 82 o 126 neutrones son por lo general más estables que los núcleos que no contienen esta cantidad de nucleones. Los núcleos con números pares de neutrones y protones son por lo general más estables que los que contienen números impares de nucleones RADIACTIVIDAD NATURAL TIEM PO D E VID A M ED IA Y D ECAIM IENTO RAD IO ACTIVO La radiación emitida por las sustancias radiactivas es discontinua, por tanto es posible de ser contada, ya que la intensidad de la radiación depende sólo de la cantidad de sustancia presente. Se llama actividad o velocidad de desintegración de una sustancia al número de partículas emitidas en una unidad de tiempo. En general, se observa que la actividad de una sustancia no es constante. Esto concuerda perfectamente con la suposición de que el número de átomos que se desintegran o decaen en un cierto intervalo Δt es proporcional con el número total de átomos presentes, N. De tal modo que se cumple que: ΔN = k x N x Δt Donde k es una constante de proporcionalidad característica de cada elemento radiactivo; se agrega el signo menos para indicar que la actividad disminuye al aumentar el tiempo. El significado de k se obtiene al hacer N = 1 y Δt = 1 seg y representa la probabilidad de que 1 solo átomo se desintegre en 1 seg, y es la llamada constante de desintegración. Dos parámetros relacionados con la constante k y útiles en la descripción de elementos radiactivos son el período de semidesintegración y la vida media de un elemento. Vida media es el tiempo necesario para que la actividad de la muestra disminuya a 1/k de su valor inicial. (Es el tiempo en que un elemento puede permanecer activo) Si designamos por τ la vida media, entonces se tiene que: τ =(1/k) De un modo general puede decirse que "Un elemento es tanto más activo cuanto menor es su vida media" (A la derecha curva de decaimiento del 9038Sr) Por período de semidesintegración T se entiende el tiempo requerido por el elemento para decaer a la mitad de su cantidad original, es decir, el tiempo necesario para que el número de átomos sea la mitad del número inicial. Se puede demostrar que la constante de desintegración k y el período T del elemento radiactivo están relacionados por la expresión: T=0,693/k de allí se desprende que a mayor k, menor período. Por ejemplo, para el radio T=1.590 años. El radón, en cambio, queda reducido a la mitad al cabo de 3,825 días. En el torio, T=1,8x1010 años y, en cambio, en el torio B' T=1x109 seg. Radioisótopos Naturales Radioisótopo Vida Media Desintegración 238 9 α 4,49x10 años 92U 235 8 α U 7,13x10 años 92 235 10 α 1,39x10 años 90Th 40 9 α 1,3x10 años 19K 14 β C 5 730 años 6 3 β 12 años 1H Radioisótopos Artificiales Radioisótopo Vida Media Desintegración 239 α 240 000 años 94Pu 137 β Cs 30 años 55 90 β 28,8 años 38Sr 131 β 8,04 años 53I 125 β I 60,25 años 53 M ED ICIÓ N D E LA RAD IACIÓ N: CO NTAD O R GEIGER Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 4 de 9 Se han ideado diversas formas de detectar la radiación, Becquerel estudió el efecto de la radiación sobre las placas fotográficas. Cuanto mayor sea la exposición mayor es el área oscura del negativo revelado. El contador Geiger se basa en la ionización de materia causada por la radiación, dado que producen iones y electrones por la acción de la radiación ionizante, este permite que exista una conducción eléctrica. El contador Geiger fundamentalmente un cilindro que tiene una abertura hechas de un material que pueden traspasar los rayos α, β y γ. En el centro del tubo existe un alambre conectado a una fuente de corriente continua y el cilindro metálico está unido a otro terminal. El impulso de corriente que se genera cuando entra radiación al tubo se amplifica; cada impulso cuenta una medida de radiación. Otro instrumento se basa en los pequeños centelleos de luz que se produce cuando la radiación alcanza un material fosforescente adecuado. Los destellos se amplifican electrónicamente y se cuentan para medir la cantidad de radiación. U NID AD ES PARA M ED IR LA RAD IACIÓ N La unidad SI de dosis absorbida es el gray (Gy), que corresponde a la absorción de 1J de energía por kilogramo de tejido. La otra unidad es el Rems, que relaciona la cantidad de radiación absorbida por un kilogramo de tejido y el tipo de radiación. 1 Rems = 1 Rad x 1 RBE 1 Rad = 1 x 102 (J) de energía por kg de tejido. 100 Rad corresponden a 1 Gy RBE = efectividad biológica relativa. (Valor 1 para radiación γ y β; 10 para la radiación α). Para cuantificar el daño biológico en cantidad real de radiación absorbida por los tejidos se utiliza el sievert (Sv) y el rem. 1 Sv corresponde a 100 rem. Efectos biológicos de la exposición de radiación de corta duración (una dosis) Dosis (Sv) Dosis (rem) Efecto biológico 0 - 0,25 0 - 25 0,25 - 0,49 25 – 49 Disminución temporal de los glóbulos blancos 0,50 - 0,99 50 – 99 Disminución importante de los glóbulos blancos en la sangre, nausea. 1,0 - 1,99 100-199 Caída del cabello, Náuseas. 2,0 - 5,0 200 – 500 No existen efectos clínicos observables Hemorragias, muerte de la mitad de la población expuesta en menos de 30 días SERIE RADIOACTIVA Las partículas α proceden de los núcleos atómicos, cuando uno de los núcleos pierde una de esas partículas disminuye su masa en 4 unidades y su carga o números atómico disminuye en 2. Esto transforma al elemento inicial en otro nuevo, de número atómico y numero másico más bajo. Luego si el átomo pierde una partícula β, aumenta su carga en 1 unidad y su masa no experimenta variación. De este modo van produciéndose sucesivas transformaciones, que se conocen como desintegraciones del elemento. La figura de la derecha representa las desintegraciones sucesivas de Uranio 238. Observe los isótopos formados RADIACTIVIDAD ARTIFICIAL Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 5 de 9 TRANSM U TACIÓ N NU CLEAR (O D ESINTEGRACIÓ N ARTIFICIAL) La transmutación consiste en modificar el núcleo atómico al ser bombardeado con neutrón u otro núcleo. Ernest Rutherford realizó en 1919 la primera transmutación, esto lo logró bombardeando núcleos de Nitrógeno con partículas α: 14 7N 4 + 2He 17 → 8O 1 + 1H La aceleración de partículas se logra mediante aceleradores de elevado potencial como el ciclotrón, betatrón y sincotrón. Con este último se ha logrado partículas con energía cercana a 6 000 MeV (Mega electrón volt) (9,612600001x10-10J) Otros ejemplos de transmutaciones: 235 27 92U 13Al + 1 + 1 1H 0n 232 → 24 → 91Pa 11Na + 4 2He + 4 2He ENERGÍA NUCLEAR FISIÓ N N U CLEAR Una reacción en la que núcleo pesado, cuyo número másico (A) es mayor a 200, se divide en dos núcleos de tamaños comparables y uno o más neutrones, se denomina fisión nuclear. Este tipo de reacciones va acompañadas por la liberación de una enorme cantidad de energía. 235 92U + 1 0n → 235 92U → 139 56Ba + 94 36Kr + 310n + Energía La primera fisión nuclear realizada por Otto Hahn y Fritz Strassman fue la del Uranio-235. La Fisión nuclear controlada se utiliza en los reactores de potencia para generar electricidad. La fisión de 1 Kg de U-235 libera una gran cantidad de energía equivalente a la explosión de 20 000 de TNT. Las bombas lanzadas en Japón durante la II Guerra Mundial contenían aproximadamente 1 Kg de material fisionable. Para que exista una reacción en cadena se requiere de una masa crítica, para poder disponer de una cantidad mínima de núcleos fisionables para mantener la reacción. En el caso del U-235 la masa crítica corresponde aproximadamente a 1 kg. FU SIÓ N N U CLEAR La fusión nuclear a diferencia de la fisión es la unión de dos núcleos livianos para formar uno más pesado y más estable. Para poder lograr producir la fusión es necesaria una cantidad de energía extremadamente alta, por ejemplos la fusión de átomos de hidrógeno necesita aproximadamente una temperatura de 100 millones de grados celsius. Pero la energía que produce es 4 veces más que la que se produce por la fisión nuclear. A diferencia de la fisión nuclear, la fisión no constituye una amenaza ambiental pues no deja residuos radiactivos. El problema que actualmente todavía no se logra conseguir la temperatura requerida para la fusión controlada: 2 1H + 3 1H → 4 2He + 1 0n + Energía CAMBIOS DE MASA Y ENERGÍA EN LAS REACCIONES NUCLEARES Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 6 de 9 La enorme cantidad de energía liberada, proviene de las partículas que participan en la reacción. Es decir que una parte de la masa de los elementos fisionabales o fusionables se transforman en energía. Los cambios de masa y energía relacionados con ellos en las reacciones nucleares son mucho mayores que los ocurridos en las reacciones químicas convencionales. La relación entre la masa que se pierde y su transformación en energía está dada por la ecuación de Einstein: E = m x c2 ; m=masa y c=velocidad de la luz en el vacío (3,0x108 m/s) Ejemplo: Examinemos la reacción desintegración radiactiva del U-238 según: 238 92U Las masas de los núcleos son: 1 + 238 92U 0n 234 → = 238,003 u ; 234 90Th 90Th = 4 + 2He 233,9942 u y 42He= 4,0015 u El cambio de masa, Δm (masa de los productos - masa de los reactantes), en gramos de un mol de Uranio - 238 que se produce es: 238 92U 1 + 0n → 238,002 g 234 90Th 233,9942 g Δm = 233,9942 g + 4,0015 g - 238,002 g + 4 + 4,0015 g 2He = -0,0063 g = -6,3 x 10-6 kg aplicando la ecuación de Einstein: E = m x c2 = -6,3 x 10-6 kg x (3,0 x 108 m/s)2 = - 5,67 x 1011 J Para un mol de sustancia se liberan - 5,67x1011 J de energía. APLICACIONES DE LA ENERGÍA NUCLEAR EN M ED ICIN A Y AM BIEN TE La posibilidad de realizar transmutaciones ha permitido la obtención de isótopos radiactivos en los laboratorios destinados principalmente a la medicina y la industria. Estos radioisótopos pueden ser usados en la esterilización de alimentos, para controlar poblaciones de insectos esterilizando insectos machos. También pueden ser usados en la destrucción de células y tejidos cancerígenos Núclidos Vida Media Emisión Aplicación Co-58 71,3 días β+, γ Determinación de la ingesta de vitamina B-12 Co-60 5,3 años β, γ Terapia del cáncer C-14 5730 años β Datación con carbono, en la determinación de los caminos de reacción, para medir el desgaste de los neumáticos. I-131 8 días β, γ Diagnostico de enfermedades de la tiroides, tratamiento del cáncer de tiroides. Fe-59 45,6 días β, γ En el estudio de la formación de glóbulos rojos. P-32 14,3 días β Tratamiento de la leucemia Ra-226 1602 años α, γ Terapia del cáncer H-3 12,3 años β Cantidad de agua que tiene una persona Na-23 14,8 hrs β, γ Estudio del funcionamiento del sistema circulatorio Tc-99 6 hrs β Estudio de los huesos, hígado, pulmones y huesos. La aplicación de los radioisótopos como trazadores en la industria, el cuál se introduce dentro de los conductos de gas, agua o petróleo, siguiendo su recorrido detectando la emisión radiactiva. También se utilizan como gammografías, el cuál consiste en obtener imágenes interna de algunas piezas utilizando radiografías en base a rayos gamma. Los trazadores también se aplican en agricultura marcando algunos nutrientes del suelo y así estudiar aquellos que producen mejores resultados en los distintos tipos de cultivos. Los isótopos radiactivos son utilizados para estudiar el ambiente, específicamente para análisis de contaminantes. El isótopo radioactivo C-14 se usa en la datación de objetos arqueológicos de naturaleza orgánica. Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 7 de 9 El hombre siempre ha estado expuesto a una cierta cantidad de radiación ambiental proveniente de fuentes naturales y artificiales. De fuentes naturales de radiación recibimos aprox. 1 mSv/año. Una fuente natural es la radiación cósmica, que nos llega de fuera del planeta. La atmósfera sirve de blindaje para la mayor parte de ella, pero de cualquier manera nos llega una dosis de 0,35 mSv/año en el ecuador a nivel del mar. Esta dosis aumenta con la latitud debido al campo magnético de la Tierra, hasta que a latitud 50°, se reciben aproximadamente 0.5 mSv/año. La dosis también aumenta con la altura sobre el nivel del mar porque hay menos atmósfera para absorber la radiación. A 2000 m sobre el nivel del mar, aumenta a 1 mSv/año, mientras que a 5 000 metros llega a 3 mSv/ año. En un viaje aéreo, se reciben aproximadamente 0,05 mSv. Otra fuente natural de radiación son ciertos elementos radiactivos que están presentes en cualquier mineral, como uranio, torio y potasio 40. El radón es un gas radiactivo producido por el decaimiento del uranio de todos los materiales. Es responsable de aproximadamente 0.3 mSv/ año, como una tercera parte de la dosis natural que recibimos. En ciertos lugares se puede acumular este gas, como en lugares mal ventilados o en fallas geológicas, aumentando la dosis. Algunos ejemplos de fuentes artificiales son los reactores nucleares, las fuentes radiactivas y los aparatos para usos médicos e industriales de la radiación. Una radiografía de tórax produce 0,2 mSv en un segundo. Una radiografía dental, 10 mSv, pero en una región muy localizada del cuerpo. GENERACIÓN DE ENERGÍA ELÉCTRICA Cuando se produce la fisión del átomo de Uranio, se libera gran cantidad de energía y se produce una reacción autosostenible. Al controlar a partir de cierto nivel la reacción en cadena, se controla también la energía que se libera. Los reactores nucleares tienen la función de controlar la energía que se libera en una fisión nuclear. El calor liberado de la fisión se transmite a través de un intercambiador calórico a un sistema que librare vapor, el cuál hace funcionar las turbinas que posteriormente generarán la energía eléctrica. Partes de un Reactor nuclear a) Combustible: en forma de UO2, que debe contener 3 o 4% de U-238 (Uranio enriquecido) b) Material moderador: comúnmente agua, se utiliza para desacelerar los neutrones liberados en la fisión. c) Barras de control: de grafito, cadmio o boro, absorben los neutrones. Con esto se puede controlar la fisión. Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 8 de 9 Sin estas barras el corazón del reactor se podría derretir, produciéndose un incendio y la liberación de material radiactivo al ambiente. d) Sistema de enfriamiento: absorbe el calor producido por la fisión y lo transfiere fuera del reactor, hacia un sistema que produzca gran cantidad de vapor para hacer funcionar el generador eléctrico. e) Sistema de blindaje: evita las fugas de radiaciones hacia el exterior. ARMAS NUCLEARES a) Bomba Atómica o Bomba A: Se basa en la fisión-nuclear, se utiliza como combustible: uranio, plutonio y polonio o mezcla de ellos. b) Bomba de Hidrogeno o Bomba H: Se basa en la fusión del hidrógeno y helio. Para que ocurra la fusión nuclear es necesario someter el combustible varios millones de grados celsius. Esto se logra haciendo explotar previamente una bomba atómica, la cuál genera la energía necesaria para producir la fusión del hidrógeno o del helio, liberándose una gran cantidad de energía. 1 2 c) 1H 1H 3 2He 3 2He + + + + 1 1 1H 1H 3 2He 1 1H → → → → 2 1H 3 2H 4 2He 4 2He + 0 -1e + + 1 1H 0 -1e + + + + energía energía energía energía Bomba de neutrones: La bomba de neutrones no genera una gran explosión, se trata de la fusión de átomos que reducen notablemente la onda electromagnética. Se trata de un sistema que libera una gran cantidad de neutrones, que al ser absorbido por los materiales lo inducen a ser radiactivos durante un corto tiempo, Las emisiones radiactivas que hacen estos materiales al absorber los neutrones son altamente dañinos y de manera irreparable para los seres vivos, sin destruir el entorno. EJERCICIOS I. Responda 1) El C-11 tiene un período de semidesintegración de 20 minutos. Partiendo de 100 g de carbono, ¿qué cantidad quedará al cabo de tres horas? 2) En un experimento se inyecta a un animal Na radiactivo, cuyo período de semidesintegración es 14,8 horas. ¿Cuántos días son necesarios para que la radiactividad descienda a 0,1 de su intensidad original?. 3) El período de semidesintegración de Ag-112 es de 3,20 horas. ¿Cuánto tiempo tardará para que desaparezca el 30% de una muestra?. 4) El núclido de sodio 22 se desintegra por emisión de un positrón, la rapidez es tal que el 76,6% de la cantidad original permanece después de un año. a) Escriba la ecuación de desintegración. b) ¿Cuál es la constante de desintegración? c) ¿Cuál es el período de desintegración del núclido? 5) El período de semidesintegración del Fe-59 es 45 días. a) Calcular el tiempo necesario para que se desintegre el 70% de la muestra. b) Se quiere disponer de 1 g de Fe-59 para un experimento y el envío demora 20 días, ¿qué cantidad se deberá encargar? 6) Se ha hallado que el 60% de la muestra de un núcleo radiactivo se ha desintegrado en 20 horas. Calcular el período de semidesintegración. 7) El isótopo Co-60 presenta un t½ de 5,23 años. Sus capsulas se usan en radioterapia y su efectividad para la medicina es nula al 75% de su actividad inicial, debiendo sustituirse. ¿Qué actividad presentará luego de 1 año de uso? II.- Desarrolla las siguientes ecuaciones nucleares, indicando en el núclido formado: a.- Neptunio -232 captura un electrón b.- 712 N emite un positrón c.- 1126 Na emite un electrón d.- 39 Li emite un neutrón e.- 83212Bi emite una partícula alfa f.- Ra–226 emite una partícula alfa Química 2014 - 4º Medio Profesora Paola A. Lizama Vergara Química Nuclear Fenómenos de Radioactividad Página 9 de 9 III. Ejercicios de Selección 1.- Al estudiar la desintegración radiactiva de un elemento, se obtiene el gráfico adjunto: El período de semidesintegración de este elemento es: a) 2 horas b) 4 horas c) 8 horas d) 12 horas e) 20 horas 11.- Para referirse a la velocidad con que ocurren las desintegraciones nucleares se utiliza el concepto de: a) emision radiactiva b) energía nuclear c) tiempo de vida media d) serie radiactiva 2.- Los radioisótopos que tienen un exceso de neutrones decaen por emisión de a) protones b) neutrones c) electrones d) protones y luego electrones 13.- Ordenando las emisiones en función de su poder de penetración es correcto a) γ> β>α b) α>β>γ c) β>γ>α d) β>α>γ 3.- Indique que tipo de partículas liberan los isótopos que poseen una cantidad de protones mayor que la de neutrones a) partículas α b) partículas β c) partículas β + d) rayos gamma 4.- ¿Cuál de los siguientes núclido(s) puede(n) ser radiactivos? a) 816 O b) 612 C c) 94238 Pu d) 50108 Sn 5.- Un electrón se puede definir como rayo a) alfa b) beta c) gamma d) otra 6.- los compuestos radiactivos son aquellos que al desintegrarse espontáneamente: a) emiten partículas alfa b) emiten neutrones c) captan partículas beta d) captan electrones 7.- La siguiente transmutación libera una partícula X que corresponde a: 16 a) 17 32 32 Cl S b) + 15 32 0 P 1 n → 1 1 H + X 33 c) 16 S d) 1833 Ar 8.- En la reacción nuclear X representa: 12 a) 8 17 O 24 Mg + b)11 23 2 4 Na He → c) 1 12 1 24 H + “X” Mg d) 1327 Al 9.- Un elemento radiactivo se caracteriza porque: a) está formado por átomos con núcleos estables b) se desintegra en sucesivas etapas emitiendo radiaciones c) se transforma en otros núcleos que son inestables d) su núcleo tiene un exceso de protones 10.Para completar la siguiente serie radiactiva se debe escribir sobre las fechas de izquierda a derecha: 234 → 90Th230 → 88Ra226 → 86Rn222 → 84Po218 92U a) α , α, β- , βb) α, β- , βc) α, α, α, α d) α, βQuímica 2014 - 4º Medio Profesora Paola A. Lizama Vergara 12.- La vida media de Co–60 es de 5,3 años ¿Qué cantidad de una muestra de 10 g de cobalto queda después de 21,2 años? a) 1,125g b) 0,625g c) 5,3 años d) 8,25 años 14.- El isótopo 53 I131 usado en medicina para medir la actividad de la glándula tiroides, tiene una vida media de 8 días. Esto implica que el isótopo decae: a) totalmente en 6 días b) a la mitad en 4 días c) a la mitad en 8 días d) totalmente en 24 días 15.- Después de 6 años, los 16g de una muestra de un elemento radiactivo quedan reducidos a 2g. Por lo tanto, su período de semidesintegración (vida media) es: a) 3 años b) 6 años c) 4 años d) 2 años 16.- Si la vida media de un isótopo radiactivo es de una semana ¿Qué fracción de material quedará sin decaer después de tres semanas? a) la mitad b) la tercera parte c) la sexta parte d) la octava parte 17.- En el decaimiento radiactivo del U -238 ¿Qué elemento resulta tras la emisión de las siguientes partículas α - β- - β- - α a) Th–230 b) U-231 c) Pa–234 d) Th–234 18.- El U-234 alcanza su estabilidad nuclear cuando se transforma en: a) Po–210 b) Pb–206 c) Pb–210 d) Th – 234 19.- La edad de un objeto arqueológico se puede calcular a través de: a) cálculo de su vida media b) de la desintegración del objeto en cuestión c) el método del C-14 d) el método del N-14 20.- La datación radiactiva se usa para: I determinar la edad de objetos arqueológicos II determinar la vida media de un elemento radiactivo III determinar el decaimiento radiactivo de un elemento a) Solo I b) solo II c) solo III d) solo I y II Química Nuclear Fenómenos de Radioactividad