Estructura de la Materia 2
Anuncio
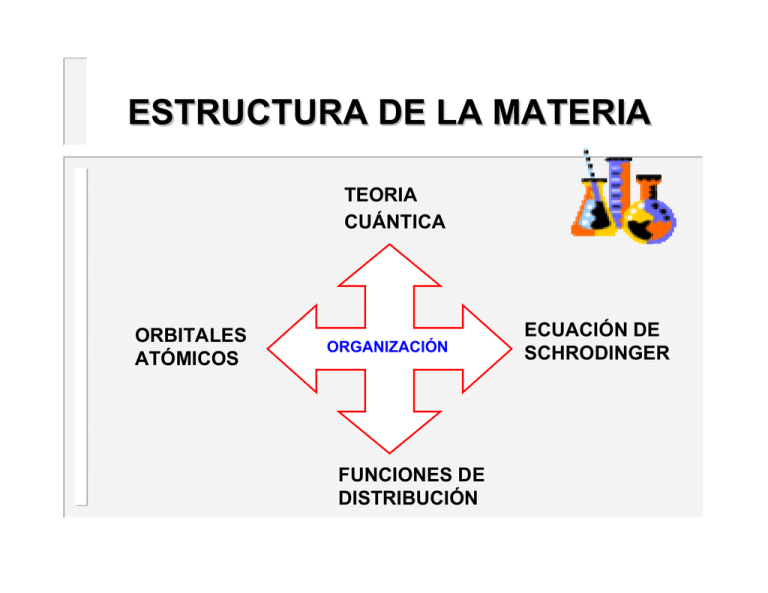
ESTRUCTURA DE LA MATERIA TEORIA CUÁNTICA ORBITALES ATÓMICOS ORGANIZACIÓN FUNCIONES DE DISTRIBUCIÓN ECUACIÓN DE SCHRODINGER ESTRUCTURA DE LA MATERIA Naturaleza Ondulatoria del Electrón Partículas muy pequeñas en movimiento presentan propiedades ondulatorías. Una partícula de masa m y velocidad v tiene una longitud de onda asociada (Louis de Broglie, 1925) = h /m v (h, constante de Planck) La materia se comporta como onda o como corpúsculos según la ocasión: las partículas presentan esta dualidad onda y corpúsculo. ESTRUCTURA DE LA MATERIA Principio de Incertidumbre de Heisenberg Es imposible determinar exactamente el momento (masaxvelocidad) y la posición de un electrón (o cualquier otra partícula muy pequeña) de forma simultánea (W. Heisenberg, 1927). x, incertidumbre en la posición. p = (masaxvelocidad), incertidumbre en el momento. Los electrones son tan pequeños y se mueven tan rápido que solo es posible establecer la probabilidad de encontrar un electrón en una región del espacio. ESTRUCTURA DE LA MATERIA MECÁNICA CUÁNTICA Los átomos y moléculas solo pueden existir en ciertos estados de energía. Cuando cambian su estado de energía deben emitir o absorber la energía suficiente para pasar al nuevo estado de energía. La variación de energía en el átomo o molécula se relaciona con la frecuencia o longitud de onda de la luz emitida o absorbida según la ecuación: E = h ESTRUCTURA DE LA MATERIA MECÁNICA CUÁNTICA Los estados de energía permitidos de átomos y moléculas pueden describirse por un conjunto de números denominados números cuánticos. La mecánica cuántica considera al electrón como una onda estacionaria (que no viaja) y por lo tanto, el electrón se puede describir a través de una función de onda ESTRUCTURA DE LA MATERIA ECUACIÓN DE SCHRODINGER - h2 (2 2 2 V = E 8 2m x2 y2 z2 h, constante de Planck; m, masa del electrón; E, energía del electrón y V, potencial Solamente para ciertas combinaciones de cuatro números cuánticos (n, l, ml y ms) existen funciones que son soluciones de la ecuación. La resolución de esta ecuación indica la probabilidad de encontrar un electrón en el espacio con una cierta , función de onda radial energía: r2, función de distribución radial ESTRUCTURA DE LA MATERIA ORBITALES ATÓMICOS Las funciones de onda y los números cuánticos asociados que se obtienen como solución de la ecuación de Schrodinger se llaman orbitales atómicos. El número cuántico principal (n) define el tamaño y el nivel de energía del orbital. Este número cuántico toma valores enteros. Cuanto mayor es n, mayor es el volumen del orbital. n = 1, 2, 3, 4, ….. El número cuántico azimutal (l) define la forma del orbital. Para cada valor de n, el número cuántico l puede tomar valores enteros entre cero y (n-1). l = 0, 1, 2, 3, 4, 5…. s p d f gh (n-1) ESTRUCTURA DE LA MATERIA ORBITALES ATÓMICOS El número cuántico magnético (ml) designa la orientación espacial del orbital. Este número cuántico puede tomar cualquier valor entero de (- l) hasta (+ l), pasando por cero: ml = (- l) ….0….(+ l) El número cuántico de espín (ms) designa la orientación de giro de un electrón y la orientación del campo magnético producido por este giro. Este número cuántico puede tomar los valores de + ½ y – ½. ESTRUCTURA DE LA MATERIA NÚMEROS CUÁNTICOS Y ORBITALES ATÓMICOS n l ml ms número Orbitales 1 0 0 +1/2, -1/2 1 2 0 0 1 -1, 0, +1 +1/2, -1/2 +1/2 1 3 1s para cada ml 3 0 1 0 +1/2, -1/2 -1, 0, +1 +1/2 -2, -1, 0, 1, +2 ídem 2s 2px, 2py, 2pz 1 3 3s 3px, 3py, 3pz 5 3dxy, 3dyz, 3dxz 3dx2-y2, 3dz2 para c/ ml 2 NOMBRE cantidad de electrones 2 8 18 ESTRUCTURA DE LA MATERIA DISTRIBUCIÓN DE LA PROBABILIDAD RADIAL La DISTRIBUCIÓN DE PROBABILIDAD RADIAL del electrón es la probabilidad de encontrar el electrón en un volumen diferencial dV de una capa esférica de radio r y espesor dr. Una forma alternativa de unir función de onda y probabilidad es calcular la probabilidad de encontrar al electrón en una esfera de radio r y espesor dr. El volumen de esta capa de espesor infinitesimal sería dV. ESTRUCTURA DE LA MATERIA DISTRIBUCIÓN DE LA PROBABILIDAD RADIAL La DISTRIBUCIÓN DE PROBABILIDAD RADIAL es la parte radial de la función de onda al cuadrado ψ2 multiplicada por el volumen de una capa esférica (4 π r2 dr). ESTRUCTURA DE LA MATERIA DISTRIBUCIÓN DE LA PROBABILIDAD RADIAL ESTRUCTURA DE LA MATERIA ORBITALES ATÓMICOS s 1s 2s 3s ESTRUCTURA DE LA MATERIA ORBITALES ATÓMICOS p ESTRUCTURA DE LA MATERIA ORBITALES ATÓMICOS d ESTRUCTURA DE LA MATERIA NÚMEROS CUÁNTICOS Y ORBITALES ATÓMICOS número Orbitales n l ml ms 1 0 0 +1/2, -1/2 1 1s 2 2 0 0 1 -1, 0, +1 +1/2, -1/2 +1/2 1 3 2s 2px, 2py, 2pz 8 para cada ml 3 0 1 0 -1, 0, +1 +1/2, -1/2 +1/2 1 3 para c/ ml 2 -2, -1, 0, 1, +2 ídem 5 NOMBRE cantidad de electrones 3s 3px, 3py, 3pz 3dxy, 3dyz, 3dxz 3dx2-y2, 3dz2 18 ESTRUCTURA DE LA MATERIA ENERGÍA DE LOS ORBITALES ATÓMICOS 5s 4d _ 4p energía 3s _ ___ 3d 4s _ 3p ___ 2p ___ 2s _ 1s _ _____ _____ ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA Llamamos configuración electrónica de un átomo en su estado fundamental a la expresión que indica la ubicación de los electrones en los orbitales. Para establecer la configuración electrónica de un átomo C.E. se utiliza el principio de construcción progresiva, conocido por la palabra alemana aufbau. El principio de construcción progresiva consiste en ubicar los electrones en un conjunto de orbitales de acuerdo a las siguientes reglas, ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA 1) MÍNIMA ENERGÍA Para escribir la C.E. de un átomo polielectrónico, los orbitales utilizados para describir su estado fundamental deben ser tales que la energía del átomo sea mínima. Por lo tanto, según esta regla, la configuración electrónica resultante de cada átomo es la que le da la menor energía y por lo tanto mayor estabilidad. ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA 2) PRINCIPIO DE EXCLUSIÓN DE PAULI Solo dos electrones pueden existir en el mismo orbital atómico y estos electrones deben tener espines opuestos (dos electrones en un átomo no pueden tener los mismos cuatro números cuánticos) 2He 1s2 1s2 1s2 ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA 3) REGLA DE HUND La distribución más estable de electrones en los subniveles es aquella que tenga mayor número de espines paralelos. 6C 1s2 2s2 2p ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA EXTERNA Los electrones más alejados del núcleo juegan un papel esencial en los procesos químicos, mientras que los de niveles interiores usualmente no intervienen. El conjunto del núcleo y los electrones que forman parte de los niveles internos, se denomina “core “ (corazón) del átomo, core = núcleo + electrones de niveles internos Los electrones del core de un átomo de un elemento, son los mismos que los del gas noble que le precede en la Tabla Periódica. Por ej., la C.E. del core del bromo es la misma que la del argón, C.E. (core Br) = [Ar] = 1s22s22p63s23p6 ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA EXTERNA La configuración electrónica de los electrones pertenecientes a los niveles más externos (fuera del core), constituye la configuración electrónica externa (C.E.E) de un elemento. Como regla para determinar la C.E.E. de un elemento, se escribe su C.E. simplificada y luego se elimina la C.E. del core y los orbitales d o f intermedios que están completos, con 10 y 14 electrones, respectivamente. Por ej., para el bromo, C.E. simplificada: [Ar] 4s23d104p5 Se elimina la C.E. del core y resulta: 4s23d104p5 se elimina el orbital d completo: 4s24p5 luego la C.E.E. del bromo es: 4s24p5 ESTRUCTURA DE LA MATERIA CONFIGURACIÓN ELECTRÓNICA EXTERNA C.E. simplificada elemento Z Potasio K 19 [Ar] 4s1 [Ar] 4s1 Titanio Ti 22 [Ar] 4s2 3d2 [Ar] 4s2 3d2 Bromo Br 35 [Ar] 4s2 3d10 4p5 [Ar] 4s2 4p5 Xenón Xe 54 [Ar] 5s2 4d10 5p6 [Ar] 5s2 5p6 Bismuto Bi 83 [Ar] 6s2 4f14 5d10 6p3 [Ar] 6s2 6p3 C.E. core C.E.E