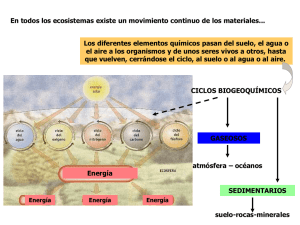
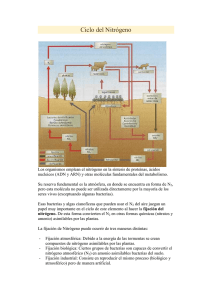
Bacterias fijadoras de nitrógeno en el comportamiento agronómico
Anuncio

Bacterias fijadoras de nitrógeno en el comportamiento agronómico del tomate Lycopersicon esculentum var. Río Grande Introducción Un elemento esencial para la sostenibilidad agrícola es el efectivo manejo del nitrógeno en el ambiente (Graham y Vance 2000). Seis mil millones de personas en la tierra consumen en promedio cerca de 11 g de nitrógeno por persona por día, o alrededor de 24 millones de toneladas por año (Fink et al. 1999). Es frecuente que en los suelos tropicales los bajos niveles de nutrientes disponibles para las plantas, principalmente los indispensables como el fósforo (P) y el nitrógeno (N), condicionen la productividad de los cultivos (Swift 1997). Este trabajo de investigación, bajo la dirección de los profesores Jaime Polanía (UN sede Medellín) y Judith Betancur (U. de Antioquia), surge de la necesidad de buscar nuevas herramientas para el desarrollo de cultivos en aquellos lugares, como el archipiélago de San Andrés, Providencia y Santa Catalina, donde el uso de fertilizantes químicos podría incrementar en niveles muy altos cualquier intento de producción agrícola y donde, además, la condición de Reserva de Biosfera 'Seaflower' limitaría su aplicación. Debido a que la deficiencia de N es común en los suelos tropicales y subtropicales (Graham 1981; Dakora y Keya 1997), el suministro, el manejo y el uso eficiente del nitrógeno continuará siendo un factor determinante en la producción vegetal en estas regiones, así como lo concerniente a la disponibilidad de reservas de petróleo para la producción de fertilizantes nitrogenados químicos en el futuro (Graham y Vance 2000). Además, existen graves daños ambientales asociados al uso desmedido de fertilizantes nitrogenados, que incluyen pérdidas de NOx a la atmósfera, lluvia ácida, lixiviado de nutrientes del suelo, cambios en el ciclo global del nitrógeno, y contaminación con nitratos de los cuerpos de agua (Kinzig y Socolow 1994; Vitousek et al. 1997). Dada la participación del N en el crecimiento y desarrollo de las plantas, los requerimientos de los cultivos por este elemento son altos, mientras que su contenido en los suelos tropicales no alcanza para cubrir estas necesidades, por lo cual se han desarrollado estrategias tecnológicas para suplementarlo total o parcialmente (Aguilar y Sánchez 1998). En muchas partes del mundo no se usan fertilizantes nitrogenados porque no están disponibles o cuestan demasiado. La alternativa ha sido aumentarlo en el suelo a través de la recolección, descomposición y distribución de desechos orgánicos (residuos vegetales y estiércol) que Por: Fáber Andrés González Pareja, estudiante de biología, U. de Antioquia 126 Bacterias fijadoras de nitrógeno en el comportamiento agronómico del tomate Lycopersicon esculentum var. Río Grande se incorporan antes de la siembra y/o la producción de cultivos de abono verde que tienen capacidad para fijar N (leguminosas), que se agregan al suelo antes de sembrar el cultivo principal. Estos métodos son demorados, no permiten el aprovechamiento al máximo de la tierra y, dadas las necesidades nutritivas de las variedades modernas de alto rendimiento, no suministran todo el N que necesitan para su máximo rendimiento potencial (Norman 1986). Así pues, la técnica más utilizada por el agricultor es la aplicación de fertilizantes químicos, lo cual incrementa los costos de producción, ya que representa aproximadamente el 5% de los gastos directos, sumado a su elevado costo ambiental (Aguilar y Sánchez 1998). Ahora bien, el alto uso de fertilizantes nitrogenados para maximizar la producción agrícola en el mundo desarrollado está sólo exacerbando el problema, mientras que en los países en desarrollo el costo de los fertilizantes y los problemas de distribución continúan siendo los mayores limitantes (Graham y Vance 2000). Existen muchos microorganismos viviendo en el suelo, especialmente en la rizósfera de las plantas. Es conocido, que un considerable número de bacterias y hongos poseen una relación funcional, constituyendo un sistema complejo con las plantas (Wu et al., 2005), y ejercen efectos benéficos sobre su crecimiento (Vessey, 2003). La aplicación de organismos en prácticas agrícolas comenzó 60 años atrás, y existe hoy en día evidencia creciente de que estas poblaciones microbianas benéficas pueden aumentar también la resistencia de las plantas a factores ambientales adversos, tensionantes, tales como deficiencias en agua y nutrientes, y contaminación con altas concentraciones de metales (Shen 1997). Un grupo de bacterias, conocidas como 'rizobacterias promotoras del crecimiento de las plantas' (PGPR), participan en muchos procesos ecológicos claves, tales como los relacionados con el control de patógenos vegetales, reciclaje de los nutrientes y el establecimiento de las semillas. Por esto despiertan atención particular para la agricultura y para propósitos forestales (Weller y Thomashow 1993; Glick 1995; Elo et al. 2000). Las rizobacterias promotoras del crecimiento vegetal pueden colonizar la rizósfera, la superficie de la raíz o también los espacios intercelulares de las plantas (McCully 2001). Los microorganismos del suelo, especialmente aquellos que habitan la rizósfera, desarrollan actividades de gran importancia en el crecimiento y nutrición de las plantas, entre las que cabe destacar la degradación de la materia orgánica, la fijación de nitrógeno, la producción de sustancias reguladoras del crecimiento vegetal y la solubilización de elementos minerales (Stewart 1991; Tate 2000; Luna et al. 2002). Desde hace mucho se sabe que algunos microorganismos libres y otros que tienen relaciones simbióticas, de dependencia mutua para sobrevivir, tienen capacidad para convertir el N del aire en amoníaco, que puede ser utilizado por otras plantas (Norman 1986). Esta actividad microbiana, denominada 'fijación biológica del nitrógeno' (FBN), es un componente principal del ciclo del N en la naturaleza, o la manera en la que regresa al suelo en forma combinada, que puede ser aprovechada por las plantas para reponer el que se perdió a la atmósfera por desnitrificación y otras causas (Norman 1986). En la agricultura moderna, la contribución de la FBN generalmente es eclipsada y no se considera tan importante como el uso de fertilizantes químicos, pero es vital en muchas partes donde no es posible obtener los fertilizantes nitrogenados (Norman 1986) o, como en el Departamento Archipiélago, su condición de Reserva de Biosfera limita severamente el empleo de fertilizantes químicos. El efecto benéfico de las bacterias de vida libre no sólo se debe a la cantidad de N2 fijado, sino también a la presencia de vitaminas y sustancias reguladoras de crecimiento (auxinas, giberelinas y citocininas). Por ejemplo A. chroococcum sintetiza tiamina, ácido nicotínico, ácido pantoténico, biotina y otras vitaminas (Aguilar y Sánchez 1998). Mediante su acción conjunta estas sustancias son capaces de estimular la germinación de las semillas y acelerar el crecimiento de las plantas, Cuadernos de Caribe Nº7 siempre que sea adecuada la concentración de microorganismos en el sistema radical (Aguilar y Sánchez 1998). Ha sido demostrado que el efecto de la fijación de nitrógeno inducida por fijadores no es importante solo para las leguminosas, sino también para las demás plantas (Doebereiner y Pedrosa 1987). Entonces, en el plano biológico una alternativa es el empleo de fijadores simbióticos como rizobios en asociación con leguminosas y existe también un potencial representado por las rizobacterias nitrofijadoras de vida libre (Aguilar y Sánchez 1998). En algunos países se han investigado las posibilidades de inocularlas en cultivos de importancia económica, entre ellos hortalizas, con incrementos en rendimiento (Aguilar y Sánchez 1998). Algunos ejemplos exitosos de la inoculación con rizobacterias promotoras del crecimiento vegetal han sido revisados tanto en laboratorio como en ensayos de campo (Wu et al. 2005). Por ejemplo, cepas de Pseudomonas putrida y P. fluorescens pudieron incrementar la elongación en la raíz y el tallo en lechuga y tomate (Hall et al. 1996; Glick et al. 1997). Los biofertilizantes son productos que contienen células vivas de diferentes tipos de microorganismos, los cuales tienen la habilidad de convertir importantes elementos nutricionales no disponibles (para la planta) en disponibles (para su uso por las plantas) a través de procesos biológicos (Hegde et al. 1999; Vessey 2003). En los últimos años, los biofertilizantes han emergido como importantes componentes de los sistemas integrales para suplir las necesidades nutricionales de las plantas, teniendo gran potencial para mejorar las producciones en las cosechas a través de un mejor suministro de los elementos nutricionales del medio (Wu et al. 2005). Sin embargo, en la práctica, en la aplicación de biofertilizantes no han sido reportados efectos constantes, además los mecanismos y las interacciones entre estos microorganismos aún no son bien conocidos, especialmente en lo que se refiere a las aplicaciones reales (Wu et al. 2005). La utilización de productos microbianos tiene un gran número de ventajas sobre los tratamientos químicos convencionales utilizados en la agricultura: (i) los productos microbianos son considerados seguros en comparación con muchos de los químicos usados hoy; (ii) ni las sustancias producidas por los microorganismos ni ellos por si mismos son acumulados en la cadena alimenticia; (iii) la auto reproducción de los microorganismos evita la necesidad de repetir aplicaciones; (iv) los organismos blanco raramente desarrollan resistencia como sí ocurre al usar agentes químicos para eliminar pestes dañinas para el crecimiento de la planta; y (v) ciertamente el desarrollo de agentes biocontroladores no es considerado perjudicial para los procesos ecológicos o para el ambiente (Weller 1988; Gloud 1990; Shen 1997). Teniendo en cuenta todo lo anterior, este trabajo pretende evaluar los efectos de bacterias fijadoras de N aisladas de las raíces y suelo del mangle en San Andrés isla (Colombia), en la promoción del crecimiento del tomate (Lycopersicon esculentum). El problema Tradicionalmente los cultivadores aplican fertilizantes sintéticos para compensar la deficiencia en suelos pobres en N. Sin embargo, su uso indiscriminado puede incrementar la salinidad y ocasionar grandes daños a la estructura de la microflora del suelo (Kapulnik et al. 1981, Banwari y Rao 1990, Akhavan et al. 1991, Nahid y Gomah 1991). Los sedimentos, junto con los microorganismos rizosféricos, son los componentes que más contribuyen a la productividad de los manglares (Alongi 1994). Debido a la diversidad de actividades microbiológicas existentes, el ecosistema de manglar está entre los tres ecosistemas más productivos conocidos (Bunt 1992). Así mismo, se ha publicado acerca de la inoculación de bacterias promotoras del crecimiento vegetal provenientes del ecosistema de manglar a las semillas del mangle para procesos de reforestación (Toledo et al. 1995; Bashan et al. 1998; Puente et al. 1999). 127 128 Bacterias fijadoras de nitrógeno en el comportamiento agronómico del tomate Lycopersicon esculentum var. Río Grande La rizósfera entonces, es una zona propicia para la búsqueda de microorganismos de uso potencial para proteger a las plantas y, a la vez, promover su crecimiento (biofertilizantes). Por lo tanto, el desafío principal consiste en conocer mejor las interfases suelo-raíz y suelo-semilla para favorecer las relaciones benéficas y minimizar las interacciones negativas con el fin de obtener un mejor desarrollo de los cultivos, afectando lo menos posible el ambiente (Medina 2001). En Colombia, la investigación en este campo se ha centrado principalmente en el aislamiento y caracterización de bacterias rizosféricas y endófitas, evaluación de hongos solubilizadores de fósforo, respuesta de poblaciones rizosféricas por efecto de diferentes tratamientos, medición de la actividad microbiana, aplicación de inoculantes específicos, efecto del manejo agronómico sobre el componente microbiológico, entre otros (Medina 2001). Pocos estudios sobre la diversidad bacterial en la rizósfera de plantas de ambientes salinos (halotolerantes) han sido publicados (Rueda et al. 2003). De éstos, la planta más estudiada es Spartina alterniflora (Lovell et al. 2000). Recientes estudios en biología molecular sobre la flora de la rizósfera de Spartina sp sugieren la presencia de un gran número de organismos no clasificados (Lovell et al. 2000, Nielsen et al. 2001). Es de gran importancia incrementar el número de bacterias halotolerantes, fijadoras de N conocidas (Hamdi 1999, Whipps 2000) como potenciales fuentes de biofertilizantes para la producción en áreas con suelos salinos. Todo esto, sumado a las restricciones del uso de fertilizantes químicos en el archipiélago de San Andrés, Providencia y Santa Catalina por su condición de reserva mundial de biosfera “SeaFlower”, realzan la necesidad de encontrar nuevas alternativas que permitan el desarrollo de una agricultura sostenible en el archipiélago. Recientemente inóculos de bacterias fijadoras de nitrógeno y microorganismos solubilizadores de fosfato, obtenidos a partir de muestras de rizósfera y suelos de mangle de San Andrés isla se evaluaron en cuanto a su efecto en la agilización de procesos de propagación y crecimiento vegetal de plántulas de mangle para fines de inserción y restauración en manglares deteriorados y en plantas de patilla en cultivo tradicional (Galindo 2004). De ahí que el objetivo de esta investigación sea determinar el efecto de la inoculación de estas bacterias fijadoras de N aisladas de la rizósfera y suelos de mangle de San Andrés, sobre algunos caracteres asociados al rendimiento de tomate, L. esculentum variedad Río Grande, y determinar las posibilidades de la fertilización nitrogenada mediante la inoculación con estas bacterias fijadoras como biofetilizantes. Se parte de que las plantas de tomate inoculadas con bacterias fijadoras de nitrógeno obtenidas a partir de muestras de rizósfera y suelos de mangle de San Andrés isla (Colombia), podrían presentar rendimientos significativamente superiores a los controles (plantas no inoculadas). Así mismo, que los rendimientos agronómicos en plantas sometidas a inoculación podrían ser comparables con los de plantas fertilizadas químicamente con nitrógeno. Para ello se propone evaluar la capacidad de inóculos de bacterias fijadoras de N obtenidas a partir de muestras de rizósfera y suelos de mangle de San Andrés isla (Colombia), como biofertilizantes efectivos en el cultivo del tomate L. esculentum variedad Río Grande. Para ello se parte de determinar la respuesta a la aplicación de los inóculos sobre algunos caracteres de plantas de tomate L. esculentum variedad Río Grande (altura, peso de materia seca de la parte aérea, área foliar, número y peso promedio de frutos, rendimiento promedio por planta y rendimiento total esperado) en San Andrés isla. De la misma manera se espera comparar los efectos producidos por la inoculación sobre el comportamiento agronómico de L. esculentum variedad Río Grande, con los del uso de fertilización química en las cantidades normalmente usadas en el cultivo comercial de esta especie. Se evaluará el efecto de la combinación de la inoculación con niveles de fertilizantes nitrogenados en el rendimiento del cultivo experimental, teniendo en cuenta que para una Cuadernos de Caribe Nº7 hectárea con 27.000 plantas se absorbe: nitrógeno (Urea, Nitron 2N, Sulfato de amonio): 50100 kg/ha; fósforo (DAP, MAP) P205: 150-200 kg/ha; potasio (Nitrato de potasio, Cloruro de potasio, Sulfato de Potasio) K20: 180-250 kg/ha (Vanegas, 2004). Se realizará la fertilización con NPK (triple 18) a razón de 600 kg/ha tomando este valor como el correspondiente a una fertilización completa. Por último, se espera definir el momento óptimo para realizar las inoculaciones en las plantas, llevando a cabo estas en tres épocas diferentes de su desarrollo: en la semilla, en el momento del transplante y 30 días después del transplante. Justificación Es de vital importancia hoy en día buscar nuevas alternativas para actividades productivas enmarcadas en modelos de desarrollo sostenible, más aún para algunas tan importantes como la agricultura y en áreas con condiciones especiales, como las reservas de biosfera. El desarrollo de biofertilizantes eficientes posibilita reemplazar la fertilización química y obtener productos agrícolas de una manera más amigable con el ambiente. La fragilidad del suelo del archipiélago, los altos costos de la importación de fertilizantes químicos y la restricción de su uso por la declaratoria del territorio como reserva de biosfera mundial 'Seaflower' por la UNESCO limitan la posibilidad de utilizar fertilización química para establecer cultivos con altos rendimientos. Además, su uso podría alterar el equilibrio ecológico del suelo insular, amenazando la sostenibilidad de los recursos naturales a largo plazo. Es claro entonces que, por muchas razones, el desarrollo del agro en el departamento debe enfocarse sobre un modelo de agroecología y ¿qué mejor manera que implementando tecnologías que involucren recursos renovables de la isla? Se plantea entonces probar la utilización de inóculos obtenidos a partir de muestras de rizósfera y suelos de mangle de San Andrés isla (Colombia), como biofertilizantes efectivos en el cultivo del tomate L. esculentum variedad Río Grande, uno de los cultivos de mayor importancia debido a su alto consumo en la región. Por otro lado muchos de los suelos que existen en el planeta presentan algún grado de salinidad que dificulta la actividad agrícola. Se evidencia entonces, la necesidad de encontrar soluciones que permitan el desarrollo de cultivos en estos suelos. La búsqueda de plantas de interés agrícola halotolerantes es vital para este propósito, como también lo es encontrar organismos benéficos para su cultivo que puedan crecer bajo estas condiciones de tensión. Dado que los organismos utilizados en esta investigación fueron aislados de raíces y suelos de mangle y, por lo tanto, son en algún grado halotolerantes, la investigación respecto a sus cualidades como biofertilizante permitiría determinar un futuro uso de estos inóculos en suelos salinos como los de donde son originarios y para los cuales están adaptados. Metodología El trabajo se realizará en la Institución Educativa CEMED “Antonia Santos” en San Andrés isla o, eventualmente, en terrenos prestados por la Corporación Universidad Cristiana. Las bacterias fijadoras de N se aislaron en trabajos anteriores (Vanegas, 2004) a partir de la rizósfera y suelos de mangle en San Andrés isla, y son fermentados en el IBUN (Instituto de Biotecnología Universidad Nacional de Colombia, sede Bogotá) de donde serán obtenidos estos inóculos. El aislamiento y caracterización de las bacterias fue llevado a cabo en el trabajo de Vanegas (2004) y se describió de la siguiente manera: el aislamiento de estas bacterias fijadoras de nitrógeno atmosférico se fundamentó en la siembra en caldos de cultivo sin fuente de nitrógeno o medio Nfb (Nitrogen Free Broth), en el cual sólo crecen los organismos que poseen el sistema enzimático que les permita reducirlo y utilizarlo en su metabolismo. Para ello, se siguió el protocolo 129 130 Bacterias fijadoras de nitrógeno en el comportamiento agronómico del tomate Lycopersicon esculentum var. Río Grande de aislamiento propuesto por Döbereiner (1994), estandarizado por Valero (2000) y con las modificaciones sugeridas por Holguín et al.(1992). Las muestras fueron sembradas en medio de cultivo semisólido Nfb, colocando por triplicado raicillas de 1cm de largo, las cuales fueron incubadas a 30°C hasta la aparición de un crecimiento denso o la formación de una película superficial o subsuperficial (Döbereiner, 1994). Posteriormente, se efectuaron repiques en el mismo medio semisólido a partir de los tubos que presentaron formación de la película característica o turbidez, con la finalidad de agotar en lo posible el nitrógeno que se pudiera haber agregado con la muestra al ser sembrada, favoreciendo el crecimiento de microorganismos eficientes en la fijación del elemento atmosférico (Valero, 2003). Para el aislamiento de colonias puras, a partir de los tubos que conservaron el crecimiento típico de los microorganismos, se efectuó una siembra por agotamiento por triplicado (Valencia, 2004) en el mismo medio de cultivo selectivo, pero sólido con el fin de obtener por separado cada uno de los morfotipos de colonia. Se registró ausencia-presencia de los morfotipos encontrados, se efectuaron repiques en agar nutritivo con adición de 2% de cloruro de sodio para mantenimiento de las cepas, y luego cada morfotipo fue cultivado nuevamente en el medio semisólido selectivo, con el fin de determinar los responsables de la formación de la película característica y de mayor crecimiento. Dichos aislamientos fueron seleccionados para realizar posteriormente el ensayo de reducción de acetileno y comprobar la actividad de la enzima nitrogenasa, según Lozano (1998). Para la caracterización de los aislamientos se efectuaron tinciones de Gram y diferenciales, descripción macroscópica de colonias, se emplearon pruebas bioquímicas de utilización de sustratos según Koneman (1987) y paneles de detección rápida de microorganismos BBL Cristal para identificación. En esta investigación se trabajará solo con la cepa de Azotobacter vinelandii (G10), que se obtendrá mediante proceso de fermentación en pequeña escala en el Instituto de Biotecnología de la Universidad Nacional de Colombia utilizando extracto de levadura 4 g/L, NaCl 1g/L, KH2PO4 4 g/L, pH 7,0; BSF2, caldo nutritivo 8 g/L, pH 8,0, con un volumen de fermentación de 1.0L. Este inoculante se envasará asépticamente en envases de vidrio color ámbar herméticamente sellados, se mantendrá refrigerado durante su envío a San Andrés isla hasta iniciar su aplicación en plántulas y semillas para llevar a cabo las pruebas de promoción de crecimiento vegetal sobre plántulas de tomate (L. esculentum) variedad Río Grande. El diazótrofo G10 fue seleccionado por presentar la más alta actividad nitrogenasa, su rápido crecimiento sobre el medio de cultivo Nfb-g, su fácil identificación morfológica en Nfb g y el amplio reconocimiento de éste género como bacteria promotora de crecimiento vegetal (Vanegas, 2004). Este morfotipo fue descrito por Vanegas (2004) con crecimiento abundante en incubación a 35°C por 24 horas en medio Nfb glucosa manitol. Colonias transparentes en forma de gota de agua, con bordes completos, elevación convexa y forma circular, de aproximadamente 2 mm. En Agar Nutritivo al 2%de NaCl cambia su forma tornándose blanca y desminuyendo su tamaño a 1 mm. Como características microscópicas señaló que son bacilos Gram negativos con cápsula algunos agrupados en pares. En este trabajo se utilizarán semillas de la variedad de tomate Río Grande debido a sus características de buen rendimiento, resistencia a algunas enfermedades y por ser apto para crecer al nivel del mar. El tomate Rió Grande es una planta con nueva arquitectura, más dinámica en la absorción y transporte de nutrientes entre su estructura fisiológica, de temprana floración y excelente calidad de frutos; esta variedad es resistente a Stemphyllium spp, Leveillula sp y tolerante a Phytopthora infestans y Alternaria spp, y es muy difícil de observar hojas manchadas en los estados iniciales y solo ataques muy fuertes de enfermedades pueden traer consigo los síntomas característicos (Vanegas 2004). La raíz alcanza gran profundidad y expansión lateral, Cuadernos de Caribe Nº7 hábil en absorber nutrientes y tolerante a nematodos, Fusarium spp y Verticillium (Vanegas 2004). Así pues, la resistencia a enfermedades, las cosechas tempranas, los frutos compactos y pesados son característicos de esta variedad, pero la planta requiere de niveles de fertilidad un poco altos (Vanegas 2004). Para el ensayo preliminar para evaluar la concentración del inoculante se usará como medio de cultivo base para el crecimiento bacteriano: 4g/l de extracto de levadura, 0.5 g/l NaCl y 4 g/l de KH2PO4. A 250 ml de medio de cultivo base se le agregarán 2 ml de preparado bacteriano con 24 horas de crecimiento en caldo nutritivo al 2% NaCl. Esta solución se mantendrá en agitación continua a 120 rpm a temperatura ambiente por 25 horas. Después de las cuales se efectuarán diluciones desde 10-5 hasta 10-9 con las soluciones bacterianas y se sembrarán en cajas de Petri, con el fin de conocer las unidades formadoras de colonias bacterianas por mililitro que se aplican en cada dilución. Las lecturas se efectuarán a las 48 horas de siembra. Después de esto se procederá a imbibir las semillas. Las semillas serán tratadas para desinfección superficial lavándolas con una solución de hipoclorito de sodio comercial al 5% por dos minutos y enjuagándolas varias veces con agua corriente. Luego, serán lavadas con alcohol al 70% por un minuto, enjuagada con agua destilada y finalmente, con agua destilada estéril. Se procederá a imbibir las semillas por una hora. Las semillas testigo se imbibirán en agua destilada estéril. Las semillas se sembrarán en sustrato artificial de arena con fertilización pobre (150 kg de NPK/ ha) en N, en macetas individuales. Se utilizará un diseño completamente al azar con 10 repeticiones por tratamiento. Se evaluará porcentaje de emergencia de las semillas sembradas y a los 30 días se medirá la altura de la planta, peso seco parte aérea, peso seco de raíces y área foliar. La dilución con la que se obtenga la mejor respuesta en las variables evaluadas en este ensayo se convertirá en la base para la producción del inoculante a aplicar en los posteriores ensayos. Para evaluar la germinación natural de la semilla se colocarán 30 semillas desinfectadas e inoculadas en cajas de Petri con fondos dobles de círculos de toallas de papel con 10 ml de agua destilada, previa esterilización del montaje por autoclave. Se depositarán semillas imbibidas por una hora en agua destilada estéril (testigo) y en la dilución bacteriana seleccionada para los ensayos en campo, 30 semillas/condición. Las cajas se mantendrán bajo condiciones de oscuridad a 28°C por cuatro días, después de los cuales se transplantarán a los montajes. Los semilleros a utilizar en este ensayo serán macetas plásticas con suelo del lugar de cultivo, se sembrarán tres semillas/maceta y se hará raleo posterior. Las plántulas se mantendrán en penumbra por 10 días y luego a plena exposición solar hasta los 45 días, cuando se llevarán al campo para trasplante. En este momento se evaluará el número de plantas emergidas/maceta/ tratamiento. En campo se empleará un diseño en bloques al azar con nueve tratamientos y 20 plantas por tratamiento (cuadro 1). Cuadro 1. Diseño de bloques al azar para los experimentos de inoculación. Testigos Fertilización completa (FC). Fertilización media (F/2). Sin fertilización (NO). Inoculación con Bfn Semilla (S). Trasplante (T). 30 días después de trasplante (30DT) Inoculaciones con Bfn + fertilización química Semilla más fertilización media (S F/2). Trasplante más fertilización media (T F/2). 30 días después de trasplante más fertilización media (30DT F/2). 131 132 Bacterias fijadoras de nitrógeno en el comportamiento agronómico del tomate Lycopersicon esculentum var. Río Grande El experimento será llevado a cabo en una parcela de dimensiones aproximadas de 130 m2, con surcos de 10 m de largo, con distancias de 1 m entre surcos y 0,5 m entre plantas. En los tratamientos que llevarán inoculación de semillas, éstas se imbibirán durante una hora en la dilución bacteriana seleccionada en el ensayo previo. Las semillas de los testigos serán imbibidas en agua destilada. Para las inoculaciones al trasplante y 30 días después se le aplicarán 20 ml/ planta de la dilución bacteriana. Para los tratamientos con fertilización química, se realizarán tres aplicaciones de NPK (Triple 18): a los ocho días de trasplante; 15 días después y al momento de floración. En la fertilización media se aplicarán 15g/planta (300kg/ha de NPK) y en la denominada completa, el doble se esta cantidad. Los problemas de plagas y enfermedades que se pueden presentar en el ciclo serán manejados con monitoreos frecuentes. Ello permite un uso racional de productos y una producción más sostenible en el largo plazo. Se realizarán labores de tutorado, amarres y deschuponadas; se utilizará el sistema de poda a dos ramas. El riego será por gravedad con una frecuencia de dos riegos/semana. La cosecha se hará manualmente, escogiendo solo los frutos maduros de cada planta dos veces por semana hasta recoger todos. Las variables a evaluar en el experimento serán: número de frutos por planta, peso promedio de frutos (g), rendimiento por planta (g/planta), rendimiento total estimado (t/ha). Se realizará análisis de varianza para cada variable, usando el paquete estadístico SAS y prueba de Duncan. Para confrontar efectos de los tratamientos se empleará comparaciones planeadas: x x x x C1: S vs T vs 30DT: se compara cuál es el momento más propicio cuando se inocula una vez. C2: S F/2 vs T F/2 vs 30DT F/2: Compara una inoculación en diferentes momentos durante el ensayo con fertilización media. C3: S F/2 + T F/2 vs FC + F/2: efecto de momento de inoculación durante el ensayo y fertilización media versus fertilización media y completa (testigos). C4: S F/2 vs F/2: efecto de la fertilización media cuando se hace una inoculación a la semilla, y efecto de una inoculación bacteriana contra fertilización completa. Resultados esperados x Se espera comprobar la efectividad de los inóculos de bacterias fijadoras de nitrógeno aisladas de las raíces y suelos de mangle de San Andrés isla (Colombia), como biofertilizantes que permitan prescindir en alguna medida de la fertilización química como único medio para obtener resultados en el rendimiento agronómico del tomate (L. esculentum) que hagan esta actividad más rentable en la región. x Se espera obtener una metodología de inoculación efectiva para ser aplicada posteriormente en cultivos comerciales de esta especie.