modelos atómicos
Anuncio
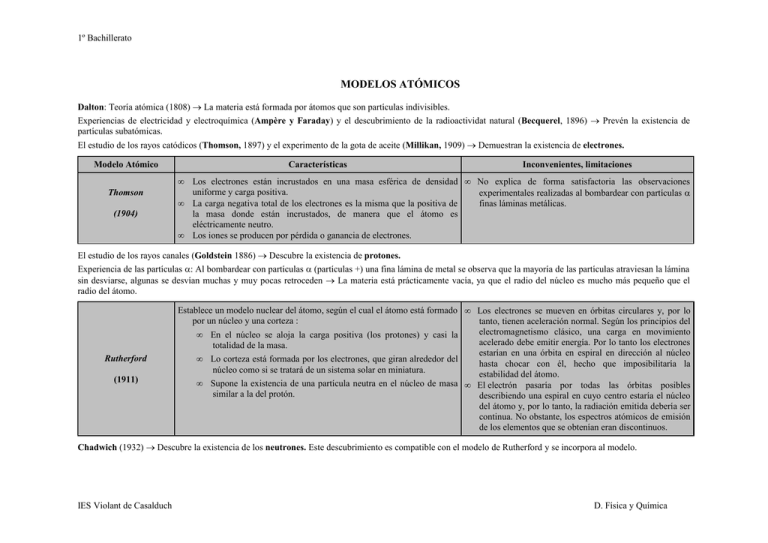
1º Bachillerato MODELOS ATÓMICOS Dalton: Teoría atómica (1808) → La materia está formada por átomos que son partículas indivisibles. Experiencias de electricidad y electroquímica (Ampère y Faraday) y el descubrimiento de la radioactividat natural (Becquerel, 1896) → Prevén la existencia de partículas subatómicas. El estudio de los rayos catódicos (Thomson, 1897) y el experimento de la gota de aceite (Millikan, 1909) → Demuestran la existencia de electrones. Modelo Atómico Características • Thomson (1904) • • Inconvenientes, limitaciones Los electrones están incrustados en una masa esférica de densidad • No explica de forma satisfactoria las observaciones uniforme y carga positiva. experimentales realizadas al bombardear con partículas α La carga negativa total de los electrones es la misma que la positiva de finas láminas metálicas. la masa donde están incrustados, de manera que el átomo es eléctricamente neutro. Los iones se producen por pérdida o ganancia de electrones. El estudio de los rayos canales (Goldstein 1886) → Descubre la existencia de protones. Experiencia de las partículas α: Al bombardear con partículas α (partículas +) una fina lámina de metal se observa que la mayoría de las partículas atraviesan la lámina sin desviarse, algunas se desvían muchas y muy pocas retroceden → La materia está prácticamente vacía, ya que el radio del núcleo es mucho más pequeño que el radio del átomo. Rutherford (1911) Establece un modelo nuclear del átomo, según el cual el átomo está formado • Los electrones se mueven en órbitas circulares y, por lo por un núcleo y una corteza : tanto, tienen aceleración normal. Según los principios del electromagnetismo clásico, una carga en movimiento • En el núcleo se aloja la carga positiva (los protones) y casi la acelerado debe emitir energía. Por lo tanto los electrones totalidad de la masa. estarían en una órbita en espiral en dirección al núcleo • Lo corteza está formada por los electrones, que giran alrededor del hasta chocar con él, hecho que imposibilitaría la núcleo como si se tratará de un sistema solar en miniatura. estabilidad del átomo. • Supone la existencia de una partícula neutra en el núcleo de masa • Εl electrón pasaría por todas las órbitas posibles similar a la del protón. describiendo una espiral en cuyo centro estaría el núcleo del átomo y, por lo tanto, la radiación emitida debería ser continua. No obstante, los espectros atómicos de emisión de los elementos que se obtenían eran discontinuos. Chadwich (1932) → Descubre la existencia de los neutrones. Este descubrimiento es compatible con el modelo de Rutherford y se incorpora al modelo. IES Violant de Casalduch D. Física y Química 1º Bachillerato El estudio de los espectros atómicos de los diferentes elementos indica que son discontinuos. Los elementos en estado gaseoso emiten radiación de forma discontinúa. La Teoría cuántica de Planck (1900): Los cuerpos emiten o absorben energía forma de paquetes o cuantos de energía E = h · ν. El efecto fotoeléctrico: Fenómeno que consiste en el desprendimiento de electrones por parte de un átomo cuando incide una radiación electromagnética de una frecuencia determinada. Einstein (1905) explica el efecto fotoeléctrico utilizando la teoría cuántica de Planck, considerando que la radiación electromagnética está formada por cuantos de energía, que llama fotones. Bohr (1913) 1. Postulado: Los electrones giran alrededor del núcleo en órbitas circulares • Los avances en espectroscopía mostraron nuevas rayas sin emitir energía (órbitas estacionarias). (desdoblamientos) en los espectros que el modelo de 2. Postulado: Sólo son posibles las órbitas en las que la energía adopta unos Borh no lograba explicar. Por lo que Sommerfeld valores determinados. A estas órbitas se las llama niveles de energía y se modificó el modelo de Bohr introduciendo la posibilidad las representa por la letra n. (Las órbitas más cercanas al núcleo tienen de que las órbitas, además de circulares pudieran ser una menor energía.) elípticas, para lo cual introduce un segundo número 3. Postulado: Cuando un electrón pasa de una órbita superior a una órbita cuántico. Pese a lo cual hay líneas inexplicables en los inferior, la diferencia de energía entre ambos órbitas se emite forma de espectros. radiación electromagnética y se absorbe en efecto contrario. • Nada más explicaba satisfactoriamente el espectro del hidrógeno. Hipótesis de de Broglie (1924): Introduce la dualidad onda- partícula. Las partículas materiales tienen propiedades ondulatorias, y por ello, cualquiera partícula lleva asociada una onda. Los electrones se comportan como las ondas y como partículas. El principio de incertidumbre de Heisemberg (1927): Es imposible conocer de forma exacta y simultánea, la posición y velocidad de una partícula. Por tanto, es imposible predecir la trayectoria exacta del electrón. Modelo mecanocuántico (1926) IES Violant de Casalduch • • • • Describe al electrón como una onda que vibra entorno al núcleo. • Limita su aplicación a átomos de un sol electrón, los otros átomos nada más son tratables a partir de las Establece el concepto de orbital, en contraposición con las órbitas aproximaciones a la solución de la ecuación. exactas del modelo de Borh. Un orbital atómico es la zona del espacio donde hay una gran probabilidad de encontrar el electrón con una energía determinada. Al resolver la ecuación que nos describe el movimiento del electrón aparecen los cuatro números cuánticos y se justifica la discontinuidad de los niveles energéticos observada en los espectros. D. Física y Química