Descenso del punto de congelación de un disolvente (descenso
Anuncio

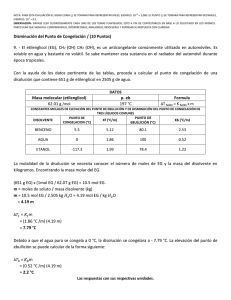
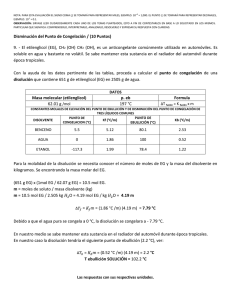
Recopilación, adaptación y diseño : MC. Rosalba Patiño Herrera Agosto del 2006 D escenso del punto de congelación de un disolvente (descenso crioscópico) y determinación del peso molecular Objetivo La determinación de la masa molecular de una sustancia a partir del descenso que su adición causa en el punto de congelación de un disolvente. Introducción teórica. Es un hecho experimental que el punto de congelación de un disolvente se rebaja por la adición de un soluto. La teoría de disoluciones ideales (aplicable a disoluciones reales muy diluidas) indica que dicho descenso puede expresarse por medio de la siguiente ecuación: RT02 M 1 m ∆T f = 1000∆H f donde ∆T f es el descenso del punto de congelación, m es la concentración molal del soluto, ∆H f es el calor molal de fusión del disolvente, M1 es la masa molecular del disolvente, R la constante de los gases y T0 es el punto de congelación del disolvente puro. El factor 1000 aparece como consecuencia del ajuste de unidades. Todos los términos encerrados dentro del paréntesis en la ecuación anterior son cantidades que dependen sólo del disolvente e independientes de la temperatura por lo que la ecuación se puede escribir, simplificando: ∆T f = k f m siendo Kf la llamada constante crioscópica molal o constante molal del punto de congelación, que puede determinarse experimentalmente midiendo el descenso en la temperatura de congelación del disolvente causado por una disolución de soluto en concentración 1 molal. También puede hallarse si se conocen las constantes englobadas en el paréntesis de la primera ecuación. Dado que en el laboratorio no resulta conveniente utilizar 1000 g. de disolvente, la ecuación anterior se escribe : ∆T f = k f w2 1000 M 2 w1 En esta ecuación, w2 es el número de gramos de soluto de masa molecular M2 disuelto en w1 gramos de disolvente. Despejando M2 se obtiene: k w 1000 M2 = f 2 ∆T f w1 Recopilación, adaptación y diseño : MC. Rosalba Patiño Herrera Agosto del 2006 ecuación que se utiliza para la determinación de la masa molecular por el método del descenso del punto de congelación. Para usarla, se obtiene experimentalmente el descenso del punto de congelación producido por la adición de w2 gramos de soluto a w1 gramos de disolvente, datos que con la constante crioscópica del disolvente se sustituyen en la última ecuación. Debe recalcarse que en el desarrollo anterior se ha partido de una ecuación, solamente válida para disoluciones suficientemente diluidas del soluto, por lo que las cantidades a emplear de éste serán, comparativamente, mucho menores que las del disolvente. En la Tabla siguiente se dan valores para las constantes crioscópicas de algunos disolventes que se pueden utilizar para la determinación del peso molecular de sustancias desconocidas, junto con sus puntos de congelación en estado puro. TABLA Disolvente Punto de congelación (ºC) Kf Agua 0.00 1.86 Benceno 5.50 5.12 Ácido acético 16.7 3.90 Alcanfor 178.0 37.7 El método anterior es válido en aquellos solutos que en disolución no presentan ninguna tendencia a asociarse, formando dímeros. Si éste fuera el caso, la técnica proporcionaría un peso molecular promedio de las especies presentes en disolución. Este hecho puede utilizarse para determinar el grado de dimerización que en disolución presentan sustancias polares como, por ejemplo, el ácido benzoico. PARTE EXPERIMENTAL Aparatos y reactivos Cubeta aislante térmica Probeta de 100 mL Tubo de ensaye Matraz Erlenmeyer de 250 ml Cronómetro o reloj con minutero Agua destilada Benceno Naftaleno Termómetro Hielo Sal de mesa Procedimiento Prepárese en el vaso grande que se suministra una mezcla frigorífica, llenando casi todo él con hielo, adicionando un puñado de sal de cocina y completando con un poco de agua, de forma que la mezcla pueda agitarse. Comprobar con la sonda termométrica que el conjunto agua, sal y hielo está a unos –3/-5 ºC. Si no se ha llegado a esa temperatura, adicionar más sal y agitar. Recopilación, adaptación y diseño : MC. Rosalba Patiño Herrera Agosto del 2006 La primera etapa de este procedimiento es determinar el punto de congelación del disolvente puro. Se pipetea al aparato 50 mls. de disolvente (benceno). Se debe tener la precaución de anotar la temperatura del laboratorio en ese momento. Tanto el recipiente de vidrio en el que se vierte el benceno como la pipeta deben estar absolutamente secos. En su interior se introduce la termómetro, también bien seca. Se puede enfriar previamente el disolvente sumergiéndolo directamente en la mezcla frigorífica hasta que su temperatura sea del orden de 15 ºC. Debe tomarse la precaución de que el termómetro no toque ni el fondo ni las paredes del recipiente de vidrio que contiene al benceno. Se agita suave pero continuamente el disolvente durante toda la determinación del punto de congelación. Se lee y anota la temperatura cada 20 segundos. El disolvente puro constituye un sistema de un solo componente y, por consiguiente, hay una temperatura única a la cual pueden coexistir en equilibrio sólido y líquido. Probablemente tendrá lugar un ligero sobreenfriamiento (ver figura) ya que la cristalización no comienza hasta que la temperatura haya descendido un poco por debajo de la del punto de solidificación, esto es, la disolución se sobre enfría, pero una vez tiene que lugar la formación de núcleos cristalinos, el calor latente de cristalización tiende a elevar la temperatura hasta un valor constante, que indica que sobreviene la congelación. Una vez concluido el proceso, se saca del hielo el matraz, se funde el disolvente calentándolo con la mano sin la camisa hasta unos 12ºC y se repite la experiencia. Con el disolvente nuevamente en estado líquido, se introduce en él una muestra de soluto (naftaleno) cuyo peso exacto, con cuatro cifras decimales, debe anotarse y estar comprendido entre 0.2900 y 0.3100 gramos. Una vez disuelta la muestra se determina el punto de congelación de la disolución de la misma manera que para el disolvente puro. Al contrario que el disolvente puro, la disolución no tiene por qué dar un punto de congelación constante, ya que a medida que congela el benceno, la disolución remanente va aumentando su concentración, con lo que la solidificación de más benceno desde esas disoluciones de creciente concentración va siendo diferente. Este descenso continuaría hasta que se alcance el punto eutéctico, temperatura a la que se solidifica la disolución entera. Sin embargo, ese progresivo descenso de la temperatura de congelación es muy lento y nosotros nos quedaremos con el primer patrón de temperatura, que nos indica la congelación del benceno desde la disolución que nosotros hemos preparado. Repetir también la experiencia con la disolución, operando como lo hemos hecho con el disolvente. Recopilación, adaptación y diseño : MC. Rosalba Patiño Herrera Agosto del 2006 Se representarán las curvas de enfriamiento obtenidas, para observar la forma de estas curvas y comprobar la existencia de sobreenfriamiento en la curva de la disolución. Se obtendrá un valor medio de los descensos crioscópicos obtenidos y se calculará el peso molecular con ayuda de la ecuación correspondiente. Para calcular la masa de disolvente empleado tendremos en cuenta los c.c. pipeteados y la densidad del mismo a la temperatura existente en el laboratorio cuando aquel se pipeteó. Si se emplea benceno, su densidad en g/ml. a t grados centígrados cumple la ecuación: ρ = 0.879 − 0.001(t − 20) Si se emplea otro disolvente, consultar el Handbook. Calculada la masa molecular es interesante que el estudiante repita el cálculo variando el descenso crioscópico en una centésima de grado (el mínimo error esperable en la determinación de la temperatura) y así comprobar la precisión en la masa molecular determinada. Interpretación de resultados 1. Informa el punto de congelación de la solución. 2. Indica el descenso crioscópico observado en esta solución. 3. Calcula la molalidad de la solución que preparaste. 4. Calcula el descenso crioscópico teórico para la solución preparada. Propuesta para discusión 1. ¿Qué son propiedades coligativas de las soluciones? 2. Cita tres ejemplos de propiedades de las soluciones que no dependan del tipo de partículas de soluto. 3. ¿Qué es la molalidad de una solución? 4. ¿Qué sucede con el potencial químico de una sustancia líquida pura cuando se le agrega un soluto no volátil?. 5. ¿Qué consecuencias trae esto sobre las propiedades del disolvente?. 6. ¿Qué sucede con las propiedades coligativas si el soluto no volátil agregado es de naturaleza iónica?. 7. ¿Qué es la constante crioscópica y como se calcula?. 8. ¿Cuál expresión matemática relaciona la masa molar del soluto con el abatimiento de la temperatura de congelación del disolvente?.