NÚMEROS DE OXIDACIÓN (no) MÁS FRECUENTES
Anuncio
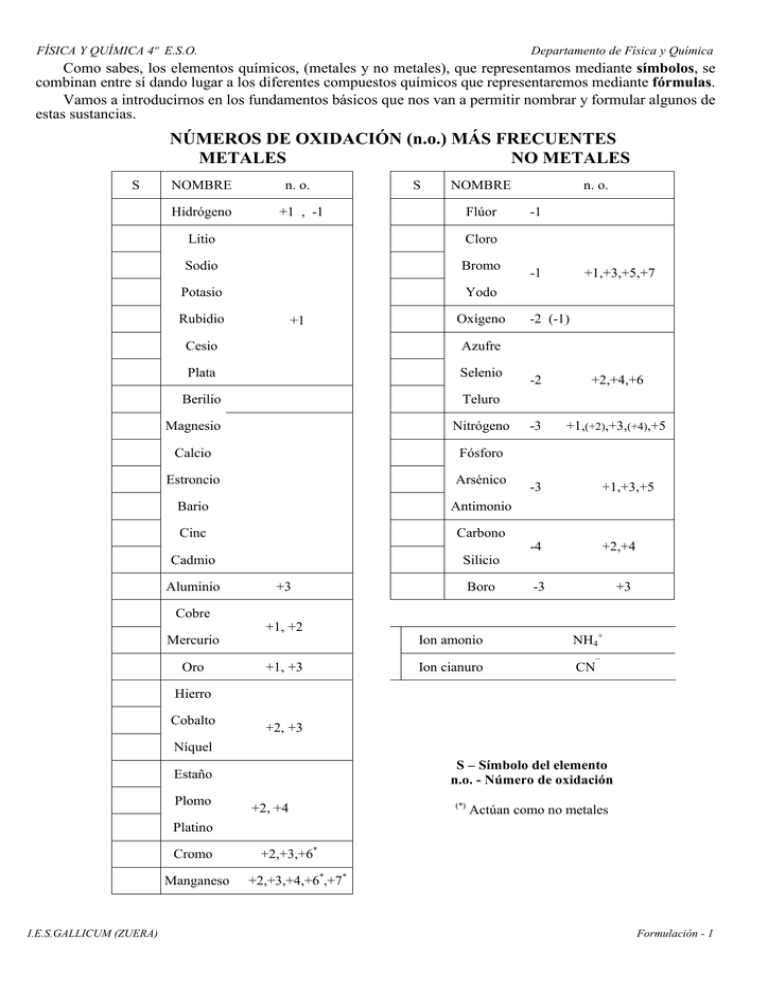
FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química Como sabes, los elementos químicos, (metales y no metales), que representamos mediante símbolos, se combinan entre sí dando lugar a los diferentes compuestos químicos que representaremos mediante fórmulas. Vamos a introducirnos en los fundamentos básicos que nos van a permitir nombrar y formular algunos de estas sustancias. NÚMEROS DE OXIDACIÓN (n.o.) MÁS FRECUENTES METALES NO METALES S NOMBRE n. o. Hidrógeno +1 , -1 S NOMBRE Flúor Litio Cloro Sodio Bromo Potasio Yodo Rubidio +1 Oxígeno Cesio Azufre Plata Selenio Berilio Teluro Magnesio Nitrógeno Calcio Fósforo Estroncio Arsénico Bario Antimonio Cinc Carbono Cadmio Silicio Aluminio +3 Boro n. o. -1 -1 +1,+3,+5,+7 -2 (-1) -2 +2,+4,+6 -3 +1,(+2),+3,(+4),+5 -3 +1,+3,+5 -4 +2,+4 -3 +3 Cobre +1, +2 Mercurio Oro +1, +3 Ion amonio NH4+ Ion cianuro CN¯ Hierro Cobalto +2, +3 Níquel S – Símbolo del elemento n.o. - Número de oxidación Estaño Plomo +2, +4 (*) Actúan como no metales Platino Cromo Manganeso I.E.S.GALLICUM (ZUERA) +2,+3,+6* +2,+3,+4,+6*,+7* Formulación - 1 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química REGLAS BÁSICAS DE FORMULACIÓN (Los n.o. (Números de Oxidación) son cargas ficticias que se les asignan a los átomos de los elementos según una serie de normas y representa la diferencia entre los electrones del átomo neutro y los que se le conceden dentro de una especie química). 1.- El número de oxidación de un elemento libre es 0 2.- El número de oxidación del oxígeno es-2 (salvo en los peróxidos que es de –1) 3.- El Hidrógeno actúa con +1 excepto en los hidruros metálicos que lo hace con –1 4.- El número de oxidación de un elemento que posee varios en un determinado compuesto es tal que la suma algebraica de los números de oxidación de todos los átomos de los elementos de dicho compuesto sea 0 * Ejemplo: En H2SO4 el número de oxidación del S es +6, el del H +1 y el del O –2 de forma que 1+ 6 + 2H2 S O4 queda: 2(+1) + 1(+6) + 4(-2) = 0 5.- El número de oxidación de un elemento en un ion poliatómico (formado por vario átomos) es tal que la suma algebraica de los números de oxidación de todos los átomos presentes coincida con la carga total de dicho ion. * Ejemplo. En el ion H2PO41- los números de oxidación de los distintos elementos presentes son: 1+ 5+ 2− 1− ( H 2 P O4 ) H(+1), P(+5) y O(-2) de forma que: 2(+1) + 1(+5) + 4(-2) = -1 Indica los números de oxidación de los elementos que se encuentran presentes en las siguientes sustancias: a) Cl2O7 b) PbO2 c) Fe d) Al(OH)3 e) HI f) CaMnO4 g) Fe2(CO3)3 h) SO42- i) NH4+ j) Cr2O72- k) H2 COMPUESTOS BINARIOS Son aquellos que están formados por dos elementos diferentes. Se escribirá en primer lugar (y con n.o. positivo) el elemento que figure antes en la tabla siguiente: (Tabla 1) Metales, B, Si, C, Sb, As, P, N, H, Te, Se, S, I, Br, Cl, O, F ÓXIDOS METÁLICOS Combinaciones de un metal (Me con n.o. positivo) con el oxígeno (n.o. 2-) . (Óxidos básicos) x+ 2 − FORMULACIÓN: Me O (se intercambian sin signo los n.o.) → Me 2 O x (y se simplifica si es posible) NOMENCLATURA: ∗ Metal con 1 n.o. → ÓXIDO DE (Me) (Me)...OSO (Me con n.o. menor) ∗ Metal con 2 n.o. → Tradicional) ÓXIDO (Me)...ICO (Me con n.o. mayor) → Stock) ÓXIDO DE (Me) (n.o. metal en n os romanos) → Sistemática) prefijoÓXIDO DE prefijo(Me) Prefijos (indican los átomos de cada elemento): mono, di, tri, tetra, penta, exa, hepta, … 2+ 2- Ejemplo: I) Ca O → (Ca2O2) CaO Óxido de calcio 3+ 2- II) Fe O → Fe2O3 Óxido férrico, óxido de hierro (III), trióxido de dihierro. ÓXIDOS NO METÁLICOS Combinaciones de un no metal (NMe) con el oxígeno. (Óxidos ácidos – anhídridos) I.E.S.GALLICUM (ZUERA) Formulación - 2 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química x+ 2− NMe O → NMe 2 O x (Simplificar si es posible) FORMULACIÓN: HIPO ...(NMe)...OSO 3 (NMe)...OSO 4 NOMENCLATURA: → Tradicional) ANHÍDRIDO 2 (NMe)...ICO PER ...(NME) ... ICO → Stock) ÓXIDO DE (NMe) (n.o. no metal en n OS romanos) → Sistemática) prefijoÓXIDO DE prefijo(NMe) 4+ 2- Ejemplo: SeO → (Se2O4) SeO2 (mono)selenio. anhídrido selenioso, óxido de selenio (IV), dióxido de Al nombrar todos los compuestos binarios que se citarán a continuación terminará en URO el que se escriba en segundo lugar HIDRUROS METÁLICOS Formados por el hidrógeno y un metal (Me). El H actúa con número de oxidación 1x + 1− FORMULACIÓN: Me H → MeH x NOMENCLATURA: ∗ Metal con 1 n.o. → HIDRURO DE (Me) → (Me)...OSO Tradicional) HIDRURO (Me)...ICO Stock) HIDRURO DE (Me) (n.o. metal en nº romanos) → Sistemática) prefijoHIDRURO DE prefijo(Me) ∗ Metal con 2 N.O. → Ejemplo: AlH3 Hidruro de aluminio. CoH3 Hidruro cobáltico, hidruro de cobalto (III) o trihidruro de cobalto. HIDRUROS NO METÁLICOS Compuestos formados por un no metal (NMe) y el hidrógeno. Distinguimos entre dos grupos de no metales: GI) los que se encuentran antes que el hidrógeno (H) en la Tabla 1 y GII) los situados después. • GI) H con B, Si, C, Sb, As, P y N x- FORMULACIÓN: 1+ NMe H → NMeH x NOMENCLATURA: → Tradicional) Borano, Silano, Metano, Estibina, Arsina, Fosfina y Amoniaco → Sistemática) prefijoHIDRURO DE (NMe) • GII) H con F, Cl, Br, I, S, Se y Te 1+ FORMULACIÓN x− H NMe → H x NMe NOMENCLATURA : → Tradicional) ÁCIDO (NMe)HÍDRICO (disueltos en agua) → Sistemática) (NMe)URO DE HIDROGENO I.E.S.GALLICUM (ZUERA) Formulación - 3 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química SALES BINARIAS A) Sales formadas por un metal (Me n.o. +) y un nometal (NMe n.o. negativo) y− x+ FORMULACIÓN Me NMe → Me y NMe x (Simplificar si es posible) NOMENCLATURA Metal con 1 n.o. → (NMe)URO DE (Me) OSO Metal con 2 n.o. • Tradicional) (NMe)URO (Me) ICO • Stock) (NMe)URO DE (Me)(n.o. metal en n os romanos) • Sistemática) prefijo(NMe)URO DE prefijo(Me) Ejemplo A: Fluoruro de calcio CaF2 (El metal sólo tiene un N.O.) Ejemplo B: Ni2Te3 Telururo niquélico, telururo de níquel (III) o Tritelururo de diníquel B) Combinaciones entre dos no metales Se escribe en primer lugar (NMe1) el nometal que figura antes en la Tabla 1 y al nombrarlos y− x+ FORMULACIÓN NMe(1) NMe(2) → NOMENCLATURA → → NMe(1) y NMe(2) x Tradicional) No se utiliza Stock) (NMe2)URO DE (NMe1) (n.o. NMe1 en n os romanos) → Sistemática) prefijo(NMe2)URO DE prefijo(NMe1) terminará en URO el nometal situado más a la derecha en dicha tabla Ejemplo A: NCl3 Cloruro de nitrógeno (III) o Tricloruro de nitrógeno Ejemplo B: Pentacloruro de yodo, ICl5 , qué también podría nombrarse . . . . . . . . . . . . . COMPUESTOS TERNARIOS Formados por tres elementos diferentes. HIDRÓXIDOS Formados por un metal (o grupo positivo como el NH4+) y por el grupo (OH)1x+ FORMULACIÓN: 1− Me OH → Me(OH) x NOMENCLATURA: ∗ Metal con 1 n.o. → HIDRÓXIDO DE (Me) (Me)oso Tradicional) HIDRÓXIDO (Me)ico → Stock) HIDRÓXIDO DE (Me) (n.o. metal en n os rom.) ∗ Metal con 2 n.o. → → Sistemática) prefijoHIDRÓXIDO DE (Me) Ejemplo A: Sr(OH)2 Hidróxido de estroncio Ejemplo B: Sn(OH)2 Hidróxido estannoso, hidóxido de estaño (II) o dihidróxido de estaño I.E.S.GALLICUM (ZUERA) Formulación - 4 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química ÁCIDOS OXÁCIDOS Compuestos formados por hidrógeno, un elemento con carácter no metálico y oxígeno. * Este curso sólo vamos a estudiar los más elementales y los formularemos de la manera Tradicional Podemos considerarlos formados al unirse los óxidos no metálicos (anhídridos) con agua. Óxido no metálico + agua → Ácido FORMULACIÓN: Anhídrido + agua → Ácido (simplificar si se puede) NOMENCLATURA: Sólo vamos a emplear la Tradicional Se nombran igual que el anhídrido del que provienen sustituyendo la palabra ANÍDRIDO por la de ÁCIDO. Ejemplo. Anhídrido nítrico + Agua → Ácido nítrico (simplificar) N2O5 + H2O → (H2N2O6) → HNO3 Ácidos del cromo y manganeso. Cuando actúan con sus números de oxidación más elevados estos elementos poseen carácter no metálico y por lo tanto pueden formar ácidos y sales. * Cromo (6+): Ácido crómico H2CrO4 (6+): Ácido dicrómico H2Cr2O7 (7+): Ácido permangánico HMnO4 * Manganeso (6+): Ácido mangánico H2MnO4 (1) 1+ Para ayudarte a formular y nombrar la mayoría de los ácidos que vamos a “trabajar” este curso, te proponemos la siguiente tabla: 3+ 5+ 7+ FÓRMULA H NMe O H NMe O2 H NMe O3 H NMe O4 (1) 2+ 4+ 6+ FÓRMULA H2 NMe O2 H2 NMe O3 H2 NMe O4 (1) n.o. (+) del NMe Ejemplo A: Si queremos nombrar H2SO3 observando la tabla comprobamos que el NMe (S en nuestro caso) actúa con el número de oxidación (n.o.) 4+. Como el S puede actuar con 2+ (hipo…oso), 4+ (…oso) o 6+ (…ico) nuestro compuesto será el ÁCIDO SULFUROSO Ejemplo B: Formular el ÁCIDO CLOROSO. El NMe (Cl en este caso) puede actuar con los N.O. 1+ (hipo…oso), 3+ (…oso), 5+ (…ico) y 7+ (per…ico). Por lo tanto la fórmula del compuesto solicitado será HClO2 SALES DE LOS OXÁCIDOS Las sales, en general, resultan de sustituir hidrógenos de los ácidos por metales. (Sales neutras) xX HIDRÓGENO (S) METAL ( y + ) FORMULACIÓN: ÁCIDO − → (ANIÓN) + → 2−2 HIDRÓGENOS + Fe ( 3 + ) Ejemplo: H2SO4 → (SO4) → Fe2(SO4)3 (Me)x(ANIÓN)y NOMENCLATURA. Se sustituyen las terminaciones …OSO e …ICO de los ácidos de procedencia por …ITO y …ATO, respectivamente. (Se mantienen los prefijos si los hubiera) ...ITO → Me con 1 n.o.: ÁCIDO (prefijo)(NMe) de (Me) ...ATO I.E.S.GALLICUM (ZUERA) Formulación - 5 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química ...ITO ...OSO → Me con 2 n.o. Tradicional) ÁCIDO (prefijo)(NMe) (Me) ...ATO ...ICO ...ITO Stock) ÁCIDO(prefijo)(NMe) DE (Me) (n.o. Me en nos romanos) ...ATO Ejemplo A: Formular Carbonato de sodio. - Los carbonatos provienen del ácido carbónico que es el H2CO3 2− 2 H+ - Obtenemos el anión H2CO3 → (CO3) - Intercambiamos (sin signo) las cargas del metal (sodio) y del anión (simplificando si se puede) Na+ (CO3) 2- → Na2CO3 Ejemplo B: Nombrar Sr(NO2)2 / Como el N actúa con n.o.. 3+ (el 2º n.o. de 3) el ácido del que deriva al sal es el ác. Nitroso por lo que la sal será un Nitrito de estroncio Fe2(SO4)3 / El S actúa con n.o. 6+ y el Fe con 3+ por lo tanto los nombres de la sal serán Sulfato férrico o sulfato de hierro (III). I.E.S.GALLICUM (ZUERA) Formulación - 6 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química EJERCICIOS SOBRE FORMULACION Y NOMENCLATURA DE QUIMICA INORGÁNICA 1.- Combinaciones binarias con oxígeno (Las que puedas, nómbralas de todas las formas posibles) 1. Óxido de potasio a. BeO 2. Óxido ferroso b. Cl2O3 3. Óxido de cloro (V) c. Ag2O 4. Óxido de plomo (II) d. CO2 5. Anhídrido peryódico e. SeO3 6. Óxido de cinc f. NiO 7. Dióxido de teluro g. PtO 8. Óxido cuproso h. N2O5 9. Anhídrido brómico i. Sb2O3 10. Trióxido de dicobalto j. Au2O 11. Óxido de mercurio (II) k. Rb2O 12. Óxido de fósforo (III) l. SrO 13. Óxido de magnesio m. As2O 14. Dióxido de azufre n. B2O3 15. Óxido de silicio (IV) o. I2O5 2.- Combinaciones binarias con hidrógeno: 1. Hidruro de rubidio - a. BaH2 / 2. Hidruro niqueloso - b. CuH / 3. Ácido bromhídrico - c. PH3 / 4. Arsina - d. H2Te / 5. Hidruro estannoso - e. PtH4 / 6. Ácido selenhídrico - f. AlH3 / 7. Hidruro de oro (III) - g. PtH2 / 8. Hidruro de cadmio - h. CsH / I.E.S.GALLICUM (ZUERA) Formulación - 7 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química 3.- Compuestos binarios con hidrógeno o con oxígeno 1. Óxido de cesio a. ZnO 2. Anhídrido sulfuroso b. H2S 3. Óxido de bromo (I) c. KH 4. Óxido de estaño (IV) d. SiO2 5. Hidruro niquélico e. Cu2O 6. Ácido clorhídrico f. CO 7. Trióxido de selenio g. SeO 8. Óxido cuproso h. NH3 9. Hidruro de magnesio i. As2O5 10. Hidruro de platino (IV) j. Au2O3 4.- Combinaciones metal-no metal. a.- Seleniuro de rubidio - 1.- MgI2 - b. Dicloruro de hierro - 2.- BaF2 - c.- Nitruro de calcio - 3.- SnTe - d.- Fosfuro de oro (III) - 4.- Hg2C - e.- Tribromuro de cobalto - 5.- NiB - f.- Arseniuro de plata - 6.- AuSb - g.- Yoduro aluminio 7.- CoSe h.- Sulfuro de plomo (IV) 8.- NaF 5.- Formula o nombra, cuando corresponda, los siguientes compuestos: 1- Hidruro de calcio 1. Hg2O 2- Dihidruro de hierro 2. FeCl3 3- Oxido de Iodo (VII) 3. PbS2 4- Oxido de dicloro 4. Br2O 5- Oxido niquélico 5. LiH 6- Oxido de plomo (IV) 6. BaO 7- Anhídrido perclórico 7. CH4 8- Óxido de litio 8. H2S 9- Trihidruro de arsénico 9. PH3 10- Hidruro de magnesio 10. CoO I.E.S.GALLICUM (ZUERA) Formulación - 8 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química 11- Óxido de oro (III) 11. SO 12- Cloruro de bario 12. P2O5 13- Anhídrido sulfúrico 13. Li2S 14- Trióxido de teluro 14. CDBr2 15- Oxido de selenio (II) 15. SnCl2 16- Fluoruro de estroncio 16. AuH3 17- Sulfuro mercúrico 17. HgH2 18- Hidruro de cobre (II) 18. ZnH2 19- Nitruro de plata 19. HCl 20- Anhídrido hipocloroso 20. H2Te 21- Óxido de estroncio 21. HI 22- Carburo de aluminio 22.As2O3 23- Ácido yodhídrico 23. SiO2 24- Pentacloruro de fósforo 24. TeO2 25- Bromuro estánnico 25. K3Sb 26- Trióxido de dinitrógeno 26.Ni3Sb2 27- Oxido de antimonio (V) 27. NH3 28- Anhídrido carbónico 28. Fe2O3 6.- Nombra (o formula) los siguientes hidróxidos: 1. Hidróxido de sodio 8. RbOH 2. Hidróxido de aluminio 9. AuOH 3. Hidróxido de estaño (IV) 10. Cd(OH)2 4. Trihidróxido de níquel 11. Hg(HO)2 5. Hidróxido cúprico 12. Mn(OH)3 6. Hidróxido de cromo (II) 13. Zn(OH)2 7. Hidróxido de cesio 14. NH4OH 7 .- Escribe o formula los ácidos que se te indican a continuación: 1. Ácido sulfúrico - a. HIO 2. Ácido nítrico - b. HMnO4 3. Ácido carbónico - c. H2CrO4 4. Ácido arsenioso - d. H2SiO3 I.E.S.GALLICUM (ZUERA) Formulación - 9 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química 5. Ácido hipocloroso - e. HBrO3 6. Ácido selénico - f. HBr 7. Ácido bromoso - g. HSbO2 8. Ácido sulfhídrico - h. H2Cr2O7 9. Ácido sulfúrico - i. HI 8.- Nombra (de todas las formas posibles) los siguientes compuestos: 1. Br2O7 2. Sr(OH)2 3. BH3 4. H2TeO3 5. HF 6. Hg3N 7. KOH 8. SeO2 9. Cu(OH)2 10. HNO2 11. FeH2 12. H2SO4 13. Sb2O3 14. AlN 15. HClO 16. CsOH 17. H2MnO4 18. MgO 19. Ni2O3 20. Au(OH)3 21. Br2O3 22. BeF2 23. Al2O3 24. HPO3 25. PbS2 I.E.S.GALLICUM (ZUERA) Formulación - 10 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química 26. CH4 27. HgOH 28. SiH4 29. Ni4C3 30. HAsO2 9.- Formula o nombra las siguientes oxisales: 1.- Nitrato de cesio 14.- NaClO 2.- Bromato de bario 15.- SrCO3 3.- Clorito de aluminio 16.- CsNO2 4.- Carbonato de sodio 17.- Co(IO4)3 5.- Sulfato de cinc 18.- Al2(SeO3)3 6.- Fosfato de hierro (III) 19.- Sn(SbO3)4 7.- Nitrito mercúrico 20.- NH4NO3 8.- Peryodato de platino (IV) 21.- PbSO4 9.- Selenito de magnesio 22.- CaMnO4 10.- Permanganato niqueloso 23.- Ca(MnO4)2 11.- Dicromato de oro (III) 24.- CuCr2O7 12.- Manganato plúmbico 25.- Cu2Cr2O7 13.- Silicato de amonio 26.- Pb(TeO3)2 10.- Indica la fórmula de los siguientes compuestos: 1. Hidróxido de cinc 21. Oxido de yodo (VII) 2. Estibina 22. Trióxido de selenio 3. Tricloruro de fósforo 23. Anhídrido antimónico 4. Nitruro de magnesio 24. Sulfito de cinc 5. Oxido de hierro (III) 25. Cloruro de bario 6. Anhídrido sulfuroso 26. Nitrato de plata 7. Fluoruro de estroncio 27. Hidruro de magnesio 8. Sulfuro de cobalto (II) 28. Anhídrido hiposulfuroso 9. Acido clorhídrico 29. Fosfato de cinc 10. Hidróxido cúprico 30. Carbonato de rubidio 11. Acido nitroso 31. Nitruro férrico 12. Acido fluorhídrico 32. Selenito de amonio I.E.S.GALLICUM (ZUERA) Formulación - 11 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química 13. Clorato de oro (I) 33. Hipobromito cúprico 14. Seleniato mercúrico 34. Tetrahidruro de estaño 15. Acido antimonioso 35. Yoduro de aluminio 16. Trióxido de dibromo 36. Carburo de plata 17. Carbonato de aluminio 37. Metano 18. Hipoclorito de cadmio 38. Ácido sulfhídrico 19. Antimoniato estánnico 39. Hidróxido de sodio 20. Cloruro de plomo (IV) 40. Nitrito de litio 11.- Nombra: a.- CuCl2 b.- TeO2 c.- Rb2O d.- NiSe e.- HgH f.- Pt(OH)4 g.- HSbO2 h.- HBrO3 i.- NH4OH j.- Cr2O3 k.- HAsO3 l.- Ag2TeO3 m.- SrSO4 n.- Sn(MnO4)2 o.- MgCr2O7 p.- Hg(IO4)2 r.- H2CrO4 s.- Cd(IO)2 t.- HPO3 u.- SF6 I.E.S.GALLICUM (ZUERA) Formulación - 12 FÍSICA Y QUÍMICA 4º E.S.O. Departamento de Física y Química Ejercicio A 1. Ácido selenioso Ejercicio B 1. Au2O 2. Ácido antimónico 2. Ca(OH)2 3. Ácido silícico 3. LiH 4. Telururo de plomo (II) 4. H2SeO4 5. Ácido hipobromoso 5. HAsO2 6. Ácido telúrico 6. K2MnO4 7. Clorito de rubidio 7. HgNO3 8. Nitrito de cadmio 9. CuSeO3 9. Antimoniato de cobre (II) 8. Cs3As 8. Nitrato de estroncio 9. CuSeO3 10. Carbonato ferroso 10. HgIO3 11. Ácido hipofosforoso 11. Fe(ClO2)3 12. Bromato de cinc 12. Na2SO4 13. Sulfito de berilio 13. N2O3 14. Carbonato de oro (III) 14. Pb(OH)4 15. Hipoyodito de plata 15. I2O7 16. Manganato de sodio 16. PH3 17. Ácido yódico 17. SnTeO2 18. Nitrato de estroncio 18. CoCr2O7 19. Silicato de aluminio 19. Sr3Sb2 20. Sulfuro de niquel (III) 20. PtO I.E.S.GALLICUM (ZUERA) Formulación - 13



