Proteínas de fusión
Anuncio
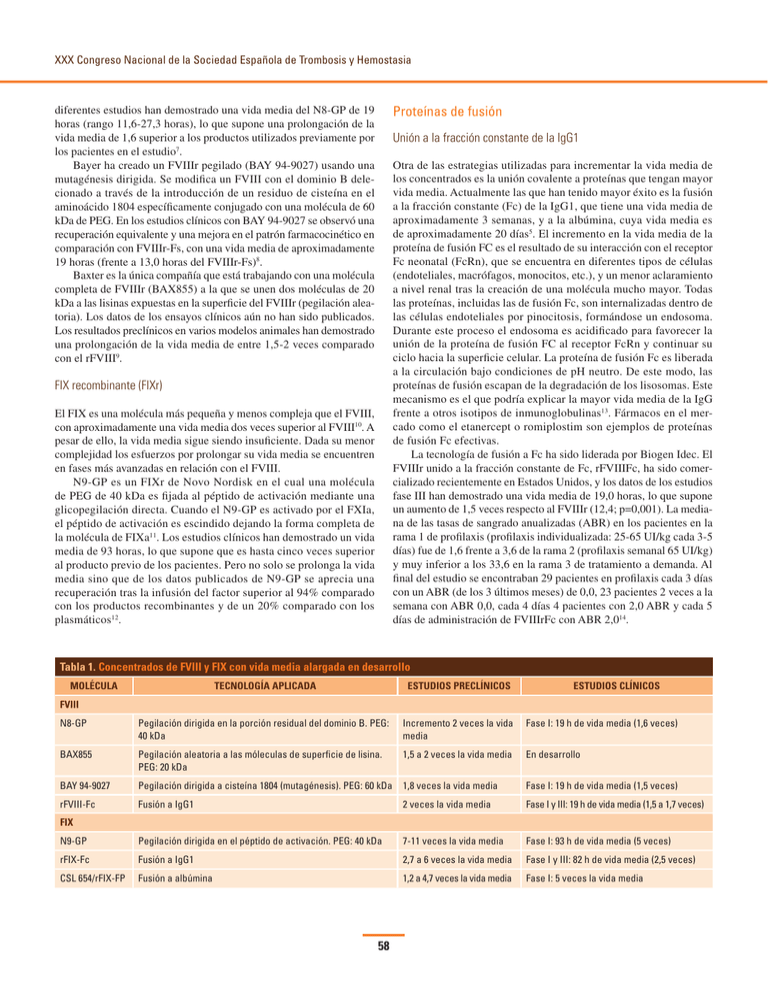
XXX Congreso Nacional de la Sociedad Española de Trombosis y Hemostasia Proteínas de fusión diferentes estudios han demostrado una vida media del N8-GP de 19 horas (rango 11,6-27,3 horas), lo que supone una prolongación de la vida media de 1,6 superior a los productos utilizados previamente por los pacientes en el estudio7. Bayer ha creado un FVIIIr pegilado (BAY 94-9027) usando una mutagénesis dirigida. Se modifica un FVIII con el dominio B delecionado a través de la introducción de un residuo de cisteína en el aminoácido 1804 específicamente conjugado con una molécula de 60 kDa de PEG. En los estudios clínicos con BAY 94-9027 se observó una recuperación equivalente y una mejora en el patrón farmacocinético en comparación con FVIIIr-Fs, con una vida media de aproximadamente 19 horas (frente a 13,0 horas del FVIIIr-Fs)8. Baxter es la única compañía que está trabajando con una molécula completa de FVIIIr (BAX855) a la que se unen dos moléculas de 20 kDa a las lisinas expuestas en la superficie del FVIIIr (pegilación aleatoria). Los datos de los ensayos clínicos aún no han sido publicados. Los resultados preclínicos en varios modelos animales han demostrado una prolongación de la vida media de entre 1,5-2 veces comparado con el rFVIII9. Unión a la fracción constante de la IgG1 Otra de las estrategias utilizadas para incrementar la vida media de los concentrados es la unión covalente a proteínas que tengan mayor vida media. Actualmente las que han tenido mayor éxito es la fusión a la fracción constante (Fc) de la IgG1, que tiene una vida media de aproximadamente 3 semanas, y a la albúmina, cuya vida media es de aproximadamente 20 días5. El incremento en la vida media de la proteína de fusión FC es el resultado de su interacción con el receptor Fc neonatal (FcRn), que se encuentra en diferentes tipos de células (endoteliales, macrófagos, monocitos, etc.), y un menor aclaramiento a nivel renal tras la creación de una molécula mucho mayor. Todas las proteínas, incluidas las de fusión Fc, son internalizadas dentro de las células endoteliales por pinocitosis, formándose un endosoma. Durante este proceso el endosoma es acidificado para favorecer la unión de la proteína de fusión FC al receptor FcRn y continuar su ciclo hacia la superficie celular. La proteína de fusión Fc es liberada a la circulación bajo condiciones de pH neutro. De este modo, las proteínas de fusión escapan de la degradación de los lisosomas. Este mecanismo es el que podría explicar la mayor vida media de la IgG frente a otros isotipos de inmunoglobulinas13. Fármacos en el mercado como el etanercept o romiplostim son ejemplos de proteínas de fusión Fc efectivas. La tecnología de fusión a Fc ha sido liderada por Biogen Idec. El FVIIIr unido a la fracción constante de Fc, rFVIIIFc, ha sido comercializado recientemente en Estados Unidos, y los datos de los estudios fase III han demostrado una vida media de 19,0 horas, lo que supone un aumento de 1,5 veces respecto al FVIIIr (12,4; p=0,001). La mediana de las tasas de sangrado anualizadas (ABR) en los pacientes en la rama 1 de profilaxis (profilaxis individualizada: 25-65 UI/kg cada 3-5 días) fue de 1,6 frente a 3,6 de la rama 2 (profilaxis semanal 65 UI/kg) y muy inferior a los 33,6 en la rama 3 de tratamiento a demanda. Al final del estudio se encontraban 29 pacientes en profilaxis cada 3 días con un ABR (de los 3 últimos meses) de 0,0, 23 pacientes 2 veces a la semana con ABR 0,0, cada 4 días 4 pacientes con 2,0 ABR y cada 5 días de administración de FVIIIrFc con ABR 2,014. FIX recombinante (FIXr) El FIX es una molécula más pequeña y menos compleja que el FVIII, con aproximadamente una vida media dos veces superior al FVIII10. A pesar de ello, la vida media sigue siendo insuficiente. Dada su menor complejidad los esfuerzos por prolongar su vida media se encuentren en fases más avanzadas en relación con el FVIII. N9-GP es un FIXr de Novo Nordisk en el cual una molécula de PEG de 40 kDa es fijada al péptido de activación mediante una glicopegilación directa. Cuando el N9-GP es activado por el FXIa, el péptido de activación es escindido dejando la forma completa de la molécula de FIXa11. Los estudios clínicos han demostrado un vida media de 93 horas, lo que supone que es hasta cinco veces superior al producto previo de los pacientes. Pero no solo se prolonga la vida media sino que de los datos publicados de N9-GP se aprecia una recuperación tras la infusión del factor superior al 94% comparado con los productos recombinantes y de un 20% comparado con los plasmáticos12. Tabla 1. Concentrados de FVIII y FIX con vida media alargada en desarrollo MOLÉCULA TECNOLOGÍA APLICADA ESTUDIOS PRECLÍNICOS ESTUDIOS CLÍNICOS N8-GP Pegilación dirigida en la porción residual del dominio B. PEG: 40 kDa Incremento 2 veces la vida media Fase I: 19 h de vida media (1,6 veces) BAX855 Pegilación aleatoria a las móleculas de superficie de lisina. PEG: 20 kDa 1,5 a 2 veces la vida media En desarrollo BAY 94-9027 Pegilación dirigida a cisteína 1804 (mutagénesis). PEG: 60 kDa 1,8 veces la vida media Fase I: 19 h de vida media (1,5 veces) rFVIII-Fc Fusión a IgG1 2 veces la vida media Fase I y III: 19 h de vida media (1,5 a 1,7 veces) N9-GP Pegilación dirigida en el péptido de activación. PEG: 40 kDa 7-11 veces la vida media Fase I: 93 h de vida media (5 veces) rFIX-Fc Fusión a IgG1 2,7 a 6 veces la vida media Fase I y III: 82 h de vida media (2,5 veces) CSL 654/rFIX-FP Fusión a albúmina 1,2 a 4,7 veces la vida media Fase I: 5 veces la vida media FVIII FIX 58






