Diagramas de fases - ingeniería ciclo básico
Anuncio

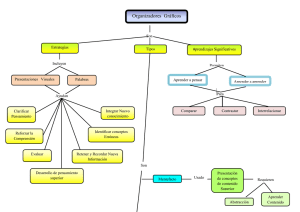
Republica Bolivariana de Venezuela Ministerio del Poder Popular para la Educación Universitaria Universidad Nacional Experimental Rafael María Baralt Programa: Ingeniería y tecnología Proyecto: Ingeniería de Gas Asignatura: Ciencia de los materiales Profesor: Roger Chirinos Diagramas de fases Integrantes: Martínez Gerardo 21.211.159 Colina Alexis 21.211.379 Daboin Jeannaly 21.428.522 Rivera Emili 21.429.623 Gutierrez Angely 23.882.902 Esquema INTRODUCCIÓN. Diagrama de fase. Definición. Características. Diagrama de fases isomorfos. Diagrama de fase eutécticos. Composición de cada fase. Regla de la palanca. Diagrama de equilibrio estructura interna. CONCLUSION. INTRODUCCION Para dar comienzo damos referencia sobre el Diagrama de Fase que es un producto del equilibrio energético en el proceso de cambiar una fase de la muestra o el proceso de cambiar de estado de cada sustancia involucrada donde básicamente es la combinación de muchos de los materiales sólidos que son un conjunto de estructuras con propiedades físicas que son útiles para nuestro entorno y nos ayudan a formar parte en la función de una composición y sirven para el estudio de soluciones a diferentes composiciones en diferentes temperaturas. ´ DIAGRAMA DE FASES. Los materiales en estado sólido pueden estar formados por varias fases. La combinación de estas fases define muchas propiedades que tendrá el material. Por esta razón, se hace necesario tener una herramienta teórica que permita describir las fases que estarán presentes en el material. Esa herramienta teórica se llama “Diagrama de fase” que podemos definir desde el punto de vista micro estructural a una fase como parte homogénea de un material que difiere en composición, estado o estructura. En el caso del agua pura, tenemos tres fases. Representamos su diagrama. En el caso de la congelación del agua (procese del hielo) tenemos dos fases a 0ºC, la líquida y la sólida. Tenemos tres líneas importantes en este diagrama. 1º Línea de Solidificación. 2º Línea de Vaporación. 3º Línea de Sublimación. Y la unión de las tres creas este punto mágico donde coexisten las tres fases. Se le denomina punto triple. Pero si el punto es mágico, más lo es el propio diagrama. Las fases solidas en un material tienen las siguientes características: Los átomos que forman la fase tienen la misma estructura o arreglo atómico La fase tiene la misma composición química en todo su volumen. Presentan las mismas propiedades físicas. Posee una interface definida con su entorno. Diagrama de fases binario (Isomorfos) Para definir una isoterma del porcentaje en peso de cada elemento, representada en la imagen por el segmento L-S. Esta línea se traza horizontalmente desde la temperatura de composición de una fase hasta la otra (en este caso desde el líquido al sólido). El porcentaje en peso del elemento B en el líquido viene dado por wl y en el sólido por ws. El porcentaje de sólido y líquido puede ser calculado usando las siguientes ecuaciones, que constituyen la regla de la palanca: % peso de la fase sólida % peso de la fase líquida Donde wo es el porcentaje en peso del elemento B en el sistema. Diagrama binario con fases sólida y líquida, con la representación de la isoterma (LS). Diagrama de fase eutécticas. La composición eutéctica presenta el punto de solidificación más bajo de todo el sistema y por lo tanto la temperatura eutéctica es la temperatura más baja a la cual puede existir alguna porción de fase liquida. Si prosigue el enfriamiento a partir de este punto, todo el liquido que quede (que tendrá composición eutéctica) solidifica formando simultáneamente las dos posibles fases solidas, α y β. Se da la circunstancia de que para una determinada composición existe una estabilidad asombrosa en estado líquido y por tanto se "retarda" el proceso de solidificación. Veamos esto en un diagrama Si el componente es puro (a la izquierda del diagrama), la temperatura de fusión (TA) es aprox 1380ºC. Para B puro (a la derecha del diagrama) la fusión tiene lugar a 1485ºC. Si añadimos algo de B a A, por ejemplo, un 20% ( flecha roja) la temperatura de fusión (cristalización) se acerca a los 1360ºC. Hemos conseguido reducir la temperatura a la que empieza la solidificación Para una mezcla de 60% (flecha azul) en B, tenemos un proceso parecido. Cuando la concentración, para esta aleación, es del 50%, tenemos la temperatura más baja, dando lugar al punto Eutéctico. Composición de cada fase. Cada fase tiene una composición expresada en porcentaje en peso (% en peso). Cuando en la aleación está presente una sola fase, su composición es igual a la de la aleación, y si se modifica la composición original de la aleación se modifica entonces la composición de la fase. Sin embargo, cuando coexisten dos fases como liquido y sólido, sus composiciones diferirán entre sí como de la composición general original. Si esta cambia ligeramente, la composición de las dos fases no se afectará, siempre que la temperatura se conserve constante. Esta diferencia queda explicada por la regla de fases de Gibbs. Regla de la palanca. Es una herramienta para determinar el porcentaje en peso de cada fase en un diagrama de fases binario. Se usa para determinar el porcentaje en peso de las fases líquida y sólida de un sistema binario composición-temperatura entre líquido y sólido. En regiones de una sola fase, la cantidad de la fase simple es 100%. En regiones Bifásicas, sin embargo, se deberá calcular la cantidad de cada fase. Una técnica es hacer un balance de materiales. Se puede utilizar la regla de la palanca en cualquier región bifásica de un diagrama de fases binario. En regiones de una fase no se usa el cálculo de la regla de la palanca puesto que la respuesta es obvia (existe un 100% de dicha fase presente). Diagramas de Fase de Equilibrio. Los diagramas de equilibrio de fase son mapas (por ejemplo, en el espacio temperatura-presión o temperatura-composición) de las fases estables de un material en función de las condiciones de P, T y composición. Ejemplo diagrama de fase (Agua). CONCLUSION Finalmente de lo expuesto anteriormente hemos llegado a la conclusión de que el Diagrama de Fase es de gran importancia ya que mediante el encontramos los diferentes tipos de estados de un material que son sistemas que van en función de todas las fases de cambios que representan determinadas condiciones de presión, temperatura y composición que a partir de estos diagramas podemos obtener informaciones rápidamente de cual podemos obtener satisfactorios resultados que van en función de los equilibrios de este sistemas en composición de su fase.