NÚMEROS CUÁNTICOS
Anuncio

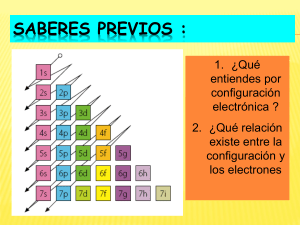
Oscar Cifuentes Sanhueza Química y CCNN Didáctica de las Ciencias Relacionar los número cuánticos con los niveles, subniveles, orbitales y electrones. Deducir la relación entre los números cuánticos n, l, ml, ms. Asociar los números cuánticos con los diagramas de átomo. Número cuántico principal Nivel (n) Subnivel (ℓ) Orbital (mℓ) 1 0=s 0 1 orbital s 2 0=s 1=p 0 1 orbital s -1, 0 , +1 3 orbitales p 0=s 1=p 2=d 0 1 orbital s -1, 0 , +1 3 orbitales p -2, -1, 0, +1, +2 5 orbitales d 3 Número Cuántico de Espín Nivel Electrones Orbitales Subnivel Nivel (n) 1 2 3 Subnivel (ℓ) Espín (ms) Notación nlx 0=s Orbital ( m ℓ) 0 1 orbital s +1/2 y -1/2 1s2 0=s 0 1 orbital s +1/2 y -1/2 2s2 1=p -1, 0 , +1 3 orbitales p +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 0=s 0 1 orbital s 1=p -1, 0 , +1 3 orbitales p 2=d -2, -1, 0, +1, +2 5 orbitales d +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 +1/2 y -1/2 2p6 3s2 3p6 3d10 Notación Cuántica Electrones Nivel x nℓ Subnivel Reglas de construcción Principio de Exclusión de Pauli Principio de máxima multiplicidad de Hund. Principio de construcción Regla de las Diagonales n=1 ℓ=0 mℓ =0 ms = + 1/2 Para el primer electrón n=1 ℓ=0 mℓ =0 ms = - 1/2 Para el segundo electrón Principio de máxima multiplicidad o principio de Hund Señala que los electrones que "entran" en alguno de los subniveles p, d o f, se distribuyen en los orbitales disponibles con sus espines en la misma dirección. Es decir, entran de uno en cada orbital disponible y luego se aparean. Buscar el número de electrones de la especie química. Ubicar los electrones en cada uno de los niveles de energía, comenzando por el más cercano al núcleo (n = 1), según la regla de las diagonales. Respetar la capacidad máxima de cada subnivel. Aplicar la regla de Hund. Por ejemplo, la configuración electrónica del Azufre sería S (Z=16): 1s2 , 2s2 , 2p6 , 3s2 , 3p4 Configuración electrónica simplificada (CES): La configuración electrónica se escribe con frecuencia en su forma simplificada; en este caso se indica el gas noble inmediatamente anterior entre signos de corchetes seguido del resto ordenado por nivel. Primer ejemplo, la configuración electrónica simplificada (C.E.S.) del silicio con número atómico 14 es: Si (Z=14): 1s2 2s2 2p6 3s2 3p2 Para este caso la C.E.S. es: [gas noble anterior + resto C.E.S.: [Ne , 3s2 3p2 Segundo ejemplo, la configuración electrónica simplificada (C.E.S.) del Calcio con número atómico 20 es: Ca (Z=20): 1s2 2s2 2p6 3s2 3p6 4s2 C.E.S.: [Ar , 4s2 Tercer ejemplo, la configuración electrónica simplificada (C.E.S.) del Bromo con número atómico 35 es: Br (Z=35): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 No olvidar que va el gas noble anterior y el resto ordenado por nivel C.E.S.: [Ar , 3d10 4s2 4p5