determinación de la constante universal de los gases r
Anuncio

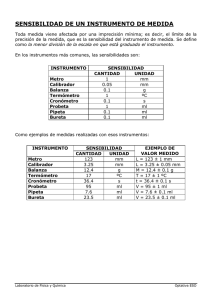
UNIVERSIDAD NACIONAL AUTONOMA DE MÉXICO Facultad de Química Determinación de la Constante universal de los gases Protocolo de Práctica Por: IQ. Fernando Morales Morales DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES R OBJETIVO Determinar experimentalmente la constante universal de los gases R y el volumen molar del hidrógeno. LECTURA OBLIGATORIA Jensen, William B. The Universal Gas Constant R. J. Chem. Educ. 2003, 80, 731. CUESTIONARIO PREVIO 1. 2. 3. 4. 5. ¿Por qué la constante universal de los gases es representada por la letra R? ¿Por qué R es llamada la constante universal de los gases? Escribe la reacción balanceada entre el Mg y HCl. (productos) Investiga los diferentes valores de la constante R en diferentes unidades. Investiga la reactividad y toxicidad de los reactivos a utilizar. PROBLEMA Manteniendo constantes, Cantidad de materia (n), Presión (P) y Temperatura (T), obtener experimentalmente la constante universal de los gases R y el volumen molar a condiciones ambientales, a partir de la reacción de Mg y HCl para producir hidrógeno. MATERIALES 1 Tubo de desprendimiento. 1 Jeringa de 3 mL con aguja 1 Tapón de #0 2 Mangueras de látex (aprox. 50 cm) 1 Bureta de 50 mL sin llave 1 Termómetro (0.1 °C) 1 Embudo de vidrio 2 Pinzas para bureta Facultad de Química 1 Pinza de tres dedos 3 soportes universales 1 Pipeta Pasteur 1 Tapón de #000 1 Vaso de pp de 250 mL 1 Vidrio de reloj Balanza digital Depto. Fisicoquímica IQ. Fernando Morales Morales REACTIVOS Ácido Clorhídrico 3 M (5 mL) Magnesio en tiras (3 aprox. 4 cm c/u) Acetona o etanol PROCEDIMIENTO 1.- Armar el equipo que se muestra en la Figura 1, verificando que no existan fugas. Figura 1. Aparato recolector de gases 2.- Llenar completamente la bureta hasta que el agua inunde el vástago del embudo. 3.- Asegurar que no existan burbujas de aire en la bureta y mangueras. 4.- Medir la temperatura ambiente (Tamb) y presión barométrica (Patm). 5.- Doblarla en 4 partes una tira de Magnesio y pesarla para obtener la masa inicial (m1). Facultad de Química Depto. Fisicoquímica IQ. Fernando Morales Morales 6.- Llenar la jeringa con HCl 3M (este nos servirá para los tres experimentos) e insertar la aguja en el tapón del tubo. 7.- Colocar el magnesio en el tubo y el tapón con la jeringa. 8.- Medir el volumen inicial en la bureta (V1). 9.- Inyectar aproximadamente 0.5 mL de HCl. 10.- Esperar 15 minutos a que la reacción finalice y que el gas obtenido alcance el equilibrio con la temperatura ambiente (Tamb). 11.- Mover el embudo para igualar el nivel del agua con el nivel de la bureta, como se muestra en la Figura 2. Figura 2. Niveles de agua 12.- Medir el volumen final del gas en la bureta (V2). 13.- Desconectar el tubo del dispositivo y recuperar el Mg que no reacciono. 15.- Lavar y secar perfectamente el Mg recuperado y obtener la masa final (m2). Si es necesario utiliza acetona o alcohol etílico. 16.- Repite el experimento 2 veces y registra los datos en el Anexo B. (nota: no necesitas secar el matraz o tubo, ni cambiar el agua en la bureta). Facultad de Química Depto. Fisicoquímica IQ. Fernando Morales Morales CÁLCULOS NÚMERO DE MOLES A partir de la masa final e inicial del Mg y la reacción balanceada con el HCl, se obtienen los moles de H2 formados. VOLUMEN − = ó Con el volumen inicial y final medido en la bureta, se obtiene el volumen del H2 recolectado. PRESIÓN − = El H2 no es el único gas en la bureta, existe también vapor de agua, para poder determinar la presión parcial del H2 seco se necesita conocer la presión parcial del vapor de agua. En el experimento se ajusta el nivel de agua en el embudo con el de la bureta, esto significa que la presión total del sistema es igual a la presión atmosférica: = + La presión del vapor del agua a temperatura ambiente se obtendrá consultando el CRC Handbook of Chemistry and Physics (Anexo B). TEMPERATURA La temperatura será (Tamb). OBTENIENDO R Finalmente utilizando la ecuación del gas ideal se obtendrá R en (L Atm/mol K). OBTENIENDO VOLUMEN MOLAR Se conoce el volumen y el número de moles generadas de H2, por lo que: = Facultad de Química Depto. Fisicoquímica IQ. Fernando Morales Morales RESIDUOS Los productos de la reacción pueden desecharse directamente a la tarja, ya que solo tenemos MgCl2 y H2O. CUESTIONARIO 1. A partir de la ecuación balanceada, demuestra usando los cálculos apropiados, que el reactivo limitante en la reacción de formación del H2 es el HCl. 2. ¿Qué errores experimentales influyeron en tu determinación de R? 3. ¿Qué efectos tienen los siguientes errores experimentales en el cálculo del valor de R? ¿Se incrementa el valor de R?, ¿Decrece? ¿Se mantiene el valor? Explica tus respuestas para cada inciso. a. Parte del HCl no reaccionó con el magnesio. b. Hay un exceso de Mg en la reacción de generación del H2. c. La presión de vapor del agua no fue considerada en el cálculo de R. d. Parte del H2 escapo del matraz. 4. En muchas ocasiones es necesario utilizar la constante R en J/mol-K: a. usa la conversión de 1 L-atm = 101.27 J, para obtener la constante en estas unidades. b. Calcula el % error del valor de R determinado en J/mol-K con el de la literatura. 6.- Calcula el volumen molar (n/V) a las condiciones experimentales y compáralo con tus valores obtenidos a partir de la práctica. 5. Calcula el volumen por mol (volumen molar) a condiciones estándar (usa tu valor promedio experimental de R). BIBLIOGRAFIA 1. David R. Lide; CRC Handbook of Chemistry and Physics; 84TH Edition 2003-2004; CRC Press; Pag. 984. 2. Moss, David B.; Cornely, Kathleen. J. Chem. Educ. 2001, 78, 1260. 3. Blanco, L. H.;Romero, C.M. J. Chem. Educ. 1995, 72, 933. Facultad de Química Depto. Fisicoquímica IQ. Fernando Morales Morales VAPOR PRESSURE OF WATER FROM 0 TO 370° C This table gives the vapor pressure of water at intervals of 1° C from the melting point to the critical point. REFERENCE Haar, L., Gallagher, J.S., and Kell, G.S., NBS/NRC Steam Tables, Hemisphere Publishing Corp., New York, 1984. t/°C 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 P/kPa 0.61129 0.65716 0.70605 0.75813 0.81359 0.87260 0.93537 1.0021 1.0730 1.1482 1.2281 1.3129 1.4027 1.4979 1.5988 1.7056 1.8185 1.9380 2.0644 2.1978 2.3388 2.4877 2.6447 2.8104 2.9850 3.1690 3.3629 3.5670 3.7818 4.0078 4.2455 4.4953 4.7578 5.0335 5.3229 5.6267 5.9453 6.2795 6.6298 6.9969 7.3814 7.7840 8.2054 8.6463 9.1075 9.5898 10.094 10.620 11.171 11.745 12.344 12.970 13.623 t/°C 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 t/°C P/kPa 14.303 15.012 15.752 16.522 17.324 18.159 19.028 19.932 20.873 21.851 22.868 23.925 25.022 26.163 27.347 28.576 29.852 31.176 32.549 33.972 35.448 36.978 38.563 40.205 41.905 43.665 45.487 47.373 49.324 51.342 53.428 55.585 57.815 60.119 62.499 64.958 67.496 70.117 72.823 75.614 78.494 81.465 84.529 87.688 90.945 94.301 97.759 101.32 104.99 108.77 112.66 116.67 120.79 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 6-8 P/kPa 125.03 129.39 133.88 138.50 143.24 148.12 153.13 158.29 163.58 169.02 174.61 180.34 186.23 192.28 198.48 204.85 211.38 218.09 224.96 232.01 239.24 246.66 254.25 262.04 270.02 278.20 286.57 295.15 303.93 312.93 322.14 331.57 341.22 351.09 361.19 371.53 382.11 392.92 403.98 415.29 426.85 438.67 450.75 463.10 475.72 488.61 501.78 515.23 528.96 542.99 557.32 571.94 586.87 t/°C 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 P/kPa 602.11 617.66 633.53 649.73 666.25 683.10 700.29 717.83 735.70 753.94 772.52 791.47 810.78 830.47 850.53 870.98 891.80 913.03 934.64 956.66 979.09 1001.9 1025.2 1048.9 1073.0 1097.5 1122.5 1147.9 1173.8 1200.1 1226.9 1254.2 1281.9 1310.1 1338.8 1368.0 1397.6 1427.8 1458.5 1489.7 1521.4 1553.6 1586.4 1619.7 1653.6 1688.0 1722.9 1758.4 1794.5 1831.1 1868.4 1906.2 1944.6