Document
Anuncio
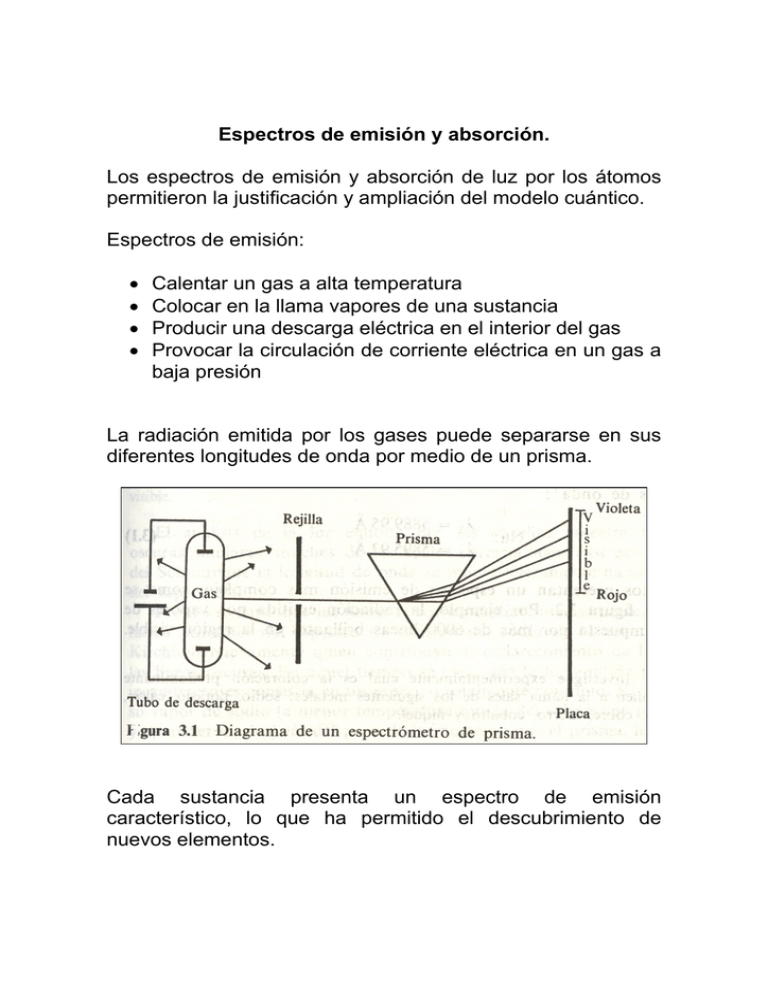
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: • • • • Calentar un gas a alta temperatura Colocar en la llama vapores de una sustancia Producir una descarga eléctrica en el interior del gas Provocar la circulación de corriente eléctrica en un gas a baja presión La radiación emitida por los gases puede separarse en sus diferentes longitudes de onda por medio de un prisma. Cada sustancia presenta un espectro de emisión característico, lo que ha permitido el descubrimiento de nuevos elementos. Espectro de absorción Wollaston en 1802 encontró siete líneas obscuras espaciadas irregularmente. Doce años después Fraunhofer encontró varios cientos de líneas oscuras. Espectro de emisión del sodio Espectro de absorción del sodio La fórmula de Balmer En 1885, Johann Jacob Balmer encontró una relación numérica entre las líneas espectroscópicas. Estas coincidían con los resultados experimentales reportados por Anders Jonas Ångstrom. ⎛ n2 ⎞ λ = b⎜⎜ 2 2 ⎟⎟ ⎝n −2 ⎠ Donde b=3645.6Å, para n= 3, 4, 5 y 6. Problema: Las líneas de emisión medidas por Ångstrom fueron: Nombre de Hα la línea Longitud de 6562.10 onda (Å) Color Rojo Hβ Hγ Hδ 4860.74 4340.1 4102.2 Verde Azul Violeta Calcule las previstas por la relación de Balmer así como el porcentaje de error (⏐λ-λexp⏐/λexp)100 En 1890, Johannes Robert Rydberg encontró dos generalizaciones fundamentales en los espectros de otros elementos. Empleó números de onda: ν = 1 λ 4⎛ 1 1 ⎞ ν = ⎜ 2 − 2⎟ b⎝2 n ⎠ ⎛1 1⎞ ν = RH ⎜ 2 − 2 ⎟ ⎝2 n ⎠ RH=109677.581cm-1 ⎛1 1⎞ ν = RH ⎜⎜ 2 − 2 ⎟⎟ ⎝ n2 n1 ⎠ Con esta ecuación se reproducen las líneas de emisión del Hidrógeno. De modelos a modelos, el modelo del átomo. Con el descubrimiento del núcleo atómico realizado por Rutherford, se empezó a utilizar éste como base de un modelo clásico del átomo. Se consideraba la fuerza de atracción entre el núcleo y electrón (para el átomo más sencillo) como la de Coulomb. La representación era de un electrón atraído hacia una masa mucho mayor que él. A este modelo se le denominó como planetario. Dado que el núcleo se encuentra en reposo y el electrón se encuentra girando alrededor de él, la energía total sería: 1 Ec = mv2 2 V =κ qq ' r Ze2 V = −κ r 1 2 Ze2 E = Ec + V = mv − κ 2 r Considerar que la fuerza eléctrica es igual a Fe=m a V κZe2 E= =− 2 2r La frecuencia, f, con la que gira el electrón dependerá del radio de la orbita, r: 1 f = 2π ⎛ κZe ⎜⎜ 3 ⎝ mr 2 ⎞ ⎟⎟ ⎠ 1/ 2 Determinar las frecuencias y la energía para r=1Å y r=2Å Como resultado de la emisión de radiación ultravioleta, la energía del electrón se reduciría, lo que haría girar al electrón más cerca del núcleo y a mayor velocidad. El átomo irradiaría continuamente. Al acercarse más al núcleo, su energía decrecería más y la radiación sería de mayor frecuencia. De acuerdo con los resultados obtenidos, la trayectoria del orbital sería una espiral y disiparía cada vez más energía radiante en una forma continua. El modelo atómico de BOHR En 1913, Niels Bohr desarrolló un modelo atómico abandonando las consideraciones de la electrodinámica clásica y tomando en cuenta la cuantización de la energía en la interacción radiación-materia. La propuesta de Bohr fue ponerle restricciones al modelo planetario: 1. No se aplica el resultado clásico de que una carga acelerada emite radiación continuamente. 2. El proceso de absorción y emisión de un átomo sólo puede realizarse discontinuamente. 3. la cantidad de energía radiada en una emisión fundamental debe ser igual a nhν 4. Cuando el átomo no absorba o emita radiación significa que se encuentra en estado estacionario con una energía constante. 5. La energía radiante tiene una sola frecuencia, la cual es la mitad de la frecuencia a la que orbita el electrón en un estado final (suponiendo que el electrón se acerca al núcleo desde el infinito) 6. el núcleo es infinitamente más grande que el electrón. − 2π 2κ 2 Z 2 e 4 m E= n2h2 n= 1, 2, 3,… De estos resultados, Bohr propone órbitas estacionarias, donde el valor de r para la primera órbita es conocido como a0 o radio de Bohr. o h2 −11 a0 = 2 2 = 5.292x10 m = 52.92pm= 0.5292A 4π κe m Así pues la expresión para la energía total puede expresarse como: ⎛ 4π 2κe 2 m ⎞⎛ κZ 2 e 2 ⎟⎟⎜⎜ E n = −⎜⎜ 2 2 h ⎝ ⎠⎝ 2n En = − ⎞ ⎟⎟ ⎠ κZ 2 e 2 ⎛ 1 ⎞ ⎜ ⎟ 2a 0 ⎝ n 2 ⎠ Para obtener la cantidad de energía radiada cuando el átomo pasa de un estado estacionario a otro propuso la siguiente relación: 2πκ 2mZ 2e4 ⎛ 1 1 ⎞ ⎜⎜ 2 − 2 ⎟⎟ En = En 2 − En1 = − 2 h ⎝ n1 n2 ⎠ Er= -∆E Considerando que la radiación es monocromática, tenemos: 2πκ 2mZ 2e4 ⎛ 1 1 ⎞ ⎜⎜ 2 − 2 ⎟⎟ ν =− 3 ch ⎝ n2 n1 ⎠ Esta es igual a la propuesta por Rydberg para las líneas espectrales del hidrógeno. ⎛1 1⎞ ν = − R∞ Z ⎜⎜ 2 − 2 ⎟⎟ ⎝ n2 n1 ⎠ 2 Donde R∞ es la constante de Rydberg. Para determinar las transiciones entre las líneas espectrales: En = E1 + hνnc La teoría de Bohr justificaba la presencia de un menor número de líneas. En su estado más estable, el átomo puede absorber energía para excitarse. El estado inicial es n=1, y el final tendría una n de 2 en adelante. Al estado atómico con menor energía se le denomina estado basal o fundamental. A cualquier otro se le denomina estado excitado. Los postulados de Bohr 1. Los átomos monoelectrónicos (H, He+, Li2+, Be3+,…) estan constituidos por un núcleo, de carga Ze, con una masa M que es A veces mayor a la del electrón, el cual gira alrededor del núcleo en una órbita circular de radio r. MH= 1836.1m Esto es debido a que se considera un centro de masa Y se define como aquel punto entre el núcleo y el protón que satisface: MrN = mre rN + re = r χ =0= MrN − mre M +m 2. La cantidad de movimiento angular, L, del átomo está cuantizada. De los infinitos movimientos orbitales existentes de acuerdo al primer postulado, sólo son posibles aquellos para los cuales el momento angular sea múltiplo entero de h =h 2π Es decir L=n h 3. las órbitas determinadas por el segundo postulado son estacionarias, es decir, el átomo no radia cuando se encuentra en una de ellas. Sólo cuando el átomo cambia de un estado (1) con mayor energía a otro (2) con menor energía, se emite radiación monocromática cuya frecuencia viene dada por En1 − En2 ν= h ⎡ 1 1 ⎤ ν = RH ⎢ 2 − 2 ⎥ n1 ⎦ ⎣ n2 Las orbitas elípticas de Sommerfield Dos años después de presentar su modelo, éste fue extrapolado por Arnold Sommerfeld y William Wilson para órbitas elípticas. Las órbitas elípticas tienen energía negativa. Pero es necesario considerar la distancia al núcleo, r, y al ángulo, φ Consideraron unas reglas de cuantización de “la acción”, gracias a las cuales pudieron encontrar tres números cuánticos en el hidrógeno: La n de Bohr La k o número cuántico azimutal, que tenía que ver con la excentricidad de la elipse: n/k = a/b La m o número cuántico magnético, que tiene que ver con el plano en el que gira el electrón en su órbita elíptica. n 1 2 3 k 1 2 1 3 2 1 nr 0 0 1 0 1 2 b/a=k/n 1 1 ½ 1 2/3 1/3 Penetrabilidad: Una orbita elíptica es más penetrante conforme más cerca del núcleo puede pasar el electrón. A mayor excentricidad de la elipse, menor valor de k, orbitas más penetrantes. Localizabilidad: Una orbita elíptica está más localizada conforme menos varía la distancia al núcleo cuando el electrón gira. Las orbitas menos excéntricas (k=n) son las más localizadas. Si se considera el caso tridimensional, aparece un tercer número cuántico. El número cuántico magnético, m. En los espectros de los metales alcalinos apareció también el número cuántico k, el cual se llevó un nombre en función de la naturaleza de las líneas espectrales (a partir de los niveles de los cuales provenía el electrón): k = 1órbitas s, por “sharp” k = 2órbitas p, por “principal” k = 3órbitas d, por “difuse” k = 4órbitas f, por “fundamental” Principio de construcción Un error de Bohr No. máximo de electrones Bohr Stoner TOTAL n= 1 1s 2 2 2 NIVEL n=3 n=2 2s 4 2 2p 4 6 8 3s 6 2 3p 3d 6 6 6 10 18 n=4 4s 8 2 4p 8 6 4d 8 10 32 4f 8 14 Desde 1921, Bohr propuso el principio de construcción progresiva o principio de “Aufbau”: 1) La configuración electrónica de un átomo con Z protones y electrones se obtiene añadiendo un electrón adicional a la configuración del átomo con Z-1 protones y electrones 2) Al añadir el electrón adicional, hay que considerar el orden de llenado de los niveles energéticos atómicos, que es: A) Se ocupan primeramente los niveles con menor suma de n+k B) Si tienen igual n+k, primero se ocupa aquel con menor n. C) El número de electrones que caben en cada nivel está dado por la expresión 2(2k-1), debida a Stoner: Stoner s (k=1) 2 p (k=2) 6 d (k=3) 10 f (k=4) 14 El orden de llenado de los niveles es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d Así, a partir del hidrógeno Z=1 H: 1s1 Vamos construyendo las configuraciones de los demás átomos: Z=2 He: 1s2 El nivel 1s ya está lleno, toca empezar a llenar el 2s. Z=3 Li: 1s2 2s1 Z=4 Be: 1s2 2s2 El nivel 2s ya está lleno, toca empezar a llenar el 2p. Z=5 B: 1s2 2s2 2p1 Z=6 C: 1s2 2s2 2p2 Z=7 N: 1s2 2s2 2p3 Z=8 O: 1s2 2s2 2p4 Z=9 F: 1s2 2s2 2p5 Z=10 Ne: 1s2 2s2 2p6 Con esto la capa 2p ya está llena y hay que empezar a llenar la 3s. Y así sucesivamente Construye la configuración electrónica del Zn (Z=30), del Cd (Z=48) y del Kr (Z=36) y del Xe (Z=54), según el principio de construcción. Pronto se conocieron las limitaciones del principio de construcción, que falla en un buen número de casos, por ejemplo: Cr (Z=24) real: Principio de aufbau: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 1s2 2s2 2p6 3s2 3p6 4s2 3d4 Cu(Z=29) real: 1s2 2s2 2p6 3s2 3p6 4s1 3d10 Principio de aufbau: 1s2 2s2 2p6 3s2 3p6 4s2 3d9 Ru(Z=44) real: 1 7 5s 4d Principio de aufbau: 2 5s 4d6 Pd(Z=46) real: 0 10 5s 4d Principio de aufbau: 2 5s 4d8 1s2 2s2 2p6 3s2 3p6 4s1 3d10 4p6 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 1s2 2s2 2p6 3s2 3p6 4s1 3d10 4p6 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 Gracias al principio de construcción de Bohr se pudo interpretar la posición de los grupos de elementos en la tabla periódica. El espín electrónico Antecedentes: Multipletes en los espectros atómicos Cuando los espectrómetros fueron más sensibles, los espectroscopistas se dieron cuenta de que muchas de las líneas espectrales no eran sino dos, tres, o más líneas muy juntas, grupos a los que se les denominó “multipletes”. Un ejemplo de doblete espectral corresponde a la línea “D” o amarilla del sodio, que en realidad es un doblete, con longitudes de onda: λ1= 5,889.95 Å y λ2= 5,895.92 Å ¿A qué se debe la presencia de dos líneas donde antes se creía que existía sólo una? Es como si el estado excitado consistiera en realidad de dos posibles energías y el estado basal de sólo una: Pronto aparecieron una multitud de “dobletes” en los espectros: Antecedentes: El efecto Zeeman En 1896, Peter Zeeman encontró que la línea D del sodio, en presencia de un campo magnético, se ensanchaba notablemente. Con posterioridad se observó que las líneas espectrales se desdoblaban en multipletes cuando los átomos emitían estando sujetos al efecto de un campo magnético. Se reconocieron dos tipos de patrones: El efecto “normal” de Zeeman consistía en el desdoblamiento en tres líneas a partir de una línea original (o singulete). Este efecto “normal” pudo explicarse por el efecto clásico de interacción entre el campo magnético y el momento magnético del electrón al girar en su órbita. El efecto “anormal” de Zeeman consistía en el desdoblamiento en múltiples líneas de algunas líneas que fueron detectadas como dobletes, tripletes o superiores. Este efecto no tenía explicación alguna. Espín electrónico Postulación del momento angular del espín Wolfgan Pauli, en 1925, indicó que eran necesarios cuatro números cuánticos para caracterizar a cada uno de los electrones en un átomo. En 1925, un científico alemán, Goudsmit propuso que los cuatro números serían n, k, m y un nuevo número ms, con dos valores ± ½. Pauli presentó también en 1925 su principio de exclusión: “Nunca puede haber dos o más electrones en un átomo para los cuales los valores de todos los números cuánticos sean los mismos” Goudsmit y Uhlenbeck se dieron cuenta de que la presencia de un cuarto número cuántico sugería la existencia de un cuarto grado de libertad del movimiento electrónico, y propusieron que el giro del electrón, en una u otra dirección, era ese cuarto grado de libertad. El momentum angular, S, debido al giro del electrón alrededor de su propio eje traía aparejada la presencia de un momento magnético, µs. La presencia del momento magnético, µs, explicaba la presencia de multipletes en los espectros atómicos y el desdoblamiento anormal de Zeeman. Erwin Schrödinger no pudo alcanzar el número cuántico del espín de su ecuación de onda mecánico-cuántica. Sólo pudo meter “a fuerza” el espín dentro de sus ecuaciones. Años más tarde, en 1930, Paul Adrien Maurice Dirac, al encontrar una ecuación tipo Schrödinger compatible con la relatividad, en la cual el espín aparecía de manera “natural”, encontró que el origen del espín no tiene nada que ver con el giro del electrón alrededor de su eje, sino que es un efecto relativista-cuántico, que genera un momentum angular y un momento magnético no clásico.






