Características de electrones protones y neutrones
Anuncio
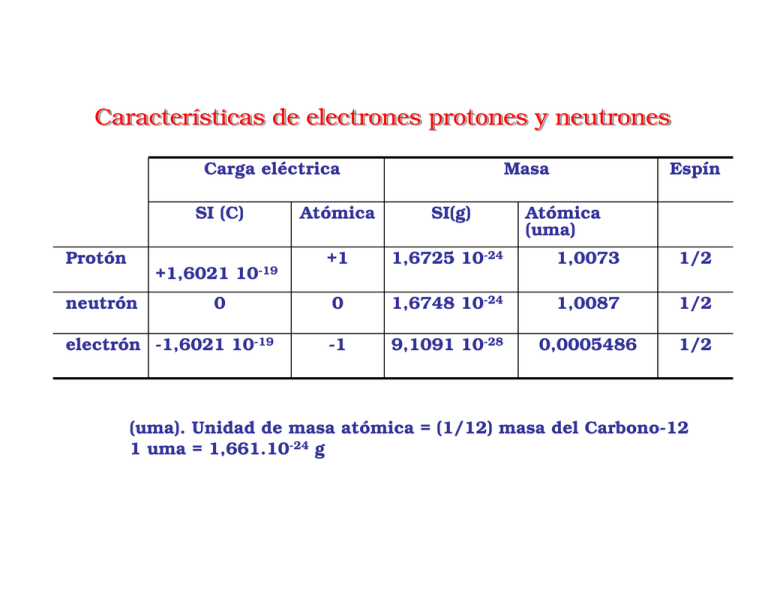
Características de electrones protones y neutrones Carga eléctrica SI (C) Protón +1,6021 neutrón 10-19 0 electrón -1,6021 10-19 Masa Espín Atómica SI(g) Atómica (uma) +1 1,6725 10-24 1,0073 1/2 0 1,6748 10-24 1,0087 1/2 -1 9,1091 10-28 0,0005486 1/2 (uma). Unidad de masa atómica = (1/12) masa del Carbono-12 1 uma = 1,661.10-24 g Notación de los isótopos de un elemento: A ZE Z número atómico = nº de protones A número másico = nº de protones + nº de neutrones E Símbolo del elemento Iones Iones:: A ±n ZE n = nº de protones - nº de electrones ¿Cómo contribuye cada isótopo a la masa atómica de un elemento? Concepto de mol. Número de Avogadro, NA = 6,02214199.1023 mol-1 Masa molar Tipos de compuestos químicos y sus fórmulas Compuesto molecular: formado por unidades discretas (moléculas) Molécula: número pequeño de átomos, generalmente no metales, que se mantienen unidos por enlaces covalentes Enlace covalente: compartición de un par de electrones de la capa de valencia por dos átomos distintos Fórmula química: representación simbólica que cómo mínimo indica los elementos presentes en el compuesto y la proporción relativa de cada uno de ellos Fórmula empírica: fórmula más sencilla Ácido acético (vinagre) CH2O Formaldehído Glucosa Fórmula molecular: Fórmula con la composición de la molécula real ÁcidoCacético 2H4O2 Formaldehído CH2O Glucosa CH O 6 12 6 Fórmula estructural: muestra el orden en el que se unen los átomos y el tipo de enlace H O H C H C O H Tipos de compuestos químicos y sus fórmulas Fórmula estructural condensad: por grupos funcionales CH3CO2H CH3(CH2)2CH3 = butano HCHO = formaldehído Representaciones espaciales Fosfolípido PCl5 Tipos de compuestos químicos y sus fórmulas Compuesto iónico: formado por iones positivos (cationes) y negativos (aniones) unidos por fuerzas electrostáticas (enlace iónico) Relación Cl/Na; 1:1 Fórmula: NaCl ClNa+ Unidad fórmula Iones monoatómicos: Na+, Cl-, Ca2+ Iones poliatómicos: NO3-, NH4+ Estado de oxidación de los elementos en los compuestos Estado de oxidación (EO)o número de oxidación:número de electrones que el elemento gana o pierde cuando está formando compuesto respecto al de su estado elemental 1. El EO de un elemento libre, sin combinar es 0 2. La suma de los EO de todos los átomos en a) Una especie neutra, es decir, un átomo aislado, una molécula o una unidad fórmula es 0 b) Un ión es igual a la carga del ión 3. Los metales del grupo 1 tienen EO +1 y los del grupo 2 tienen EO +2 4. El EO del Flúor es siempre -1 5. El EO del H en sus compuestos es +1 (excepto en los hidruros, combinación con metales, LiH, hidruro de litio, en donde es -1) 6. El EO del oxígeno en sus compuestos es -2 (excepto en los peróxidos, O2-2) 7. Los elementos del grupo 17 en sus compuestos binarios con metales tienen un EO de -1, los elementos del grupo 16, -2 y los del grupo 15, -3 Los estados de oxidación siempre son números enteros ejemplo: F3O4 (EO del Fe + 8/3); realmente = FeO + F2O3 Nomenclatura de los compuestos inorgánicos Sales binarias: Anión de un no metal + catión (compuestos iónicos) CrCl3; Cloruro de Cromo (III) SnS; Sulfuro de Sn (II) NH4F; Fluoruro de amonio o fluoruro amónico Nomenclatura de los compuestos inorgánicos Óxidos Básicos: Oxígeno + catión metálico (compuestos iónicos) Ag2O; Óxido de Plata ZnO; Óxido de Zinc Cu2O; Óxido de Cobre (I); óxido cuproso CuO; Óxido de Cobre (II); óxido cuprico (compuestos moleculares) Óxidos Ácidos: Oxígeno + no metal EO halógenos (excepto el Flúor): 1, 3, 5, 7 Cl2O- monóxido de dicloro; óxido hipocloroso Cl2O3-trióxido de dicloro; óxido cloroso orden creciente de Cl2O5- pentóxido de dicloro; óxido clórico oxidación Cl2O7-heptóxido de dicloro; óxido perclórico EO grupo 16 : 4, 6 SO2- dióxido de azufre; óxido sulfuroso SO3-trióxido de azufre; óxido sulfúrico EO grupo 15 : 3, 5 N2O3- trióxido de dinitrógeno; óxido nitroso N2O5-pentóxido de dinitrógeno; óxido nítrico Nomenclatura de los compuestos inorgánicos Hidróxidos: catión + hidroxilo (OH-) (compuestos moleculares) AgOH; hidróxido de Plata Zn(OH)2; Hidóxido de Zinc CuOH; hidróxido de Cobre (I); Cu(OH)2; hidróxido de Cobre (II); (compuestos moleculares) Ácidos Oxiácidos: EO halógenos (excepto el Flúor): 1, 3, 5, 7 HClO ácido hipocloroso HClO2ácido cloroso HClO3 ácido clórico HClO4 ácido perclórico EO grupo 16 : 4, 6 H2SO3- ácido sulfuroso H2O4-ácido sulfúrico EO grupo 15 : 3, 5 HNO2- ácido nitroso HNO3- ácido nítrico Nomenclatura de los compuestos inorgánicos Nomenclatura de los compuestos inorgánicos Oxisales: Oxianión + catión (compuestos iónicos) Na3PO4 – Fosfato sódico o fosfato de sodio Na2HPO4- Monohidrógeno fosfato de sodio NaH2PO4- Dihidrógeno fosfato de sodio Na2SO3- Sulfito de sodio NaClO-hipoclorito de sodio Na2CO3-Carbonato de sodio Otros compuestos: Ácidos hidrácidos: No metal + hidrógeno (compuesto molecular) HCl- Cloruro de hidrógeno ; HCl(aq) ácido clorhídrico H2S- Sulfuro de hidrógeno; H2S(aq) ácido sulhídrico Hidratos: CoCl2· 6H20 Cloruro de Cobalto(II) hexahidratado











