Extracción con fluídos supercríticos
Anuncio
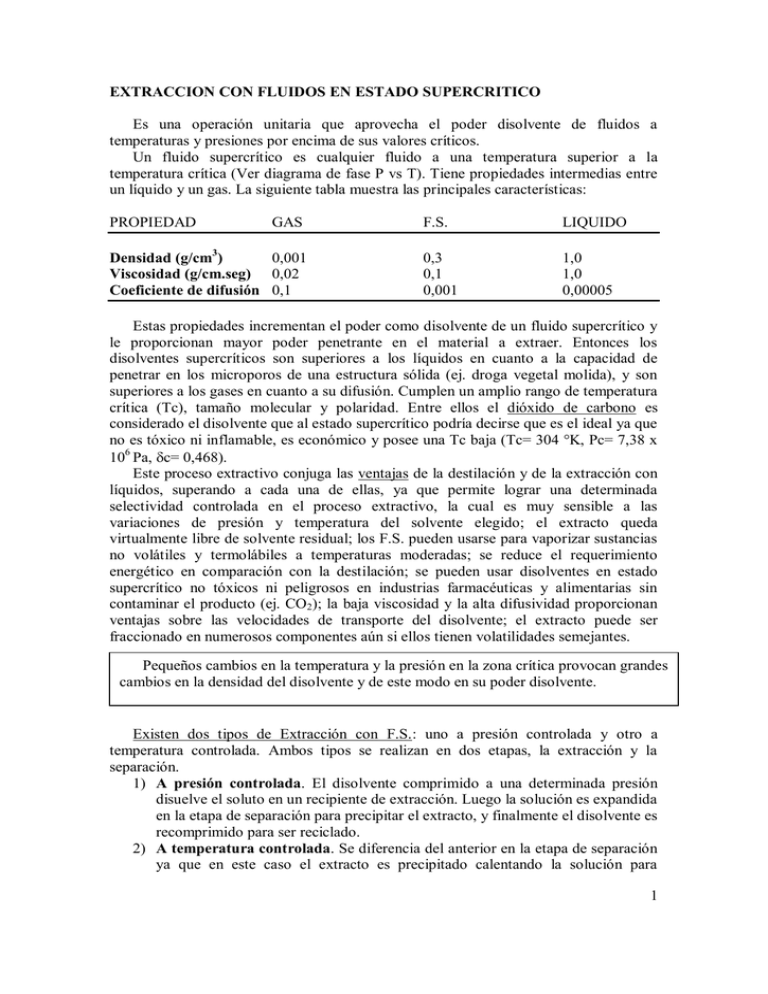
EXTRACCION CON FLUIDOS EN ESTADO SUPERCRITICO Es una operación unitaria que aprovecha el poder disolvente de fluidos a temperaturas y presiones por encima de sus valores críticos. Un fluido supercrítico es cualquier fluido a una temperatura superior a la temperatura crítica (Ver diagrama de fase P vs T). Tiene propiedades intermedias entre un líquido y un gas. La siguiente tabla muestra las principales características: PROPIEDAD GAS Densidad (g/cm3) 0,001 Viscosidad (g/cm.seg) 0,02 Coeficiente de difusión 0,1 F.S. LIQUIDO 0,3 0,1 0,001 1,0 1,0 0,00005 Estas propiedades incrementan el poder como disolvente de un fluido supercrítico y le proporcionan mayor poder penetrante en el material a extraer. Entonces los disolventes supercríticos son superiores a los líquidos en cuanto a la capacidad de penetrar en los microporos de una estructura sólida (ej. droga vegetal molida), y son superiores a los gases en cuanto a su difusión. Cumplen un amplio rango de temperatura crítica (Tc), tamaño molecular y polaridad. Entre ellos el dióxido de carbono es considerado el disolvente que al estado supercrítico podría decirse que es el ideal ya que no es tóxico ni inflamable, es económico y posee una Tc baja (Tc= 304 °K, Pc= 7,38 x 106 Pa, c= 0,468). Este proceso extractivo conjuga las ventajas de la destilación y de la extracción con líquidos, superando a cada una de ellas, ya que permite lograr una determinada selectividad controlada en el proceso extractivo, la cual es muy sensible a las variaciones de presión y temperatura del solvente elegido; el extracto queda virtualmente libre de solvente residual; los F.S. pueden usarse para vaporizar sustancias no volátiles y termolábiles a temperaturas moderadas; se reduce el requerimiento energético en comparación con la destilación; se pueden usar disolventes en estado supercrítico no tóxicos ni peligrosos en industrias farmacéuticas y alimentarias sin contaminar el producto (ej. CO2); la baja viscosidad y la alta difusividad proporcionan ventajas sobre las velocidades de transporte del disolvente; el extracto puede ser fraccionado en numerosos componentes aún si ellos tienen volatilidades semejantes. Pequeños cambios la temperatura la presión la zona crítica provocangrandes grandes Leves cambios en laentemperatura y laypresión en en la zona crítica provocan cambiosenenlaladensidad densidaddel deldisolvente disolventey ydedeeste estemodo modoenensusupoder poderdisolvente. disolvente. cambios Existen dos tipos de Extracción con F.S.: uno a presión controlada y otro a temperatura controlada. Ambos tipos se realizan en dos etapas, la extracción y la separación. 1) A presión controlada. El disolvente comprimido a una determinada presión disuelve el soluto en un recipiente de extracción. Luego la solución es expandida en la etapa de separación para precipitar el extracto, y finalmente el disolvente es recomprimido para ser reciclado. 2) A temperatura controlada. Se diferencia del anterior en la etapa de separación ya que en este caso el extracto es precipitado calentando la solución para 1 disminuir la densidad del disolvente. La densidad se aumenta luego para reciclar mediante un enfriamiento isobárico. Este proceso es altamente eficiente energéticamente debido a que el calor se transfiere directamente entre las etapas de calentamiento y enfriamiento, y en la proximidad de condiciones isobáricas minimiza la energía de compresión. Entonces una vez finalizada la etapa de extracción deberá realizarse la separación del disolvente. En la región supercrítica ocurre lo que se denomina condensación retrógrada, en donde un vapor supercrítico puede condensar al disminuir la presión, y un líquido puede dar burbujas (“gas”) al ser comprimido, en este caso se ocurre una evaporación retrógrada. Todo esto genera inmiscibilidad entre las sustancias, que es lo que finalmente se aprovecha para contrarestar la formación de azeótropos, y que permite separar adecuadamente el disolvente del extracto. Resumiendo, la separación del disolvente puede lograrse: a) precipitando el soluto del extracto por disminución de la densidad del disolvente, ya sea por disminución de la presión a la misma temperatura (isotérmica), o por aumento de la temperatura a la misma presión (isobárica); b) por separación del soluto extraído por tratamiento con otros disolventes, ej. la cafeína con agua; c) por pasaje del extracto a través de resinas de intercambio iónico; d) por combinación de la extracción con F.S. con HPLC en donde también se puede usar como FM este tipo de disolventes. Un disolvente supercrítico trabaja a una temperatura cercana, próxima Un disolvente supercrítico trabaja a una temperatura cercana, próxima a laa la Tc del Tc del dislvente, y a una presión elevada, entonces su densidad será superior a la dislvente, y a una presión elevada, entonces su densidad será superior a la densidad densidad crítica del disolvente. crítica del disolvente. Los disolventes supercríticos se clasifican de acuerdo a la temperatura crítica en dos grupos: 1) de baja Tc, se utilizan para productos naturales, para la industria alimentaria, farmacéutica, en general para compuestos de bajo y mediano peso molecular. Ej. dióxido de carbono, etileno, propano. 2) de alta Tc, se aplican en la recuperación y tratamiento y/o procesamiento de carbón y petróleo, de hidrocarburos en general. Ej. hexano, metanol, tolueno. Aplicaciones actuales: descafeinización del café y del té; extracción de alcaloides en general (ej. del lupino, del tabaco, etc); en el refinamiento y recuperación de aceites; extracción de lípidos y colesterol; extracción de colorantes, etc. 2