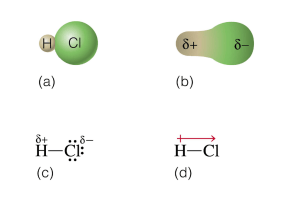Enlaces químicos Enlaces iónicos químicos Enlaces covalentes
Anuncio

31/08/2011 Enlaces iónicos Enlaces iónicos Enlaces químicos Polares Enlaces covalentes Simple Doble No polares Triple Enlaces Se produce la cesión de electrones desde el átomo menos químicos Simple P l Polares electronegativo al más electronegativo. Enlaces covalentes Se produce entre elementos con diferencia de electronegatividades apreciables. No polares Doble Triple En general participan metales (bajo potencial de ionización) y no metales (alta electroafinidad). Estructuras de Lewis Fuerza de atracción relativa: Se representa cada electrón de valencia (electrón de la capa más externa) con un punto. Símbolo de Lewis Diagrama de Bohr se representa Radio: se representa Radio suma = distancia entre el centro de los iones El ión queda con 8 electrones en la última capa (regla del octeto) 1 31/08/2011 Estructuras de Lewis Se representa cada electrón de valencia (electrón de la capa más externa) con un punto. Símbolo de Lewis Diagrama de Bohr se representa configuración de capa incompleta configuración de capa completa se representa El ión queda con 8 electrones en la última capa (regla del octeto) Los electronesEnlaces se comparten de a pares entre los átomos iónicos involucrados en el enlace. Cuando cada átomo aporta 1 electrón: Enlaces químicos P l Polares Enlaces covalentes Este hidrógeno comparte un par de electrones …y este hidrógeno comparte un par de electrones Simple Doble No polares Triple 2 31/08/2011 muy cerca Distancia internuclear (longitud de enlace) Radio covalente Distancia interniclear (longitud de enlace) Radio covalente muy lejos Longitud de enlace Distancia internuclear Los electronesEnlaces se comparten de a pares entre los átomos iónicos involucrados en el enlace. Cuando cada átomo aporta 2 electrones: Enlaces químicos P l Polares Simple Doble Enlaces covalentes No polares Triple Los electronesEnlaces se comparten de a pares entre los átomos iónicos involucrados en el enlace. Cuando cada átomo aporta 3 electrones: Enlaces químicos P l Polares Enlaces covalentes Simple Doble No polares Triple 3 31/08/2011 iónicoscon electronegatividades Se producenEnlaces entre elementos iguales (átomos del mismo elemento). Enlaces químicos Longitud de enlace P l Polares Enlaces covalentes Energía de enlace Doble No polares Este hidrógeno comparte un par de electrones Simple Triple …y este hidrógeno comparte un par de electrones Enlace covalente no polar 4 31/08/2011 Distancia internuclear (longitud de enlace) Radio covalente Distancia interniclear (longitud de enlace) Radio covalente iónicoscon electronegatividades Se producenEnlaces entre elementos semejantes (en general, entre no metales). Enlaces químicos P l Polares Enlaces covalentes Simple Doble No polares Triple Momento dipolar (μ): es el producto de la densidad de carga por la distancia que las separa μ=qxd 5 31/08/2011 Enlace covalente no polar Los electrones se comparten de igual manera Enlace covalente polar Enlace iónico Los electrones se transfieren Aumenta el carácter iónico Diferencia de electronegatividades ionic_vs_covalent.swf Porcentaje de carácter iónico Los electrones del enlace son atraídos más fuertemente por el Cl que por el H Enlace covalente polar Los electrones se comparten de manera desigual Diferencia de electronegatividad 6 31/08/2011 Polarizabilidad (α): ): medida de la tendencia a distorsionarse de una nube electrónica al ser sometida a un campo eléctrico. Especies polarizables: Son aquellos átomos cuya nube electrónica experimenta fácilmente grandes deformaciones. Iónico (especies cargadas) Covalente polar (cargas parciales) Covalente no polar (electrónicamente simétricas) Especies polarizantes: Son átomos o iones que pueden inducir g grandes deformaciones en las nubes electrónicas de otros átomos o iones. catión polarizante nube electrónica distorsionada anión polarizable Estructura de Lewis de moléculas poliatómicas Modelo iónico Modelo covalente Aumento de la diferencia de electronegatividad Modelo iónico Modelo covalente Aumento del poder polarizante del catión y de la polarizabilidad del anión. 7 31/08/2011 Geometría molecular. Las estructuras de Lewis no indican la forma de las moléculas, sólo indica el número y tipo de enlaces. Longitud de enlace C-Cl: 1.78 A Ángulo de enlace: 109,5º 8 31/08/2011 AB H H AB2 H H AB3 SO3 Compuestos del tipo ABn NH3 Teoría de repulsión de pares de electrones de valencia (TRPEV) Geometrías moleculares La mejor manera de acomodar pares de electrones es aquella que minimiza la repulsión. lineal angular triangular plana pirámide triangular ti triangular l hamaca cuadrado plana bipirámide pirámide triangular cuadrada octaédrica tetraédrica bipirámide pentagonal 9 31/08/2011 Posiciones de las regiones con alta densidad electrónica lineal triangular plana AB4 AB3L 109,5º tetraédrica 107º metano bipirámide triangular octaédrica amoníaco AB2L2 104,5º agua bipirámide pentagonal tetraédrica piramidal trigonal angular •Las regiones de alta densidad electrónica adoptan posiciones que maximizan sus separaciones. pares de e- no enlazantes Repulsión •Todos los enlaces (simples, dobles o triples) se repelen de igual e- pares de enlazantes par libre – par libre manera. par libre – par enlazante •El enlace alrededor de un átomo central es independiente de si la molécula tiene más de un átomo central. par enlazante l t – par enlazante l t •Los pares solitarios contribuyen a la forma de la molécula (geometría electrónica), aunque no están incluidos en la descripción de la forma molecular (geometría molecular). •Los pares solitarios se repelen con mayor intensidad que los pares enlazantes y por lo tanto tienden a comprimir los ángulos de enlace. 10 31/08/2011 Nº de regiones electrónicas Geometría electrónica Ángulo de enlace lineal 1- Dibujar la estructura de Lewis de la molécula. 2- Identificar la geometría electrónica , contando las regiones con pares de electrones (los enlaces dobles y triples se cuentan como una única región). g molecular. 3- Ubicar los átomos y clasificar la geometría 4- Identificar la intensidad de las repulsiones y permitir que la molécula se distorsione de acuerdo a ellas. triangular plana tetraédrica bipirámide base triangular Recordar que las repulsiones son: pl – pl > pl – pe > pe – pe octaédrica 11 31/08/2011 Polaridad de las moléculas. Enlaces polares Enlaces polares Molécula polar: molécula con momento dipolar permanente no nulo. Todas las moléculas diatómicas son polares si sus enlaces son polares. Momento dipolar neto (μ) = 0 Momento dipolar neto (μ) ≠ 0 Todas las moléculas diatómicas homonucleares (2 átomos iguales) son no polares, debido a que sus enlaces son no polares. Moléculas poliatómicas: Enlaces polares Enlaces polares No polares Polares Asimétricas Rojo: regiones de mayor densidad electrónica Azul: regiones de menor densidad electrónica Simétricas 12 31/08/2011 tipo No polar Polar tipo No polar Polar tipo No polar Polar 13