Fundamentos de Química Teórica
EL ÁTOMO CON DOS ELECTRONES
e1−
r1
●
núcleo
masa = M
carga = Ze
r2
r1, 2
e2−
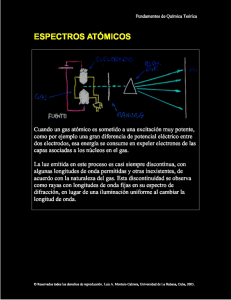
La ecuación de Schrödinger del sistema con dos electrones puede
expresarse como:
2
2 2 2 2
e
Z Z
1
∇ r1 −
∇ r2 +
− − +
ψ
(
r1 , r2 ) = Eψ (r1 , r2 )
−
2µ
4πε 0 r1 r2 r1, 2
2 µ
M
m es la masa reducida de cada electrón de
(M + m )
masa m con respecto al núcleo de masa M, e es la carga del
electrón, ε0 es la permitividad del medio en el sistema
internacional de unidades (SI) y Z es el número atómico del
núcleo, que equivale al número de sus cargas positivas.
donde µ =
Este operador puede expresarse en términos de unidades atómicas:
1
Z Z
Hˆ = − 12 ∇ r21 − 12 ∇ r22 − − +
r1 r2 r1, 2
y la ecuación de Schrödinger:
1 2 1 2 Z Z
1 −
∇
−
∇
−
−
+
2 r1 2 r2
ψ (r1 , r2 ) = Eψ (r1 , r2 )
r1 r2 r1, 2
© Reservados todos los derechos de reproducción. Luis A. Montero Cabrera, Universidad de La Habana, Cuba, 2003.
Fundamentos de Química Teórica
La función de onda bielectrónica puede tener las formas:
ψ = ±ψ (r1, r2 )
Cuando se cumple con el signo + se denotan como ψ + (r1 , r2 ) y se
denominan espacio – simétricas. Cuando se cumple con el signo –
se denotan como ψ − (r1 , r2 ) y entonces se llaman espacio –
antisimétricas.
Los estados espacio – simétricos se denominan para y los espacio
antisimétricos como orto.
© Reservados todos los derechos de reproducción. Luis A. Montero Cabrera, Universidad de La Habana, Cuba, 2003.