para descargar el archivo
Anuncio

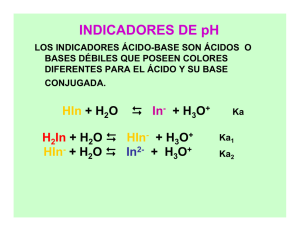
Cátedra I Química General II Autor I Ana Baruzzi, Carla Giacomelli SOLUCIONES AMORTIGUADORAS (SOLUCIONES BUFFER) Es una solución que resiste los cambios de pH. Son soluciones mixtas formadas por un ácido débil y su base conjugada o por una base débil y su ácido conjugado. Para entender cómo funciona un buffer veamos cómo resiste los cambios de pH. Calcular que pasa cuando a 1 L de agua se le agrega 0,1mL de HCl 1 M. Se están agregando 0,1.10-3 moles. Despreciando el cambio de volumen la nueva concentración de HCl es 0,1.10-3 M. Por lo tanto el nuevo valor de pH=4. Es decir que el agregado de esa cantidad produjo un cambio de 3 unidades de pH (7 a 4) Qué pasa cuando esa misma cantidad se agrega a un litro de solución mezcla de Acido Acético 0,05 M y Acetato de Sodio 0,05 M ?? 1) Calculemos el pH de esta solución antes del agregado a) Plantear los equilibrios + HA (aq) ⇔ H (aq) + A -(aq) A - + H 2 O (l) ⇔ HA + OH b) Constante de Equilibrio [H + ][A - ] Ka = [HA] c) Aproximaciones Las concentraciones de HA y de A- en la expresión, son las del equilibrio, no las iniciales con las cuales se preparó la solución . Pero como los equilibrios están desplazados hacia la izquierda, se puede despreciar lo que proviene de ambas reacciones d) Cálculo De esta manera la Ka se puede escribir: [ ] + [H ]x 0,05 Ka = → Ka = H+ 0,05 En general se puede escribir para estas soluciones , cuando las C no son iguales : ] pH = pKa - log [[HA A- ] pH = pKa + log C base C ácido Ecuación de Henderson- Hasselbalch Cuanto valen α0 y α1 ?? En el caso de que las concentraciones sean iguales α0 = α1 =0,5 2) Calculemos el pH de la nueva solución Si agrego un ácido y tengo una especie ácida (HA) y una básica (A-) con cual de las dos reaccionará?? Cuáles serán las nuevas concentraciones de A- y de HA??. + H (aq) + A -(aq) ⇔ HA (aq) La [A - ] disminuye y la [HA ] aumenta Cuánto ? Cinicial de ácido + 1x10-4 = C final de ácido = 0,05 + 1x10-4 = 0,0501 Cinicial de base − 1x10-4 = C final de base = 0,05 − 1x10-4 = 0,0499 pH = pKa + log C base C ácido = 5 + log 00,,0499 0501 = 4,99 Tiene sentido que el pH disminuya? Cuánto disminuyó con respecto al inicial? Compare con el caso en que se agrega la misma cantidad de ácido fuerte al agua Este pequeño cambio de pH esta relacionado con la capacidad reguladora de una solución buffer. La capacidad de controlar el pH es mayor mientras más parecidas son las concentraciones de ácido y base. A medida que los valores de α se alejan de 0,5 esa capacidad reguladora disminuye. Cuánto vale el pH de una solución amortiguadora preparada con Concentraciones iguales de amoníaco y cloruro de amonio?? Siempre es conveniente trabajar con Ka NH NH + 4(aq) + H 2 O (l) ⇔ H + + NH 3(aq) + H 2 O (l) ⇔ NH + 4(aq) 3(aq) + OH (aq) [NH 3 ][H 3O + ] -14 −5 −10 Ka = = Kw / K = 1.10 / 1 , 8 . 10 = 5 , 5 . 10 b [NH +4 ] pH = 9,25 α 0 ≅ 0,5 pOH = 4,74 α1 ≅ 0,5 Calcular la relación de concentraciones HA/A- para preparar un litro de buffer de pH = 4,5, siendo pKa= 5 [H + ][A - ] Ka = [HA] pH = 4,5 [H + ] = 3,16.10 −5 Ka = 10 −5 [A - ] = [HK+a ] = 0,316 [HA] Tiene sentido que la concentración de A- sea menor que la de HA? Sí, porque el pH es menor que el pKa Si la Ca es= 0,1 , cual será la concentración de cada especie?? Conociendo el cociente y la suma se pueden calcular ambas concentraciones