Revista digital de Ecografía Clínica
Anuncio

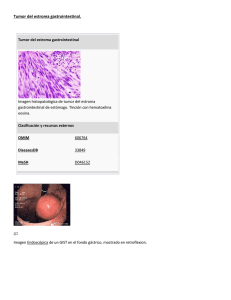
EuroEco Revista digital de Ecografía Clínica Caso clínico Tumor de la estroma gastrointestinal Junio, 2012 Volumen 3, número 2 la altura del ombligo, más o menos hasta la bifurcación de las iliacas a partir de la aorta abdominal. Durante la exploración del resto del abdomen no se observan alteraciones relevantes (figuras 1, 2 y 3, y vídeo 1). 1María Carmen Vidal García, 1Mercedes Ignacia Ferreira González, 1Adela Balado Carballido, 2Roberto Fernández Álvarez, 3Pedro Javier Cañones Garzón 1Centro de Salud Valle Inclán. Orense- 2Centro de Salud de Allariz (Orense)- 3Centro de Salud Isla de Oza. Madrid Paciente de 79 años de edad, diagnosticado de arritmia cardiaca por fibrilación auricular e hipertrofia benigna de próstata, que se encuentra en tratamiento con digoxina, irbesarstán, hidroclorotiazida, furosemida, acenocumarol, dutasterida y tamsulosina. Hace 3 años se le descubrió mediante TAC una masa abdominal en la fosa iliaca derecha, adyacente al ciego, de aproximadamente 5 cm de diámetro, de bordes regulares. La hipótesis diagnóstica era la de una masa sólida apendicular, que podía corresponder a un tumor carcinoide, a un carcinoma o a un pseudomixoma. No fue intervenido ni tampoco se completó el estudio diagnóstico en aquel momento. Acude a consulta por malestar general, sensación de pesadez hipogástrica e incremento de su sintomatología prostática. En la exploración se palpa una gran masa que ocupa todo el hipogastrio y ambas fosas iliacas, por lo que se procede a efectuar una exploración ecográfica. Figura 2. Figura 3. VÍDEO 1 Figura 1. En ella se aprecia una masa heteroecoica que se extiende desde la fosa iliaca derecha hasta prácticamente la fosa iliaca izquierda, y desde la región suprapúbica hasta A la vista de estos hallazgos, es remitido para completar el estudio al Servicio de Aparato Digestivo del hospital de referencia. Se le practica TAC abdominal, cuyo informe describe que una tumoración de 117 x 144 mm, centrada entre las asas del intestino delgado y la cavidad pélvica. Se trata de una masa heterogénea, con áreas sólidas que captan contraste y otras hipodensas que pueden corresponder a zonas necróticas de la tumoración. La masa comprime la vejiga, aunque aparentemente no la infiltra. También se identifican al menos dos lesiones nodulares satélites só- Solla Camino JM, Cañones Garzón PJ, Ferreira González MI, Fernández Álvarez R, Vázquez Fernández A. Tumor de la estroma gastrointestinal (GIST). EuroEco 2012;3(2):35-38. 35 EuroEco lidas en la vecindad (26 x 22 mm y 18 x 15 mm, respectivamente). No es posible evaluar la afectación de las asas implicadas del intestino delgado como consecuencia del tamaño tumoral. No se identifican lesiones sugestivas de metástasis hepáticas; tampoco se observan lesiones esplénicas. Existen pequeñas calcificaciones de aspecto puntiforme en la cabeza y el proceso uncinado del páncreas. Todos estos hallazgos sugieren la presencia de una tumoración maligna, compatible con un tumor carcinoide intestinal o también con un tumor de la estroma gastrointestinal. Se efectúa una colonoscopia hasta el ciego, que no consigue valorar adecuadamente toda la extensión explorada como consecuencia de la mala preparación intestinal. Se observan dos pólipos pequeños a 20 y 100 cm del ano, respectivamente, que son extirpados. El estudio histológico de ambos concluye que se trata de adenomas tubulares. El caso es presentado en sesión de Oncología Digestiva y se decide su remisión a Cirugía General para extirpación de la masa abdominal. Mediante intervención quirúrgica se procede a la exéresis de la tumoración abdominal y a la de varias asas de intestino delgado afectadas. Además se efectúa sigmoidectomía, apendicectomía y extirpación de los implantes satélites. El informe de Anatomía Patológica confirma que se trata de un tumor de la estroma gastrointestinal. La evolución postoperatoria es favorable y es dado de alta del hospital al cabo de dos semanas. COMENTARIO Los tumores de la estroma intestinal (GIST, conforme al acrónimo de su nombre en inglés) son las neoplasias de origen mesenquimatoso más frecuentes del tubo digestivo, aunque sólo suponen 0,1-3 % de todas las neoplasias gastrointestinales. Su incidencia es de 20 casos por millón de habitantes y la mediana de la edad en el momento del diagnóstico es de 63-67 años. No hay un predominio claro de ninguno de los sexos a la hora de evaluar su frecuencia de presentación. En el 95 % de los casos son consecuencia de una mutación en el proto-oncogén tirosina-proteín-kinasa (KIT), también conocido como “cluster de diferenciación 117” (CD117). Un tipo especial de GIST, localizado sobre todo en el estómago, expresa un alto porcentaje de mutaciones en el gen del receptor alfa del factor de crecimiento derivado de las plaquetas (PDGFRA). Más de la mitad se desarrollan en el estómago, cerca de 3 de cada 10 en el intestino delgado, 1 de cada 10 en el colon, y en mucha menor medida en el esófago, los epiplones, el mesenterio y el retroperitoneo. Se han descrito tamaños tumorales que alcanzan hasta los 38 cm, pero en el momento del diagnóstico se encuentran en torno a 5 cm. Habitualmente son únicos, pero pueden ser múltiples, lo que debe hacer sospechar agregación familiar o afecciones concomitantes (triada de Carney –mixomas, hiperpigmentación cutánea y afectación de glándulas endocrinas-, neurofibromatosis…). Su crecimiento puede ser expansivo (21 %), pseudo- expansivo (45 %) o infiltrante (24 %). Los dos últimos son los responsables de la inmensa mayoría de casos en que la resección tumoral no llega a ser completa. Pueden ser submucosos, mucosos ulcerados, intraparietales o subserosos. Macroscópicamente suelen mostrar áreas hemorrágicas, necróticas y zonas de degeneración quística. Están formados por células fusiformes (77 %), epitelioides (15 %) o por una miscelánea de ambas (8 %). Estas células se generan en el tubo digestivo, en el tejido epiploideo, en el mesentérico o en el retroperitoneal. Además de CD117, 70-90 % expresan CD34, 20-30 % actina, 8-10 % proteína S-100 y 2-4 % desmina. Tanto el PDGFRA como otros marcadores menos experimentados (proteín-cinasa-C-theta, DOG-1) sólo tienen utilidad en protocolos de investigación. Diagnóstico Los tumores pequeños suelen detectarse casualmente durante intervenciones quirúrgicas o con motivo de exploraciones endoscópicas o de otras técnicas de imagen. Constituyen la tercera parte de todos los casos de GIST y puede identificarse enfermedad metastásica hasta en el 10 % de estos pacientes. En cambio, los sintomáticos suelen ser grandes y se manifiestan habitualmente mediante hemorragia intestinal; así, los pacientes pueden presentar hematemesis, melenas o síntomas y signos de anemia secundaria a hemorragia oculta. También son posibles las náuseas, los vómitos, el dolor abdominal, o bien percibir distensión abdominal o incluso una masa durante la exploración física. En los estudios mediante contraste baritado los tumores aparecen como lesiones submucosas. En la ecografía ofrecen el aspecto de masas hipoecogénicas. Cuando son de gran tamaño pueden contener en su interior áreas quísticas, necróticas o hemorrágicas y desplazar los órganos y estructuras adyacentes. En la endoscopia oral ofrecen el aspecto de lesiones submucosas que en ocasiones muestran áreas centrales ulceradas. La ecoendoscopia sólo debe utilizarse en los tumores localizados en el esófago, el estómago, el duodeno, el ano y el recto. En ellos puede ser empleada como guía para la realización de una biopsia. Para la estadificación tumoral se emplea la TAC y la RMN. Éstas detectan masas sólidas de 30-35 UH en vacío, que alcanzan las 50-60 UH y muestran un realce heterogéneo tras la aplicación de contraste. En el caso de grandes tumores (mayores de 10 cm) la heterogeneidad es más evidente como consecuencia de la existencia de áreas necróticas, hemorrágicas o degenerativas. Diagnóstico diferencial Los GIST pueden ser confundidos con multitud de neoformaciones, cuya relación se recoge en la tabla 1. Cada uno de ellos expresa de preferencia uno o varios marcadores, por lo que la sospecha de la presencia de un GIST obliga a realizar un exhaustivo estudio inmunohistoquímico. Solla Camino JM, Cañones Garzón PJ, Ferreira González MI, Fernández Álvarez R, Vázquez Fernández A. Tumor de la estroma gastrointestinal (GIST). EuroEco 2012;3(2):35-38. 36 EuroEco Tabla 1. Diagnóstico diferencial de los GIST. Fusiformes: • Tumores de músculo liso (leiomiomas, leiomiosarcomas). • Schwannoma y tumor maligno de la vaina nerviosa periférica. • Tumor miofibroblástico inflamatorio. • Tumor fibroso solitario. • Carcinoma sarcomatoide • Pólipo fibroide inflamatorio. Epitelioides: • Carcinomas poco diferenciados. • Carcinomas neuroendocrinos. • Variantes epitelioides de leiomiosarcoma y tumor maligno de vaina nerviosa periférica. Otros: • Melanoma. • Tumores de células germinales. • Angiosarcomas. • Sarcoma de Ewing. • Sarcomas granulocíticos. • Carcinomas indiferenciados de células pequeñas. Tratamiento TUMOR LOCALIZADO La exéresis tumoral completa es la terapia de elección si el tumor es resecable. Se deben garantizar márgenes de resección libres de enfermedad, lo que en ocasiones implica la necesidad de extirpar en bloque órganos y estructuras contiguas al tumor. La resección completa se logra en más del 70 % de las ocasiones, y ello se acompaña de una supervivencia de 34-60 % al cabo de 5 años. Las linfadenectomías regionales no aportan mayor supervivencia, por lo que no suelen practicarse. La rotura del tumor durante la cirugía conlleva un alto riesgo de diseminación peritoneal que lógicamente limita la supervivencia esperada. La recurrencia tumoral se produce en 40-90 % de estos casos, y en 50 % de ellos afecta al hígado. Las recidivas locales y las metástasis tienen el mismo pronóstico y deben tratarse como los tumores avanzados. Los tratamientos adyuvantes (tras la cirugía) y neoadyuvantes (antes de la cirugía) con imatinib se encuentran en fase de investigación y no pueden ser recomendados aún de forma generalizada. TUMORES AVANZADOS Los GIST irresecables o con enfermedad metastásica en el momento del diagnóstico se tratan con mesilato de imatinib; también puede emplearse radioterapia, quimioterapia o embolización de las metástasis. No hay experiencias que avalen la cirugía de rescate en pacientes cuya enfermedad no responde al imatinib. Mesilato de imatinib Es un inhibidor de la tirosín-cinasa cuyo empleo ha modificado radicalmente el curso clínico de una enfer- medad que antes era invariablemente fatal. La dosis recomendada actualmente es de 400 mg diarios, que se administran de forma ininterrumpida hasta que se constata la progresión de la enfermedad o bien hasta que los efectos secundarios en el paciente se hacen insoportables. Generalmente la tolerancia al fármaco es buena. Los efectos secundarios aparecen habitualmente en el transcurso de las primeras 8 semanas de tratamiento. Incluyen retención de líquidos, diarrea, náuseas, fatiga, calambres musculares, dolor abdominal y eritema, además de algunos otros menos frecuentes. La ascitis, el derrame pleural o pericárdico y el edema submucoso extenso son consecuencias de la retención hídrica y es frecuente que coexistan con respuestas parciales al fármaco o con enfermedad estable. Se han detectado casos de resistencia al imatinib. Es importante descartar en primer lugar el incumplimiento terapéutico y en segundo lugar que las interacciones con otros fármacos disminuyan su efectividad. En los casos de resistencia parcial puede emplearse la resección de las metástasis o la radiofrecuencia. Cuando la resistencia es multifocal se puede probar a doblar la dosis del fármaco. Radioterapia Sólo está indicada con intención paliativa en caso de hemorragias tumorales o con el propósito de combatir el dolor. Quimioterapia Los GIST son tumores resistentes a las pautas citotóxicas habituales. En este momento se encuentran en marcha estudios de valoración de la eficacia de nuevos fármacos, cuyos resultados previos avalan la posibilidad de que puedan suponer una opción terapéutica para estos pacientes. Quimioembolización de las metástasis Hasta ahora los resultados obtenidos con esta terapia son mejores que los de la quimioterapia, por lo que puede considerarse una posibilidad alternativa en pacientes con resistencia al imatinib. Factores pronósticos La supervivencia de pacientes con un GIST se ha modificado radicalmente a partir del empleo del mesilato de imatinib como tratamiento crónico de estos tumores. El periodo de supervivencia libre de recaída (SLR) es el parámetro más fiable para valorar el pronóstico vital de estos pacientes. La edad y el sexo no parecen ser determinantes sobre la SLR. En cambio, los GIST de intestino delgado y recto tienen peor pronóstico. En la evaluación anatomo-patológica se pone especial énfasis en determinar el número de mitosis por cada 50 campos de gran aumento (CGA), de forma que éstas y el tamaño del tumor primario constituyen los factores pronósticos más importantes de cara a la SLR. A ellos se ha unido la localización tumoral en un índice elaborado por Miettinen et al, que permite discriminar con bastante Solla Camino JM, Cañones Garzón PJ, Ferreira González MI, Fernández Álvarez R, Vázquez Fernández A. Tumor de la estroma gastrointestinal (GIST). EuroEco 2012;3(2):35-38. 37 EuroEco fiabilidad el riesgo referido a cada tipo de pacientes (tabla 2). El riesgo de recidiva tiene un rango que abarca desde el 2 % en los tumores gástricos de menos de 5 cm y menos de 5 mitosis por 50 CGA, hasta el 90 % en los intestinales mayores de 10 cm y con más de 5 mitosis por 50 CGA. Tabla 2. Índice de riesgo en los tumores de la estroma gastrointestinal según Miettinen et al. Tamaño Riesgo muy bajo Riesgo bajo Riesgo intermedio Riesgo alto 2 - 5 cm > 5 y ≤ 10 cm 2 – 5 cm > 10 cm > 5 y ≤ 10 cm 2 – 5 cm 2 – 5 cm > 10 cm > 5 y ≤ 10 cm >10 cm > 5 y ≤ 10 cm > 10 cm Índice mitótico por 50 CGA Localización BIBLIOGRAFÍA CONSULTADA • • • • Gástrica Intestinal Gástrica Intestinal Gástrica Intestinal ≤ 5 mitosis • > 5 mitosis ≤ 5 mitosis • Gástrica > 5 mitosis Intestinal Seguimiento y valoración de la respuesta La TAC es la técnica empleada para valorar la respuesta al tratamiento. Los realces nodulares y la demostración de neovascularización son signos de de progresión, mientras que el aumento del tamaño tumoral no siempre indica progresión de la enfermedad. La adecuada respuesta al tratamiento se hace patente cuando las lesiones se tornan homogéneas e hipodensas y desaparecen los vasos tumorales y los realces nodulares; constituyen signos de buen pronóstico y suelen ser visibles tras el primer mes de tratamiento. Se considera que la enfermedad está estabilizada si las imágenes de la TAC no se modifican. Las recidivas suelen afectar al peritoneo o al hígado. Se presentan como nódulos intratumorales nuevos o como aumento de tamaño (mayor de 10 cm), sin que se acompañe de disminución de la intensidad de las masas previas. Las metástasis se producen en el hígado y la cavidad peritoneal, y raramente en la pared abdominal, la pleura, los pulmones o los linfáticos. La respuesta al tratamiento de las invasiones peritoneales se produce antes que la de las masas hepáticas; en todo caso, la máxima respuesta suele tardar en producirse 6-12 meses, por lo que conviene mantener el tratamiento al menos durante un año antes de admitir su ineficacia. • • • • • • Artigas-Raventós V, López-Pousa A. Tumores de la estroma gastrointestinal: nuevos conceptos y estrategias terapéuticas multidisciplinarias médico-quirúrgicas. Cir Esp 2006;79:1-2. Fernández Salazar LI, Álvarez Gago T, Sanz Rubiales A, Velayos Jiménez B, Aller de la Fuente R, González Hernández JM. Tumores de la estroma gastrointestinal (GIST): aspectos clínicos. Rev Esp Enferm Dig 2007;99:19-24. Fresno Forcelledo MF. Determinación inmunohistoquímica de CD117/c-kit en el GIST (tumor estromal gastrointestinal). Oncología 2004;27:242-5. Gómez Senent S, Gómez Raposo C, Segura Cabral JM. Tratamiento de los tumores de la estroma gastrointestinal (GIST). Med Clin (Barc) 2006;127:660-8. Marqués Medina E, Palomo Sánchez JC, Cruz Cidoncha A, Cantero Ayllón MJ, Yunta Abarca PJ, Pérez Gil MA, Saiz Jarabo JM. Tumores GIST con morfología quística. Oncología 2006;29:134-7. Muñoz C, Sabah S, Navarro A, Planzer M, Silva C, Santander R. Tumores del estroma intestinal (GIST): revisión de la literatura. Gastr Latinoam 2006;17:43-51. Oyanedel R, O’Brien A, Pizarro A, Zamora E, Menias C. Tumor estromal gastrointestinal (GIST): formas de presentación. Rev Chil Radiol 2005;11:13-8. Pablo Bórquez M. Tumores del estroma gastrointestinal. Rev Med Chile 2006;134:1482. Pablo Bórquez M, Rodrigo Neveu C. Tumores del estroma gastrointestinal (GIST), un particular tipo de neoplasia. Rev Med Chile 2008;136:921-9. Poveda A, Artigas V, Casado A, Cervera J, García del Muro X, López-Guerrero JA, López-Pousa A, Maurel J, Ortega L, Ramos R, Romero I, Safont MJ, Martín J. Guía de práctica clínica en los tumores estromales gastrointestinales (GIST): actualización 2008. Cir Esp 2008;84(supl 1):1-21. Sánchez Hidalgo JM, Muñoz Casares FC, Rufián Peña S, Naranjo Torres A, Ciria Bru R, Briceño Delgado J, López Cillero P. Tumores del estroma gastrointestinal (GIST): factores pronósticos de supervivencia tras citorreducción R0. Rev Esp Enferm Dig 2007;99:703-8. Valera Sánchez Z, Sánchez Gil JM, Díaz Aunión C, Blanco MA, Socas Macías M, Serrano Borrego I. GIST rectal. Rev Esp Enferm Dig 2008;100:373-9. Solla Camino JM, Cañones Garzón PJ, Ferreira González MI, Fernández Álvarez R, Vázquez Fernández A. Tumor de la estroma gastrointestinal (GIST). EuroEco 2012;3(2):35-38. 38