FOSFOLIPASAS Las fosfolipasas son moléculas capaces de romper
Anuncio
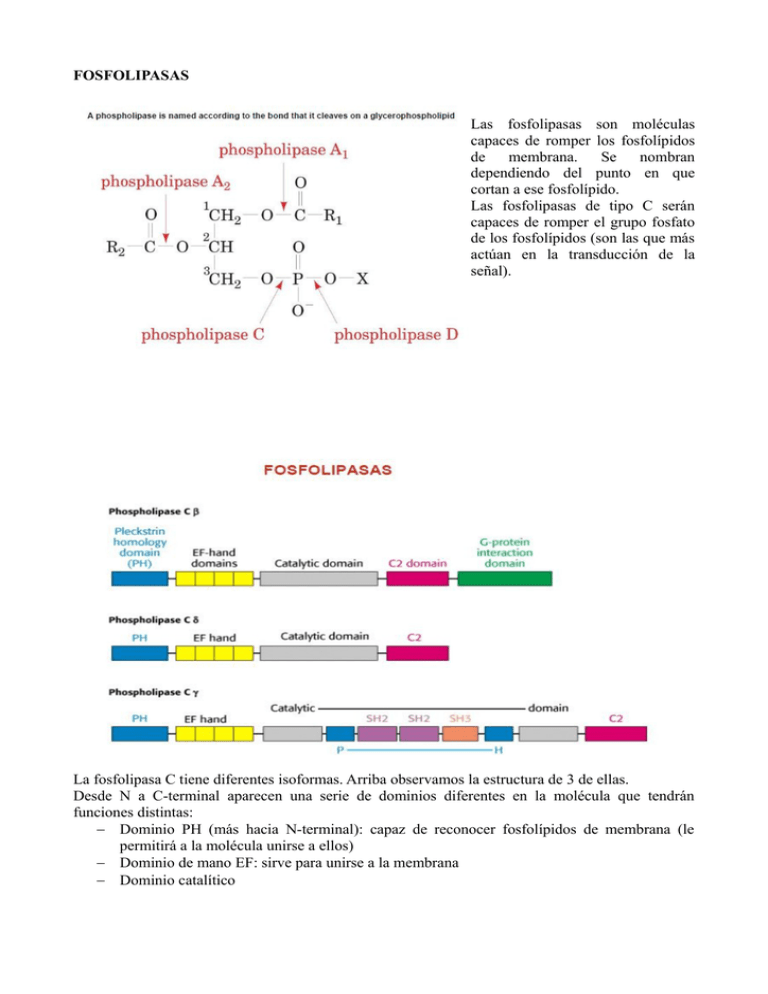
FOSFOLIPASAS Las fosfolipasas son moléculas capaces de romper los fosfolípidos de membrana. Se nombran dependiendo del punto en que cortan a ese fosfolípido. Las fosfolipasas de tipo C serán capaces de romper el grupo fosfato de los fosfolípidos (son las que más actúan en la transducción de la señal). La fosfolipasa C tiene diferentes isoformas. Arriba observamos la estructura de 3 de ellas. Desde N a C-terminal aparecen una serie de dominios diferentes en la molécula que tendrán funciones distintas: − Dominio PH (más hacia N-terminal): capaz de reconocer fosfolípidos de membrana (le permitirá a la molécula unirse a ellos) − Dominio de mano EF: sirve para unirse a la membrana − Dominio catalítico A continuación hay una serie de dominios que son diferentes en las distintas moléculas. Sirven para control o unión de otras moléculas. En el tercer caso el dominio catalítico está dividido en 2 zonas de la molécula (también sucede en otras moléculas de la transducción de señales). Algunos de esos dominios: − Dominio C2 − Dominio de asociación con proteínas G: aparece en el caso de la fosfolipasa C-β, por lo que dicha fosfolipasa actuará a través de receptores de 7 hélices transmembrana que están acoplados a proteínas G. En este esquema aparece la hélice α perpendicular al plano de la diapositiva, así como el dominio de la mano EF. Aquí tenemos representada de nuevo la estructura de la fosfolipasa C con todos los dominios que anteriormente hemos mencionado correspondientemente etiquetados (dominio PH, dominio de la mano EF, dominio C2 y el dominio catalítico a la derecha). No hablaremos más de las lipasas porque cuando veamos la formación de los segundos mensajeros que se producen como consecuencia de la fosfolipasa podremos completar la información. ADENILATO CICLASA La adenilato ciclasa forma el AMPc a partir de ATP, con separación de pirofosfato. El cAMP se forma por tanto debido a las ciclasas. Para la formación del cAMP, la proteína Gαs se tiene que unir a la adenilato ciclasa y activarla por medio de un cambio conformacional.También estaría la guanilato ciclasa, que actúa como receptor de NO, y se forma el GTP cíclico. La acumulación de ambos en el citoplasma va a dar lugar a toda una serie de respuesta celular. En la estructura de la adenilato ciclasa, aparecen 2 dominios estructurales, cada uno con 6 segmentos transmembrana (es una proteína que se sitúa en la membrana plasmática) y los centros activos de estos dominios quedan en el lado citosólico. Observamos uno de los centros activos entre los bucles intracelulares (los podemos llamar como a los de las 7 hélices transmembrana) 6 y 7, y el otro hacia el extremo C-terminal. En estos centros activos es donde puede actuar la subunidad αs que los activa, o bien la subunidad αi que los inhibe (los mantiene inactivos o los inactiva). Cuando los centros activos están activados se produce el cAMP. Aquí el extremo N-terminal está en el interior de la célula (a diferencia de los receptores de 7 hélices transmembrana, donde quedaba fuera y sufría glicosilaciones). ACTIVACIÓN Y DESACTIVACIÓN DE LA AC (ADENILATO CICLASA) − Activación: l receptor se une a la hormona, las proteínas G se activan y se unen a la AC, la cual forma cAMP y provoca la respuesta celular. − Inactivación: para pasar a estado inactivo, la proteína G se separa y se inactivan ambas (proteína G y AC). SEGUNDOS MENSAJEROS Los segundos mensajeros principales son: – cAMP, cGMP – Ca2+ – IP3 (inositol 1,4,5-trisfosfato) – DAG (diacilglicerol) Los sistemas efectores son los encargados de modificar los niveles de segundos mensajeros en el interior de las células para lograr cambios en la actividad celular. Tanto la adenilato ciclasa como las fosfolipasas serían sistemas efectores, porque producirán el segundo mensajero y a la vez reciben la fracción de DNA directamente de receptores. Los segundos mensajeros que nombramos arriba se van a formar bien a partir de AC o bien a partir de las lipasas: – IP3 y DAG: formados por las lipasas – cAMP y cGMP: por las lipasas El ión calcio tiene diferentes formas de aumentar su concentración en la célula y de llevar a cabo su respuesta celular. Podemos ver el receptor con su ligando y una adenilato ciclasa activada, que formará cAMP. Esto provoca la activación de PKA. Las subunidades catalíticas de la PKA pueden entrar al núcleo y fosforilar a determinadas moléculas que vayan a estar implicadas en la transducción. Un ejemplo es el CREB, que fosforilado se une a la proteína CBP, y en conjunto se unen al promotor de un gen, activando la maquinaria de transcripción. Por tanto, la transcripción de determinados genes es una de las respuestas relacionadas con el cAMP. Esta es otra respuesta, en este caso de tipo metabólico (ya no usa la vía del control de la transcripción y la biosíntesis de nuevas proteínas) que va a activar proteínas que ya se encuentran en la célula. Muestra el control de la actividad de la triacilglicerol lipasa en células del tejido adiposo mediante una cascada mediada por cAMP. La interacción H-R activa la AC, que produce cAMP. Éste activa la proteína kinasa, que activa la triacilglicerol lipasa por fosforilación (gracias a ATP ). Dicha enzima queda activada y unida a un grupo fosfato, y a su vez gracias a una fosfatasa se inactivará (ciclo de activación – inactivación). La triacilglicerol lipasa activa hace que los TAG pasen a diacilglicerol y ácidos grasos, luego a monoacilgliceroles y ácidos grasos, y finalmente a glicerol y ácidos grasos. La respuesta por tanto del aumento del cAMP es un aumento de glicerol y ácidos grasos en la célula. El cAMP no puede tener una vida muy larga en la célula sin dar problemas, con lo que se inactiva por acción de la fosfodiesterasa del cAMP a 5´- AMP. Esta fosfodiesterasa tiene algunos inhibidores como la teína (se encuentra en café, té, chocolate) o la teobromina (es un alcaloide). Manteniendo altos niveles de cAMP conseguimos mantener las células más activas (sería uno de los efectos de la cafeína). IÓN CALCIO Aparece coordinado a diferentes moléculas de agua (a 7), no en forma de ión con 2 electrones libres. En la célula podemos encontrar diferentes bombas de calcio que serán capaces de mantener unos determinados niveles de calcio (la concentración de calcio extracelular es mucho mayor que la intracelular). A la izquierda aparece un intercambiador de calcio y sodio, y a la derecha una bomba de calcio (requiere ATP para sacar calcio). En la célula existen diferentes lugares en los que se almacena el calcio: – membrana del retículo endoplásmico: hay bombas que meten calcio ahí – mitocondrias (también hay bombas que lo introducen en la matriz mitocondrial) El calcio no se va a encontrar libre mucho tiempo en el citoplasma, sino que se suele unir a proteínas como la calmodulina. Este dibujo muestra cómo se une el calcio a las proteínas: es una mano EF donde el calcio se colocaría como se ve, y se coordina con diferentes aminoácidos de la proteína. Observamos dos hélices α y una lámina plegada β. La calmodulina por ejemplo tiene este tipo de dominio. La calmodulina va a captar calcio del citosol, uniéndose a 4 iones calcio. Es una proteína con un segmento N-termina y otro C-terminal unidos por una hélice. Aparecen zonas hidrofóbicas en los extremos. Se sitúan dos iones calcio en cada uno de los dos polos. Cada polo a su vez tiene 2 manos EF, y hay una zona intermedia que le da la capacidad de movimiento y cambio de conformación a esa proteína. La calmodulina se va a unir a la calmodulina kinasa I (CaM kinasa I). En la estructura de esta CaM kinasa I vemos un péptido en el que actúa la calmodulina, activando a CaM kinasa I. A la calmodulina se le unen los 4 iones calcio, cambia su conformación, se le une la CaM kinasa I y al hacerlo, la calmodulina “engloba” al péptido del que hablábamos antes y consigue la activación de la CaM kinasa I. El calcio se une a: – 1 molécula de agua – 1 residuo de ácido glutámico – 3 residuos de ácido aspártico – la cadena principal Con estos aminoácidos es con los que se combina en la estructura de mano EF. Aquí aparecen los puntos de unión del calcio a la calmodulina en los 2 extremos y el segmento intermedio que es flexible (es una hélice α), capaz de abrazar al péptido de la CaM kinasa I. Así, hay 2 zonas globulosas en los extremos, y en cada una de esas zonas con segmentos en mano EF. Cuando aumenta la concentración de calcio en el citoplasma se une a la calmodulina y se activa la CaM kinasa I. Cuando se pierde calcio y calmodulina se inactiva CaM kinasa I y vuelve al punto de inicio el ciclo. Hay una activación independiente de calcio en la que solo una parte de las moléculas están en forma activa. Una fosfatasa separaría el grupo fosfato, dejando totalmente inactiva a la proteína porque tiene su dominio catalítico tapado por un dominio inhibidor (no está expuesto y no se pueden unir los substratos). Aparecen aquí una serie de vías en la célula mediadas por la unión de calmodulina y de otras proteínas. Hay diferentes receptores y diferentes funciones (exocitosis, división celular, forma de la célula y movilidad, transducción de la señal, metabolismo...). Así, hay muchas funciones en la célula en las que está implicado el calcio. En el citosol hay una serie de proteínas kinasa (como la CaM kinasa I), fosfodiesterasas... que están implicadas. Dentro del RE vemos almacenado el calcio, y tiene unos receptores que permiten la salida al citoplasma del calcio en determinadas situaciones. Vemos por ejemplo la CaM kinasa II en el núcleo, relacionada con la transcripción. IP3 Y DAG Tanto IP3 como DAG proceden de la hidrólisis de PIP2 (PI 4,5-bisfosfato) que está en la membrana plasmática. De los fosfolípidos de membrana se pasa del fosfatidil inositol por la acción de kinasas a PIP2, que será sustrato de fosfolipasa C (es la que formará dichos mensajeros, rompiendo el enlace y formando cada uno por un lado). La fosfolipasa C-β rompe el enlace fosfodiéster. El DAG queda anclado a la membrana mientras que el IP3 se liberará. Ambos tendrán que activar rutas diferentes pero en algunos casos activan a la misma proteína kinasa. En principio el DAG activa a la PKC y el IP3 va a liberar calcio del retículo endoplásmico. El aumento de calcio del citoplasma contribuye también a la activación de la PKC. Tenemos el papel del glicerol en la señalización celular. La hormona se une al receptor y acaban activando a la fosfolipasa C. La subunidad de la proteína G (qα) activa a la fosfolipasa C, la cual rompe PIP2 y forma DAG y IP3. El DAG activa a PKC, y el IP3 se une a unos receptores en la membrana del retículo endoplásmico, abriendo canales y sale calcio al citoplasma. Este calcio ayuda a la activación de la PKC, pero también se une a calmodulina y a CaM kinasa I (la activa, haciendo que contribuya a las respuestas celulares una vez que tiene fosfato). Además, una vez que el IP3 activa canales de calcio pierde el grupo fosfato gracias a una fosfatasa (inositol polifosfato 1-fosfatasa) y se inactiva (IP2). El segundo mensajero, una vez que ha transducido la señal se desactiva (vida media corta). Otro caso en que el IP3 tiene función es en el caso de la formación de NO. Dadas células endoteliales y musculares lisas de los vasos sanguíneos, la acetilcolina se une a su receptor (relacionado con proteínas G). Estas proteínas activan a la fosfolipasa C, que producen IP3, el cual aumenta niveles de calcio en citoplasma (se une a calmodulina). La NO sintasa tenía entre sus cofactores a la Ca-calmodulina, por lo que se activa, produciéndose NO que va a células cercanas. El NO produce cGMP, que activa a PKC (produce relajación de las células del músculo liso de los vasos sanguíneos). El DAG, bien pasa a glicerol fosfato o bien se descompone en ácidos grasos y glicerol. Pasado un tiempo ya no existe como 2º mensajero y ya no podrá activar la PKC. El PIP3 pasa a inositol y también desaparece. Aquí tenemos vías en las que va a actuar el DAG y una serie de respuestas celulares que se sabe que produce (se activan células y se produce una transducción intracelular a través de DAG). Se trata de moléculas sobre las que va a actuar (relación con proliferación, supervivencia, apoptosis, señalización de células inmunes, sistema inmune, expresión genética, inflamación, movilidad del citoesqueleto...) Algunos están en varias vías, como la señalización del sistema inmune, la expresión génica o la proliferación. Así, a través de la activación de diferentes kinasas existen vías que en muchos casos van a coincidir en el mismo tipo de respuesta celular, aunque ésta es bastante variada. En el RE endoplásmico vemos la salida del calcio, que produce una serie de respuestas celulares mediadas por la PKC que se fosforila. Un receptor unido a proteínas G activa la AC, que produce cAMP y activa PKA. Al actuar sobre canales de calcio en la superficie celular permiten la entrada del calcio al RE. Si ese calcio sale puede provocar la contracción celular. La epinefrina y la noreprinefrina actúan sobre receptores de este tipo. PIP2 se une también a una proteína llamada “Tubby” que se encuentra en el cerebro de ratones. Cuando faltan, los ratones engordan. Cuando la fosfolipasa se activa, separa PIP2 de esta proteína, que queda libre. Se transcriben en el núcleo sus genes, que parecen estar relacionados con la cantidad de grasa en el cuerpo de los ratones. Sería otro tipo de respuesta mediada por la fosfolipasa C (si está activa produce todo esto).



