Impacto de las entidades polimórficas en la pre
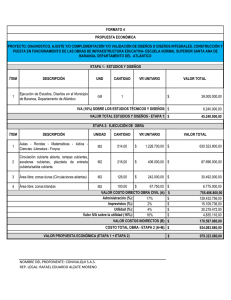
Anuncio

Impacto de las entidades polimórficas en la pre-formulación farmacéutica, considerando las herramientas para el diseño estadístico y la gestión de riesgos" Duración: 4 sesiones de 5 horas cada una Fechas: viernes 13 y 27 de Mayo de 16 a 21 Hrs., sábados 14 y 28 de Mayo de 9 a 14 Hrs. Sede: oficinas de la Asociación Farmacéutica Mexicana, A.C. OBJETIVOS DEL CURSO 1. Conocer los aspectos fisicoquímicos que influyen en la pre-formulación farmacéutica y algunas técnicas novedosas para la caracterización de principios activos y excipientes. 2. Exponer los criterios esenciales para la definición de variables y la selección de un diseño experimental que permita optimizar los procesos de formulación y fabricación de medicamentos. 3. Familiarizar al participante con la terminología estadística básica y con el establecimiento de los pasos a seguir en la planeación de un experimento, considerando los recursos, componentes de la fórmula y metodologías analíticas y centrando la atención en cuatro aspectos clave: a. Selección del diseño adecuado b. Análisis estadístico de los resultados c. Interpretación de resultados. d. Uso de paquetes o programas en el cálculo estadístico. 4. Describir la importancia que tiene la caracterización cristalográfica y la identidad polimórfica de un principio activo sobre sus propiedades físicas, químicas, farmacológicas, tecnológicas y biofarmacéuticas, así como su impacto en la industria farmacéutica. 5. Comprender los principios del modelo de la gestión del riesgo y su importancia en los procesos del desarrollo de fármacos y medicamentos. CONTENIDO TEMÁTICO SESIÓN 1 INTRODUCCIÓN A LA PRE-FORMULACIÓN Mariana Ortiz Reynoso. (3 horas). UAEMex 1. Introducción a. Consideraciones generales en la pre-formulación según la forma farmacéutica a desarrollar: sólidos, semi-sólidos, líquidos y aerosoles. 2. Aspectos a considerar en la caracterización de los principios activos y excipientes a. Caracterización fisicoquímica y su impacto en el desempeño tecnológico y biofarmacéutico b. Algunas técnicas novedosas para caracterizar principios activos y excipientes i. Disolución intrínseca ii. Disolución aparente iii. Difracción de rayos láser iv. Microscopía automatizada y análisis de imagen v. Ensayos de solubilidad, permeabilidad y coeficiente de partición vi. Pruebas de perfil de flujo vii. Otras técnicas 3. Aspectos a considerar en la estabilidad de fármacos y excipientes SESIÓN 2 DISEÑO ESTADÍSTICO DE EXPERIMENTOS APLICADO A LA PRE-FORMULACIÓN DE MEDICAMENTOS Dr. Sergio Alcalá Alcalá. (7 horas). UAEMor 1. Introducción a. Ciclo de vida de un producto farmacéutico y su estadística b. Planeación del Diseño de Experimentos 2. El Diseño de Experimentos (DDE) a. Principios estadísticos (tipo de variables, factores, niveles, tratamientos, significancia estadística) b. Herramientas estadísticas (intervalos de confianza, análisis de varianza y prueba de hipótesis) c. Clasificación de los diseños y criterios de selección d. Principios básicos del DDE (aleatoriedad, replicación y bloqueo) 3. Diseños para estimar efectos de variables no consideradas a. Diseños de bloques completos al azar 4. Diseños exploratorios o para estudiar el efecto factor-respuesta a. Diseños 2k y 3k b. Ejemplos empleando diseños factoriales y fraccionados 5. Diseños para optimizar procesos y formulaciones a. Metodología de Superficie de Respuesta 6. Diseños de mezclas SESIÓN 3 SÓLIDOS CRISTALINOS M. en C. Cuauhtémoc Carrasco Pacheco. (5 horas). Signa, S.A. de C.V. 1. Bases conceptuales del estado sólido. 2. Amorfos, polimorfos, solvatomorfos y cocristales. 3. Enantiotropismo. 4. Polimorfismo en principios activos (API's) y su impacto en las propiedades físicas, químicas, farmacológicas, tecnologías y biofarmacéuticas. 5. Métodos de análisis y control. 6. Diseño de un proceso de manufactura considerando las características del estado sólido del API. SESIÓN 4 GESTIÓN DEL RIESGO EN LAS ETAPAS INICIALES DEL DESARROLLO Dr. Miguel Lazcano Seres. (5 horas). Consultor Independiente 1.- Marco conceptual y regulatorio. 2.- Modelo de gestión de riesgo. 3.- Conocimiento, ciencia y tecnología en la gestión de riesgo. 4.- Gestión de riesgo como soporte del sistema de calidad. 5.- Calidad por diseño / control de cambios / ciclo de vida / CAPA / mejora continua Materiales necesarios: -Computadora personal con Excel y versión Statgraphics XVI -Notas, guías y material didáctico CUOTAS PROFESIONISTA ASOCIADO, PAGO PERSONAL PROFESIONISTA ASOCIADO, PAGO POR EMPRESA ACADEMICO ASOCIADO PROFESIONISTA NO ASOCIADO, PAGO PERSONAL PROFESIONISTA NO ASOCIADO, PAGO POR EMPRESA ACADEMICO NO ASOCIADO ESTUDIANTE ASOCIADO ESTUDIANTE NO ASOCIADO Informes e inscripciones Adriana Linares Asociación Farmacéutica Mexicana, A.C. Nicolas San Juan # 1511 Col. del Valle Tel. 91832060 Ext. 1064 [email protected] $3,600.00 $4,800.00 $3,000.00 $5,500.00 $7,000.00 $3,250.00 $1,500.00 $2,700.00