LA MED compresion 10
Anuncio

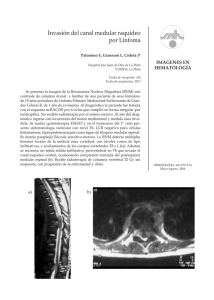
LA MED compresion 10 la ila as co a; 20/4/04 12:37 Página 1 LA MEDICINA HOY Compresión medular A. Martínez Yelamos y M. Huerta Villanueva d Servicio de Neurología. Hospital de Viladecans. Barcelona. España. n RECUERDO ANATÓMICO de s, s, ola La médula espinal forma parte del sistema nervioso central y se extiende desde la unión craneovertebral hasta la parte inferior del cuerpo vertebral L1. Está formada por una serie de tractos ascendentes y descendentes (la sustancia blanca medular) que rodean una zona central con forma de H donde residen los cuerpos neuronales (la sustancia gris). En las astas anteriores de la sustancia gris se hallan los cuerpos de las neuronas motoras y en las posteriores los de las sensitivas. En la región torácica de la médula espinal existe una tercera asta (intermedio lateral) que contiene las neuronas autonómicas. Los tractos ascendentes y descendentes se describen en función de la zona por la cual transitan en la médula espinal. Así, por la porción más dorsal transcurren los cordones posteriores de Goll y Burdach (sensibilidad posicional y vibratoria), por la porción lateral los fascículos espinotalámico lateral (sensibilidad dolorosa y térmica), espinocerebeloso y la vía piramidal cruzada (90% de las fibras), y por la región ventral de la médula transitan los fascículos espinotalámico anterior, reticulospinal y la vía piramidal directa (fig. 1). Las fibras de los tractos de la médula tienen una disposición somatotópica; por ejemplo, en la vía piramidal las fibras que transmiten impulsos a las zonas más distales (piernas) viajan más laterales que las que los transmiten a las zonas más proximales, que son más mediales. Lo mismo sucede con el fascículo espinotálamico y los cordones posteriores. Por otro lado, las vías medulares se decusan en diferentes niveles para llegar al hemisferio cerebral contralateral. De esta forma, la vía piramidal en su trayecto descendente sufre la decusación en el bulbo, de forma que una lesión en el lado derecho de la médula provocará una paresia en dicha localización. Los cordones posteriores se decusan en el tronco cerebral (protuberancia). Sin embargo, las fibras que forman el fascículo espinotalámico se decusan uno o dos niveles por encima de su entrada en la médula espinal; por ello, una lesión medular derecha provocará una disminución de la sensibilidad algésica y térmica izquierda (cruzada) (fig. 2). CLÍNICA DE COMPRESIÓN MEDULAR La clínica que presenta un paciente con compresión medular es la derivada de la afección de las estructuras anatómicas lesionadas. En general, se podría afirmar que aparecerá una serie de alteraciones por afección de los diferentes tractos y de la sustancia gris medular que compondrán diferentes síndromes clínicos, descritos posteriormente. La primera alteración, y quizás también la más variable, pero la que precisamente puede proporcionar más información clínica, sería el dolor. Podríamos definir diferentes tipos de dolor. Así, el paciente puede presentar un dolor por afección ósea, de ligamentos o estructuras vecinas. Dicho dolor aumentará con la palpación/presión de la zona y nos servirá para localizar el lugar de la lesión. En ocasiones el dolor puede estar referido, por ejemplo, a los hombros si la afección es cervical, y a las caderas si es lumbar. 50 JANO 30 ABRIL-6 MAYO 2004. VOL. LXVI N.º 1.519 Fascículos de Goll y Burdach Cordón posterior Fascículo piramidal cruzado Fascículos espinocerebelosos anterior y posterior Raíz posterior Asta posterior Sustancia gris Asta intermedia lateral Sustancia blanca Asta anterior Fascículo espinotalámico lateral Fascículo espinotalámico anterior Raíz anterior Fascículo piramidal directo Fascículo reticulospinal medial Figura 1 Esquema de un corte transversal de la médula espinal. Haces ascendentes y descendentes. Fascículos de Goll y Burdach Cordón posterior Fibras propioceptivas Fibras termoalgésicas Haz espinotalámico lateral Fibras motoras Figura 2 Esquema de un corte transversal de la médula espinal. Trayecto de las vías sensitivas y motoras intramedulares antes de formar parte de los fascículos. Las fibras para la sensibilidad táctil y algésica se decusan a su entrada en la médula, mientras que las fibras de la sensibilidad vibratoria y propioceptiva y las motoras lo harán en el tronco del encéfalo. Generalmente, es un dolor agudo e intenso, que va en aumento, con una evolución dependiente de la etiología. De esta forma, el dolor será más o menos agudo en función de si la afección es brusca (hemorragia, infarto, hernia, fractura), progresivo si aumenta durante días en los pacientes con abscesos o tumores, y crónico en casos de espondilosis, siringomielia, tumores intradurales extramedulares1. Otro posible tipo de dolor sería el radicular. No es tan indicativo de la localización de la lesión si no se acompaña de alteraciones sensitivas (parestesias-hormigueos)1. Dichas parestesias se presentan en la zona más distal del territorio correspondiente a la raíz afectada. La afección intrínseca o funicular de las propias vías sensitivas podría producir un dolor urente o quemante. Este dolor es generalmente un signo tardío, se inicia en las zonas distales del cuerpo (pies, piernas, periné…) y es más probable que aparezca en caso de afección de los cordones posteriores1. (1776) LA MED compresion 10 20/4/04 LA MEDICINA HOY 12:37 Página 2 Compresión medular A. Martínez Yelamos y M. Huerta Villanueva La afección de las vías motoras (principalmente la piramidal) repercute sobre la fuerza muscular. Sin embargo, se considera debilidad clínica una pérdida superior al 50% de las fibras de las vías o las células del asta anterior1. La afección de las vías producirá una alteración de los reflejos y el tono muscular de forma paralela a la velocidad de aparición de la debilidad. Así, en lo que se denomina shock medular, la lesión aguda de las vías motoras, se produce una paraplejía con hipotonía, arreflexia y reflejos cutáneos abolidos, incluido el cutáneo plantar. Si el cuadro es más lento, se acompañará de hiperreflexia, signo de Babinski y, generalmente, espasticidad1,2. En estos últimos casos el paciente refiere con frecuencia más sensación de torpeza al caminar o al mover las manos que una verdadera pérdida de fuerza. Si la lesión en la vía motora descendente no afecta la vía piramidal sino las neuronas del asta anterior de la médula, la debilidad irá acompañada de cambios tróficos en el músculo (atrofia) y de signos de denervación (fasciculaciones)2. La lesión que afecta al canal medular por debajo de donde acaba el cordón medular (caudal a L1) es un síndrome especial de afección medular. En estos casos, lo único que se afecta son las raíces lumbares y sacras, que descienden intrarraquídeas hasta el punto donde emergen por sus respectivos agujeros de conjunción, por lo que la afección motora se acompaña de una hiporreflexia aquílea y/o rotuliana y de alteraciones sensitivas de localización específica1,2. La afección medular suele proporcionar unos síndromes típicos de afección sensitiva hallados en la exploración neurológica. La diversidad de síntomas positivos (parestesias, disestesias) o negativos (hipoalgesia, hipoestesia) que puede presentar un paciente y las posibles dificultades de éste para describirlos (hormigueos [parestesias], agujas; descargas [disestesias]; adormecimiento, entumecimiento [hipoestesia-hipoalgesia]) pueden interferir la evaluación de la función sensitiva1. Si la afección se produce en los cordones posteriores suele haber una disminución de la sensibilidad posicional y vibratoria con conservación de los reflejos. Si esta pérdida se acompaña de un nivel, se puede identificar por encima de la lesión. Si la afección está “suspendida” en una serie de dermatomas y afecta la sensibilidad térmica y algésica con conservación de la táctil y vibratoria, la lesión será centromedular en la zona correspondiente, aproximadamente donde se localiza el déficit suspendido. Si la pérdida de sensibilidad es algésica y táctil en un lado y posicional y vibratoria en el otro, se trata de una hemisección medular o síndrome de Brown Sequard. La pérdida de sensibilidad en el tronco y una pierna con conservación de la sensibilidad perineal sugiere una lesión compresiva, mientras que la afección de la sensibilidad perineal y la región superior de las nalgas sugiere una lesión de cola de caballo o cono medular1-3. Por último, el paciente puede presentar alteraciones esfinterianas, principalmente vesicales. Generalmente, sin embargo, no suelen ser precoces, excepto si hay una afección del cono medular o la cola de caballo. El signo más evidente de afección vesical es la incontinencia si el cuadro es de evolución lenta y, si es agudo o subagudo, aparece una retención de orina con incontinencia por rebosamiento1,2. SÍNDROMES DE COMPRESIÓN MEDULAR Síndrome centromedular de Scheneider o parálisis cruzada Está causado por enfermedades que lesionan la médula espinal desde el centro. Característicamente, si la lesión se localiza en la zona cervical, ésta produce una pérdida de fuerza de ambas extremidades superiores, más grave en las manos, y con atrofia y fasciculaciones por afección de las neuronas motoras de la sustancia gris me54 JANO 30 ABRIL-6 MAYO 2004. VOL. LXVI N.º 1.519 dular si la evolución es lenta. La afección sensitiva es leve y puede detectarse un síndrome sensitivo suspendido algésico y térmico por afección de las fibras que se decusan en la zona de la lesión1-3. Síndrome de hemisección medular El cuadro clínico clásico consiste en debilidad de las extremidades homolaterales a la lesión con afección de sensibilidad vibratoria y artrocinética del mismo lado y termoalgésica contralateral. Generalmente, la afección es más importante en las extremidades inferiores, dado que las lesiones comprimen la médula desde fuera. Si el cuadro es agudo, se asocia a un shock medular (descrito previamente) con hiporreflexia e hipotonía añadidas a la pérdida de fuerza, y si el cuadro es crónico o subagudo se asociarán hiperreflexia y espasticidad3. Síndrome de sección medular completa Se caracteriza por la pérdida de fuerza y de todas las sensibilidades por debajo de la lesión. Son posibles las asimetrías (p. ej., por una mayor afección de la vía piramidal de un lado que del contralateral). Por tanto, aparecerá paraparesia o tetraparesia, con una alteración de la sensibilidad vibratoria, posicional, térmica, algésica y táctil junto con una afección esfinteriana3. Síndrome del agujero occipital Lo componen las lesiones que produzcan una compresión medular en esta zona. Un signo clínico es la cefalea occipital, que aumenta con las maniobras de Valsalva, asociada en ocasiones a un síncope. Otras manifestaciones clínicas serían la presencia de vértigo posicional con nistagmo vertical hacia abajo, no habitual con maniobras de reequilibrio, o los cuadros de afección bulbar progresiva con disfagia, disfonía, incontinencia de esfínteres, etc.3. Síndrome del cono medular. Síndrome de cola de caballo El síndrome del cono medular se caracteriza por la presencia de una afección vesical y del esfínter anal precoz, junto con una hipoestesia perineal, sin déficit motor si la afección es pura, pero con un deterioro de la función motriz distal de las piernas (L4-S2) y la ausencia de reflejo aquíleo si se ha lesionado el epicono. En el síndrome de cola de caballo aparecen diferentes síntomas: dolor lumbar bajo, paresia de las extremidades inferiores con arreflexia y atrofia, junto con afección esfinteriana. ETIOLOGÍAS DE LA COMPRESIÓN MEDULAR Las causas de compresión medular se clasifican tradicionalmente, según la localización del proceso, como extradurales, intradurales, extramedulares e intramedulares. Se ofrece un resumen de éstas mismas en la tabla I. Lesiones extradurales Es frecuente que las lesiones de origen extradural se inicien clínicamente con dolor local en relación con la afección de las estructuras de origen, con dolores irradiados de tipo radicular y, sólo posteriormente, comprimen la médula. La causa más frecuente de compresión medular –sobre todo en las personas mayores de 45 años–, es, sin duda, la degeneración espondiloartrósica cervical, que combina las lesiones degenerativas discales, la espondilosis, la osteofitosis y las calcificaciones e hipertrofias ligamentosas. Generalmente, cursa con cervicalgia sorda o cervicobraquialgia de larga evolución y una combinación de síntomas radiculares cervicales y medulares, como alteración de la marcha por paraparesia de evolución progresiva con fases de esta(1780) LA MED compresion 10 20/4/04 LA MEDICINA HOY 12:37 Página 3 Compresión medular A. Martínez Yelamos y M. Huerta Villanueva bilización, urgencia miccional y disfunción eréctil en los varones. El diagnóstico se basa en la historia, la exploración neurológica y la resonancia magnética (RM) cervical. La exploración muestra frecuentemente la ausencia o la depresión de algún reflejo en las extremidades superiores, con atrofias y fasciculaciones de los músculos dependientes de las raíces más afectadas con un síndrome piramidal bajo esa localización, una paraparesia espástica con hiperreflexia y, frecuentemente, un signo de Babinski. Las alteraciones sensitivas medulares, como en toda compresión crónica, no son prominentes, aunque sí puede haber alteraciones sensitivas en las extremidades superiores de distribución radicular. La musculatura intrínseca de las manos suele ser la más débil y atrófica, a pesar de que la compresión medular se halle en zonas superiores, lo que se ha atribuido a mecanismos isquémicos compresivos vasculares. La RM confirmará la compresión de la médula con imágenes de hiperseñal por edema o gliosis. Con frecuencia, contribuyen al cuadro los factores compresivos congénitos (estrechez congénita del canal raquídeo). Las hernias discales pueden ser causa de mielopatía, en relación con un movimiento brusco o un traumatismo, en ocasiones de inicio agudo, generalmente cervicales, lo que induce una mayor afección medular motora y esfinteriana. Si la hernia es lateral puede predominar la clínica radicular. Las alteraciones de la unión craneocervical, como la subluxación atloaxoidea, son causa de una posible mielopatía grave. En la tabla I se describen otras alteraciones óseas y de la unión craneovertebral que pueden ser causa de compresión medular. La compresión puede ser únicamente dinámica y afectar la circulación medular cervical, como en la enfermedad de Hirayama18. En los pacientes jóvenes la causa más frecuente de compresión medular es la traumática, que se manifiesta como paraplejía o tetraplejía completas con shock medular. La compresión medular traumática se puede producir por luxaciones o fracturas del raquis o de forma momentánea, durante el impacto, en relación con los movimientos de flexión o extensión forzadas. Entre las neoplasias extradurales causantes de compresión medular predominan las metastásicas8,9, con cursos de evolución más rápida que las tumoraciones intrarraquídeas, de crecimiento lento y un curso más progresivo y crónico. En los países desarrollados las metástasis vertebrales/epidurales son, después de las traumáticas, la causa más frecuente de compresión medular de rápida evolución8. Fundamentalmente, se trata de neoplasias con metástasis óseas; las más frecuentes son las de pulmón en el varón, las de mama en la mujer y, con menor frecuencia, el linfoma, las neoplasias de próstata y las de estómago8,9. Las neoplasias alcanzan el espacio epidural a través de la extensión directa desde el espacio paravertebral por los agujeros de conjunción (p. ej., el cáncer de pulmón) o por difusión hematógena. Entre las neoplasias primarias extradurales destacan, por su frecuencia, los mielomas múltiples; los cordomas y las neoplasias óseas son menos frecuentes9. Las tumoraciones benignas extradurales no suelen ser una causa habitual de compresión medular. Entre las etiologías infecciosas destacan las espondilodiscitis (fundamentalmente por Staphylococcus aureus, tuberculosis [enfermedad de Pott] y Brucella) y los abscesos epidurales en que predomina también S. aureus11-14. La tuberculosis y la brucelosis pueden producir lesiones radiculomedulares primarias. La clínica de las espondilodiscitis se desarrolla de una forma más lenta que la de los abscesos epidurales. Éstos son poco frecuentes, pero representan una causa grave y potencialmente curable de compresión medular. Su diagnóstico debe sospecharse ante pacientes con un dolor localizado en el raquis y fiebre, con factores de riesgo para el absceso epidural (diabetes, frecuentes venopunciones, traumatismos, cirugía espinal y, raramente, punción lumbar o catéter (1781) TABLA I Etiologías de compresión medular Extradurales Neoplasias primarias4-7 Neoplasias metastásicas8,9 Tumoraciones benignas2,10 Infecciones11-14 Trastornos mecánicos1-3,15-18 Enfermedades vasculares2 Otros19,20 Intradurales extramedulares21-24 Tumoraciones Malformaciones vasculares Infecciones Inflamaciones Intradurales intramedulares8,9,25,26 Tumoraciones Trastornos del desarrollo Infecciones Parasitosis Enfermedades vasculares Traumatismos Mieloma múltiple Cordoma, condrosarcoma, sarcoma osteogénico y de Ewing Pulmón, mama, linfomas Genitourinarios, intestinales, sarcomas… Tumores de células gigantes, quiste óseo aneurismático, osteoma osteoide, hemangioma, osteocondroma, displasia fibrosa, granuloma eosinófilo... Abscesos epidurales, espondilodiscitis S. aureus Enfermedad de Pott/tuberculosis, Brucella BGN, estreptococos, anaerobios, Aspergillus, otros hongos Degeneración espondiloartrósica Hernias discales Estenosis de canal, cifoscoliosis, enfermedad de Paget, acondroplasia, osificación de los ligamentos espinales, anomalías de la unión craneovertebral Subluxación atloidoaxoidea: AR, traumática, EA Malformación de Arnold-Chiari Anomalías altlas/foramen magnum Platibasia, impresión basilar Traumatismos Enfermedad de Hirayama Hematomas epidurales Lipomatosis espinal, angiomas cavernosos, depósitos amiloides Meningiomas, neurinomas Tumores epidermoides, lipomas, quistes aracnoideos Fístula dural Absceso subdural espinal Aracnoiditis crónica adhesiva Paquimeningitis hipertrófica espinal Sarcoidosis Ependimomas, astrocitomas Hemangioblastoma, metástasis, oligodendroglioma Siringomielia Absceso intramedular Neurocisticercosis, hidatidosis, esquistosomiasis, toxoplasma Hematomielia espinal), sin esperar a la aparición de radiculopatía o déficit neurológicos. La velocidad de sedimentación globular (VSG) suele estar muy elevada y su diagnóstico precisa una RM espinal rápida. Con mucha frecuencia, estos pacientes no son diagnosticados apropiadamente en las consultas o servicios de urgencias, y son dados de alta de forma precoz. La mayoría de ellos precisa un drenaje quirúrgico y todos un tratamiento con antibióticos por vía intravenosa. Los hematomas epidurales o hemorraquis son raros y, en general, de origen traumático; causan una clínica de compresión medular aguda. Raramente se producen de forma no traumática en relación con malformaciones vasculares, o en pacientes anticoagulados o con coagulopatías, en ocasiones tras punciones lumbares traumáticas27. Lesiones intradurales extramedulares En la zona intradural extramedular destacan, fundamentalmente, las tumoraciones, los meningiomas y los neurinomas21. En estos casos la clínica de compresión medular suele ser de instauración lenta y, habitualmente, se inicia como síndrome de hemisección medular incompleta progresiva. Otros tumores son menos frecuentes. JANO 30 ABRIL-6 MAYO 2004. VOL. LXVI N.º 1.519 55 LA MED compresion 10 20/4/04 LA MEDICINA HOY 12:37 Página 4 Compresión medular A. Martínez Yelamos y M. Huerta Villanueva Las fístulas durales pueden ser causa de un cuadro medular progresivo subagudo o crónico, con períodos de estabilización; éstas se pueden detectar en la RM medular como dilataciones venosas intradurales extramedulares con signo de vacío por flujo. Inducen un edema medular por estasis venosa y, secundariamente, clínica por isquemia. Por tanto, estas anomalías vasculares no son causa propiamente de compresión medular. Otras causas raras de compresión medular son las inflamatorias, como la aracnoiditis crónica o la sarcoidosis. Lesiones intramedulares Las etiologías intramedulares de compresión inducen con frecuencia un síndrome centromedular. El arquetipo de esta clínica es la siringomielia, generalmente cervical, que suele inducir una alteración de la sensibilidad termoalgésica suspendida en los brazos y la parte superior del tronco, la abolición de reflejos en los brazos, la amiotrofia en las manos, las alteraciones vegetativas y los signos piramidales en las extremidades inferiores. Los principales tumores intramedulares intrínsecos, que son el astrocitoma, el ependimoma y, con menos frecuencia, el hemangioblastoma, inducirán una clínica progresiva, habitualmente centromedular, que progresa hacia una afección medular global. Otras causas raras de compresión medular en nuestro medio, aunque no en otras latitudes, son las parasitarias: cisticercosis, hidatidosis y esquistosomiasis. Los hematomas intramedulares (hematomielia) casi siempre se dan en relación con malformaciones vasculares o tumores sangrantes. Diagnóstico diferencial En primer lugar, se deberá diferenciar si un cuadro de paraparesia o tetraparesia es de origen medular o debido a otras causas. Los cuadros agudos se deben diferenciar de las oclusiones de las arterias cerebrales anteriores bilaterales y de las polirradiculoneuropatías inflamatorias agudas (síndrome de Guillain-Barré). La existencia de un nivel sensitivo suele orientar el cuadro medular agudo. El síndrome de Guillain-Barré no suele mostrar una alteración de esfínteres, pero su arreflexia característica también se observa en ocasiones en las lesiones medulares agudas (shock medular). Los cuadros de paraparesia de lenta instauración con trastorno de la marcha se deben diferenciar de las lesiones frontales bilaterales y parasagitales (como los meningiomas de la hoz cerebral), las apraxias de la marcha por lesiones vasculares cerebrales o la hidrocefalia normotensiva. Todas estas entidades, como las mielopatías, suelen cursar con una afección de esfínteres. La neuroimagen cerebral permite descartarlas. Por último, las paraparesias histriónicas y ficticias pueden ser agudas o crónicas. La clínica de la afección medular será común para la mayoría de las enfermedades relacionadas con esta patología. Por ello, tan sólo en función de la clínica será difícil, en la mayoría de las ocasiones, establecer que el cuadro clínico es secundario a una compresión medular. Los procesos de larga evolución son sugestivos de compresión medular, ya sea por una mielopatía espondiloartrósica o por un tumor de crecimiento lento, pero se debe realizar el diagnóstico diferencial principalmente con otras etiologías, como la paraparesia espástica hereditaria o la asociada al virus HTLV-I –cuadros que generalmente se restringen a una afección de la vía piramidal con una debilidad espástica progresiva– y con la esclerosis múltiple, que se puede presentar en su forma primaria o secundaria progresiva como un cuadro de afección medular progresiva y repercutir, aparte de la vía piramidal, sobre cualquiera de los otros tractos ascendentes o descendentes. La presencia de antecedentes familiares (paraparesia espástica familiar) y síndromes neurológicos focales previos (p. ej., esclerosis múltiple secundaria progresiva) ayudarán, en algunos casos, en la orientación diagnóstica. La 56 JANO 30 ABRIL-6 MAYO 2004. VOL. LXVI N.º 1.519 neuroimagen por RM y el estudio del líquido cefalorraquídeo (LCR) acabarán de confirmar o descartar estos cuadros. En los casos en que la presentación clínica es subaguda o crónica y se acompaña de atrofia y fasciculaciones de predominio en los músculos distales de extremidades superiores (como la siringomielia, algunos casos de mielopatía espondiloartrósica cervical o en la enfermedad de Hirayama), se ha de realizar el diagnóstico diferencial con las enfermedades de la neurona motora (esclerosis lateral amiotrófica). La afección esfinteriana o la presencia de otra clínica, aparte de la motora, no se asocian con esta entidad, mientras que la presencia de una exaltación del reflejo maseterino, las fasciculaciones en el territorio facial y/o la lengua son signos que pueden estar ralacionados con ella. Los cuadros compresivos de inicio agudo (hematoma epidural espinal, algunos procesos tumorales y/o metastásicos y los traumatismos) deben ser diferenciados de otras patologías medulares, como las inflamatorias (mielitis, brote de esclerosis múltiple) y vasculares (infarto de arteria espinal anterior). Principalmente, los antecedentes clínicos en caso de traumatismo o brotes previos de esclerosis múltiple, la neuroimagen (que debe de ser realizada de forma urgente en los procesos de menos de 24 h de evolución con afección esfinteriana y paraparesia) y el estudio del LCR ayudarán a diferenciar las distintas etiologías. DIAGNÓSTICO El diagnóstico sindrómico de mielopatía se basa en la anamnesis y la exploración física. La existencia ocasional de un grado de afección neurológica permite, además, la localización topográfica de la lesión. El diagnóstico etiológico de la causa de la mielopatía y la confirmación de la compresión medular requieren la práctica de exploraciones complementarias. La técnica exploratoria de elección es la RM. La radiología simple de la columna permite evaluar solamente las lesiones que inducen una afección ósea; sólo se aprecian alteraciones si la destrucción ósea supera el 50%, por lo que abundan los falsos negativos8. Las masas paraespinales que invaden los agujeros neurales no suelen inducir cambios radiológicos. Las tumoraciones benignas intradurales extramedulares (meningiomas y neurinomas) pueden erosionar el pedículo y ensanchar los agujeros de conjunción28. La radiología simple puede mostrar una mayor positividad en el mieloma múltiple y las metástasis de próstata y mama. En pacientes con un cáncer determinado que presentan un dolor espinal localizado o radiculopatía, y en los que la radiología simple detecta un colapso del cuerpo vertebral o una erosión del pedículo en esa zona presentan una afección epidural en el 75% de los casos29. La tomografía computarizada (TC) con contraste tiene una alta sensibilidad diagnóstica en los procesos vertebrales, paravertebrales y del agujero raquídeo. La gammagrafía ósea es una exploración inespecífica y no detecta si existe una afección del canal raquídeo. La mielografía y, posteriormente, la mielografía-TC eran las exploraciones de elección para el diagnóstico de compresión medular anteriores a la disponibilidad de la RM. La mielografía conlleva un pequeño riesgo de exacerbar un déficit neurológico por cambios de presión en el caso de un bloqueo subaracnoideo, y está contraindicada en el caso de masas cerebrales, trombocitopenia o coagulopatía8. La RM es la exploración de elección, en general, ante la sospecha de mielopatía, permite la evaluación no sólo del hueso sino también del contenido del canal espinal y en concreto de la médula. Ofrece un mayor detalle anatómico, no es invasiva y no está limitada por la existencia bloqueo espinal. En resumen, ante la sospecha de compresión medular es inexcusable la práctica de una RM sobre la zona de la compresión o, en los pacientes con cáncer, (1782) LA MED compresion 10 20/4/04 LA MEDICINA HOY 12:37 Página 5 Compresión medular A. Martínez Yelamos y M. Huerta Villanueva la RM medular completa, o por lo menos torácica y lumbar, además de la región sintomática, dada la alta incidencia de depósitos metastásicos secundarios que podrían pasar desapercibidos30. El uso de gadolinio puede ser útil, ya que las lesiones neoplásicas e inflamatorias suelen mostrar captación. Ante la sospecha de compresión medular el examen del LCR no suele estar indicado. En cualquier caso puede haber un aumento de proteínas en él, principalmente si la afección es de cola de caballo. Si la compresión bloquea la circulación del líquido, se produce un grave aumento de las proteínas (1.000 mg/dl o más) con coloración amarillenta y tendencia a coagular con facilidad por la presencia de fibrinógeno. Esta combinación de alteraciones se denomina síndrome de Froin2. Al registrar la presión de salida del LCR se debe realizar el test de Queckenstedt, que consiste en la compresión de la vena yugular de un lado, después la del otro y, finalmente, de ambas. En condiciones normales debe producirse un rápido aumento de la presión de 100-200 mmH2O, que cede en unos 10 s tras parar. La falta de este aumento puede ser un signo de bloqueo subaracnoideo2. En el caso de lesiones infecciosas, como abscesos epidurales o intramedulares, puede producirse un discreto aumento de células, polimorfonucleares y linfocitos, y de proteínas (100-400 mg/dl) con glucosa generalmente normal. En caso de dudas sobre la afección medular, los potenciales evocados somatosensoriales y potenciales evocados motores pueden ser de utilidad. TRATAMIENTO El tratamiento será diferente, evidentemente, en función de la etiología de la compresión medular. En general, se precisarán medidas de soporte que, en los casos de mielopatía aguda, incluyen la monitorización, por la posible inestabilidad hemodinámica secundaria a la disfunción autónoma, el tratamiento del estreñimiento inducido por la mielopatía para evitar las maniobras de Valsalva que empeoren el cuadro, el sondaje vesical si es preciso, el tratamiento del dolor con antiinflamatorios no esteroideos o, si fuese necesario, opiáceos. El uso de corsés o fajas se limitará a los casos con verdadera inestabilidad espinal8. Los corticoides se utilizan en compresiones medulares agudas traumáticas en las primeras 24-48 h como una opción terapéutica, con bolos de metilprednisolona, aunque parece que las evidencias de efectos adversos son más consistentes que las de los beneficios clínicos31. En las compresiones medulares por neoplasia epidural se suele utilizar dexametasona a dosis de 16-96 mg al día inicialmente, con una reducción posterior tan rápida como sea posible y la tolere el paciente8. En el caso de los abscesos o empiemas epidurales, el tratamiento será antibiótico (a la espera de los resultados de los cultivos para S. aureus) o la combinación, realizada con frecuencia, de tratamiento antibiótico y quirúrgico, que requiere un desbridamiento y una descompresión medular11,13,32. El tratamiento de los procesos neoplásicos será quirúrgico en la mayoría de las ocasiones, excepto en los metastásicos con un tumor primario conocido, en que se suele preferir un tratamiento radioterápico. La radioterapia suele disminuir el dolor y frenar la progresión del déficit neurológico. Su eficacia depende del grado de limitación funcional al inicio, del tipo de tumor y el grado de extensión subaracnoideo. En casos de afección medular compresiva con paraplejía o afección de esfínteres de menos de 24 h de evolución se considera que el tratamiento debe ser urgente (descompresión quirúrgica o tratamiento con radioterapia, si se conoce el tumor primario). (1783) Las alteraciones esqueléticas (óseas y discales) generalmente también serán subsidiarias de tratamiento quirúrgico descompresivo si hay una afección medular. Bibliografía 1. Woolsey RM, Young RR. The clinical diagnosis of disorders of the spinal cord. Disorders of the spinal cord. Neurologic Clin 1991;9:573-83. 2. Victor M, Ropper AH. Enfermedades de la médula espinal. En: Adams, Victor. Principios de neurología. 7.ª ed. McGraw-Hill, 2002; p. 1211-60. 3. Zarranz JJ, Rouco I. Enfermedades de la médula espinal. En: Zarranz JJ, editor. Neurología. 3.ª ed. Barcelona: Mosby/Doyma, 2003; p. 559-92. 4. Benson WF, Scarffe JH, Todd ID, Palmet M, Crowther D. Spinal-cord compression in myeloma. BMJ 1979;1:1541-4. 5. Gelabert-González M, Reyes-Santias RM, García-Pravos A. Dorsal medullary compression due to a primary vertebral chondrosarcoma. Rev Neurol 2000; 30:322-4. 6. Merimsky O, Lepechoux C, Terrier P, Vanel D, Delord JP, LeCesne. Primary sarcomas of the central nervous system. Oncology 2000;58:210-4. 7. Goktepe AS, Alaca R, Mohur H, Coskun U. Paraplegia: an unusual presentation of Ewing’s sarcoma. Spinal Cord 2002;40:367-9. 8. Schiff D. Spinal cord compression. Neurol Clin 2003;21:67-86. 9. Schick U, Marquardt G, Lorenz R. Intradural and extradural spinal metastases. Neurosurg Rev 2001;24:1-5. 10. Khosla A, Martin DS, Awwad EE. The solitary intraspinal vertebral osteochondroma. An unusual cause of compressive myelopathy: features and literature review. Spine 1999;24:77-81. 11. Tang HJ, Lin HJ, Liu YC, Li CM. Spinal epidural abscess- experience with 46 patients and evaluation of prognostic factors. J Infect 2002;45:76-81. 12. Turgut M. Spinal tuberculosis (Pott’s disease): its clinical presentation, surgical management and outcome. A survey study on 694 patients. Neurosurg Rev 2001;24:8-13. 13. Nussbaum ES, Rigamonti D, Standiford H, Numaguchi Y, Wolf AL, Robinson WL. Spinal epidural abscess: a report of 40 cases and review. 14. Rubio García E. Tumores y colecciones purulentas del sistema nervioso. En: Codina Puiggros A, editor. Tratado de neurología. ELA, 1994: p. 573-617. 15. May D, Janny B, Faundez A. Cervical cord compression due to a hypoplastic atlas. Case report. J Neurosurg 2001;94(Suppl 1):133-6. 16. Saifuddin A, Hassan A. Paget’s disease of the spine: unusual features and complications. Clin Radiol 2003;58:102-11. 17. Wiseman DB, Stokes JK, Toselli RM. Paraparesis in a black man brought on by ossification of the ligamentum flavum: case report and review of the literature. J Spinal Disord Tech 2002;15:542-5. 18. Hirayama K. Juvenil muscular atrophy of distal upper extremity (Hirayama disease): focal cervical ischemic poliomyelopathy. Neuropathology 2000;20:91S-4S. 19. Dumont-Fischer D, Rat AC, Saidenberg-Kermanach N, Laurent S, Cohen R, Boissier MC. Spinal epidural lipomatosis revealing endogenous Cushing’s syndrome. Joint Bone Spine 2002;69:222-5. 20. Goyal A, Singh AK, Gupta V, Tatke M. Spinal epidural cavenous hemangioma: a case report and review of the literature. Spinal Cord 2002;40:200-2. 21. Albanese V, Platania N. Spinal intradural extramedullary tumors. Personal experience. J Neurosurg Sci 2002;46:18-24. 22. Kumar K, Malik S, Schulte PA. Symptomatic spinar arachnoid cysts: report of two cases with review of the literature. Spine 2003;28:25E-9E. 23. Hamasaki T, Noda M, Kamei N, Yamamoto S, Ochi M, Yasunaga Y. Intradural extramedullary mass formation in spinal cord sarcoidosis: case report and literature review. Spine 2003;28:420E-3E. 24. Kanamori M, Matsui H, Terahata N, Tsuji H. Hypertrophic spinal pachymeningitis. A case report. Spine 1997;22:1787-90. 25. Koeller KK, Rosenblum RS, Morrison AL. Neoplasm of the spinal cord and filum terminale: radiologic pathologic correlation. Radiographics 2000;20: 1721-49. 26. Pamir MN, Ozduman K, Elmaci I. Spinal hydatid disease. Spinal cord 2002; 40:153-60. 27. Evans RW. Complications of lumbar puncture. Iatrogenic disorders. Neurologic Clin 1998;16:83-105. 28. Osborn AG. Quistes, tumores y lesiones pseudotumorales de la columna vertebral y la médula espinal. En: Neurorradiología diagnóstica. Barcelona: Mosby/Doyma Libros S.A., 1996; p. 876-918. 29. Graus F, Krol G, Foley KM. Early diagnosis of spinal epidural metastasis (SEM): correlation with clinical and radiological findings. Proc Am Soc Clin Oncol 1985;4:269. 30. Posner JB. Neurologic complications of cancer. Philadelfia: FA Davis Company, 1995. 31. Guidelines Committee. Section on Disorders of the Spine and Peripheral Nerves of the American Asociation of Neurological Surgeons of the Congress of Neurological Surgeons. Pharmacological therapy after acute cervical spinal cord injury. Neurosurgery 2002;50(Suppl 3):63-72. 32. Pilkington SA, Jackson SA, Gillet GR. Spinal epidural empiema. Br J Neurosurg 2003;17:196-200. JANO 30 ABRIL-6 MAYO 2004. VOL. LXVI N.º 1.519 57