UNIDADES TEMÁTICAS - Facultad de Química UNAM
Anuncio

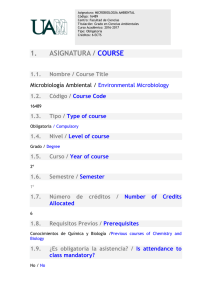
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA PROGRAMAS DE ESTUDIO QUINTO SEMESTRE Asignatura MICROBIOLOGÍA EXPERIMENTAL OBLIGATORIA Ciclo FUNDAMENTAL DE LA PROFESIÓN Clave: 1515 Tipo de asignatura: Modalidad de la asignatura: TEORÍA 0 Área BIOLOGÍA HORAS/SEMANA PRÁCTICA 6 h Departamento BIOLOGÍA CRÉDITOS 6 PRÁCTICA LABORATORIO ASIGNATURA PRECEDENTE: Seriación obligatoria con Microbiología General. ASIGNATURA SUBSECUENTE: Seriación obligatoria con Microbiología de Alimentos. OBJETIVO(S): Aplicar correctamente las normas de higiene y bioseguridad en el laboratorio de microbiología. Desarrollar correctamente las técnicas básicas para el estudio de los microorganismos. Discriminar las condiciones nutricionales y de cultivo para los diferentes grupos microbianos. Evaluar el efecto de los agentes físicos y químicos en el crecimiento microbiano. Caracterizar a las eubacterias en función de su capacidad metabólica. Aplicar diferentes métodos de cuantificación de microorganismos en diversos productos. UNIDADES TEMÁTICAS NÚMERO DE HORAS POR UNIDAD 3P 3h UNIDAD 1. INTRODUCCIÓN A LA MICROBIOLOGÍA Y BIOSEGURIDAD 1.1 El laboratorio de Microbiología. Descripción, características, importancia y aplicaciones. 1.2 Consideraciones de seguridad individual y grupal. 1.3 Revisión de material y equipo básico utilizado en Microbiología. 18P 18h 2. TÉCNICAS BÁSICAS DE MICROBIOLOGÍA 2.1 Manejo y aplicaciones del microscopio de campo claro en Microbiología. 2.2 Observación de preparaciones frescas y fijas. Calibración del microscopio y medición de microorganismos. 2.3 Técnicas de asepsia, desinfección y esterilización. Manejo de horno y autoclave. 2.4 Preparación de medios de cultivo y material para esterilización. Indicadores de esterilidad (químicos y biológicos). Control de esterilidad en medios de cultivo. 2.5 Integración y análisis de resultados y conclusiones. 12P 12h 3. CULTIVO DE BACTERIAS Y TÉCNICAS DE SIEMBRA 3.1 Cultivo de bacterias. Inoculación de medios sólidos, líquidos y semisólidos. Conceptos de cepa, cepa pura, cultivo, cultivo mixto. Características morfológicas macroscópicas de las bacterias. 3.2 Tinciones: simples, diferenciales selectivas y negativa, Características microscópicas de las bacterias: morfología, agrupación y tamaño. 3.3 Comprobación de pureza de cultivos: macroscópica y microscópica. 3.4 Integración, análisis de resultados y conclusiones. 6P 6h 4. ESTUDIO MICROSCÓPICO Y CULTIVO DE HONGOS 4.1 Cultivo de hongos. Técnicas de siembra en medios selectivos. Observación macroscópica y microscópica del crecimiento. 4.2 Preparaciones a partir de cultivos axénicos para la observación microscópica de hongos filamentosos y levaduriformes. 4.3 Integración, análisis de resultados y conclusiones. 6P 6h 5. ESTUDIO MICROSCÓPICO DE ALGAS Y PROTOZOARIOS 5.1 Preparaciones en fresco a partir de muestras ambientales para la observación de algas y protozoarios. 5.2 Descripción de características morfológicas de cada grupo. 5.3 Integración, análisis de resultados y conclusiones. 12P 12h 6. TÉCNICAS DE AISLAMIENTO DE MICROORGANISMOS 6.1 Empleo de estrategias para el aislamiento de microorganismos y obtención de cultivos axénicos: • Diluciones y agotamiento. • Medios selectivos y diferenciales. • Condiciones fisicoquímicas para el desarrollo selectivo de microorganismos. 6.2 Comprobación de pureza mediante características morfocoloniales y microscópicas. 6.3 Conservación de cultivos axénicos. 6.4 Integración, análisis de resultados y conclusiones. 15P 15h 7. NUTRICIÓN MICROBIANA Y CARACTERIZACIÓN DE BACTERIAS 7.1 Siembra de microorganismos en diferentes medios de cultivo, variando las fuentes de carbono, nitrógeno y factores de crecimiento. 7.2 Determinación de los requerimientos nutricionales en cultivos microbianos. 7.3 Uso de las pruebas bioquímicas y técnicas rápidas para la caracterización fisiológica de bacterias. 7.4 Integración, análisis de resultados y conclusiones. 12P 12h 8. TÉCNICAS PARA LA ENUMERACIÓN DE MICROORGANISMOS: ANÁLISIS MICROBIOLÓGICO DEL AGUA Y DE OTRAS DIVERSAS MUESTRAS 8.1 Aplicación de técnicas para el conteo de microorganismos totales y viables en una muestra conocida (recuento microscópico, turbidimetría, cuenta en placa y filtración). 8.2 Análisis microbiológico de una muestra problema. 8.3 Integración, análisis de resultados y conclusiones. 12P 12h 9. CONDICIONES AMBIENTALES PARA EL DESARROLLO, INHIBICIÓN Y DESTRUCCIÓN DE LOS MICROORGANISMOS. 9.1 Determinación del efecto de pH, temperatura, y concentración de solutos. 9.2 Determinación del efecto letal y mutagénico de las radiaciones UV. 9.3 Efecto biocida y biostático de diferentes agentes químicos en el crecimiento microbiano. 9.4 Integración, análisis de resultados y conclusiones. SUMA: 96P=96h BIBLIOGRAFÍA BÁSICA 1. Cappuccino, J. & Sherman, N., Microbiology: A laboratory manual, California. Benjamin Cummings, 2010. 2. Gamazo, C., López_Goñi, I., & Díaz, R., Manual práctico de Microbiología, España, Masson, 2005. 3. Madigan M.T, Martinko J.M., Dunlap P.V. and Clark D.P., Brock Biología de los microorganismos, 12a edición, UK, Pearson Education, 2009. 4. Madigan M.T, Martinko J.M., Stahl D and Clark D.P., Brock Biology of microorganisms, 13th edition, UK, Pearson Benjamin Cummings, 2010. 5. Prescott L.M., Harley J.P. and Klein G.A., Microbiología, 3a edición, Madrid, México, Mc GrawHill-Interamericana, 2009. 6. Ramírez-Gama, R. M., Luna, M. B., Velásquez, M. O., Vierna, L., Mejía C. A., Tsuzuki, R. G., Hernández G. L., Müggenburg, I., Camacho Cruz, A. y Urzúa H. M. del C., Manual de Prácticas de Microbiología General, México, UNAM, Facultad de Química, 2011. 7. Tortora G.J., Funke B.R. and Case C.L., Microbiology: An Introduction with Mastering Microbiology, 11th edition, UK, Pearson Benjamin Cummings, 2012. BIBLIOGRAFÍA COMPLEMENTARIA 1. Aladro Lubel, M. A., Principales clasificaciones de los protozoos, México, UNAM, Facultad de Ciencias, 2006. 2. Andersen R. A., Algal culturing techniques, USA, Elsevier Academic Press, 2005. 3. Bonifaz A., Micología Médica Básica, 3a edición, México, D.F., McGraw-Hill Interamericana, 2010. 4. Martínez-Pérez, J. A., Elías-Gutiérrez, M. & Varona, D. E., Protozoología. Aspectos morfofuncionales, Tlalneplantla, UNAM-Facultad de Estudios Superiores Iztacala, 2003. 5. Mc Faddin J.F., Pruebas bioquímicas para la identificación de bacterias de importancia clínica, 3a edición, México, Editorial Médica Panamericana, 2003. 6. Reglamento de higiene y seguridad para los laboratorios de la Facultad de Química de la UNAM, Número especial. Gaceta de la Facultad de Química, UNAM, 2006. 7. Reglamento interno de higiene y seguridad para los laboratorios del Departamento de Biología, Gaceta de la Facultad de Química, UNAM, 2006. 8. Winn, W. C. Allen, S. A., Janda, W. M., Koneman, E. D., Procop, G. W., Scheckenberg, P. C. & Woods, G. M., Koneman´s Color Atlas and Textbook of Diagnostic Microbiology, 6a edición, USA, Lippincott Williams & Wilkins, 2006. 9. Winn, W. C. Allen, S. A., Janda, W. M., Koneman, E. D., Procop, G. W., Scheckenberg, P. C. & Woods, G. M., Koneman Diagnóstico Microbiológico, Texto y atlas en color, 6a edición, Argentina, Editorial Médica Panamericana, S.A., 2008. SUGERENCIAS DIDÁCTICAS Exposición oral por parte del profesor, interrogatorio y participación espontánea. Atención personalizada durante el desarrollo práctico. Análisis y discusión de resultados, y conclusiones de manera colectiva. FORMA DE EVALUAR La calificación final se establece por la aplicación de exámenes cortos y/o parciales, examen departamental, asistencia, trabajo práctico, bitácora y/o informes. PERFIL PROFESIOGRÁFICO DE QUIENES PUEDEN IMPARTIR LA ASIGNATURA Se recomienda que el curso sea impartido por profesionistas con experiencia en el trabajo de laboratorio de control microbiológico, investigación, producción o diagnóstico.