Furosemida suspensión oral
Anuncio

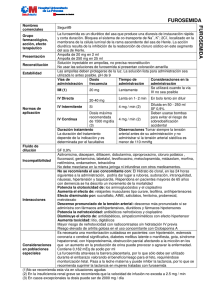
Procedimiento Normalizado de Fórmula no Tipificada abril 2012 Edición 01 Furosemida suspensión oral Modificaciones respecto a la edición anterior: PNT 00 Página 1 de 4 Aprobado por UNIDAD DE FORMULACIÓN MAGISTRAL 1. NOMBRE Y/O COMPOSICIÓN CUALITATIVA Furosemida suspensión oral SINÓNIMOS: Furosemida = furosemide = frusemida = fursemida = furosemidum 2. FORMA FARMACÉUTICA Suspensión. 3. COMPONENTES Furosemida RFE Mon. Nº 0391 Metilcelulosa RFE Mon Nº 0345 Agua purificada RFE Mon. Nº 0008 4. MÉTODO DE ELABORACIÓN PN de elaboración de geles PN/L/FF/003/00 1. Se pesa el principio activo siguiendo el procedimiento de pesada (PN/L/OF/001/00). 2. Se hierve el agua purificada, al menos, durante tres minutos y posteriormente se deja enfriar. 3. A continuación se dispersa la metilcelulosa (1% - 1,5%) sobre la solución anterior y se deja en reposo durante 24 horas. 4. Transcurridas las 24 horas se agita suavemente hasta la formación del gel. 5. En el mortero, ponemos la furosemida, y añadimos, poco a poco, el gel en cantidad suficiente, trabajándolo hasta conseguir una mezcla homogénea. 5. REFERENCIA BIBLIOGRÁFICA Atienza M, Vila M. N. Formulación Magistral en Pediatría. 1ª Ed. Grupo Español de Farmacia Pediátrica. Madrid. 2005. Procedimiento Normalizado de Fórmula no Tipificada Furosemida suspensión oral PNT 00 abril 2012 Edición 01 Página 2 de 4 Callabed J. Fórmulas Magistrales en Pediatría. 1ª Ed. Acofarma Distribución S.A. Barcelona. 2011. Castaño MT, Ruiz L, Vidal JL y otros. Monografías Farmacéuticas. Colegio Oficial de Farmacéuticos de Alicante. Alicante. 1998. Catálogo de Especialidades Farmacéuticas 2011. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid. 2011. Formulario Nacional. 1ª Ed. Revisado y actualizado. Ministerio de Sanidad y Consumo. Agencia Española de Medicamentos y Productos Sanitarios. Madrid. 2007. Hidalgo FJ, Bermejo T, García B y Juana P. Formulaciones de Medicamentos para Pacientes con Dificultades de Deglución. 1ª Ed.Janssen-Cilag, S.A. Madrid. 2005 Real Farmacopea Española. 4ª Ed. Ministerio de Sanidad y Consumo. Madrid. 2011 San Miguel MT, Vila MN, Nájera MD y Alonso JM. Manual de Formulaciones Pediátricas Orales (Recopilación bibliográfica). 1ª Ed. Rasgo Editorial. Barcelona. 1997. Sean C. Sweetman. Martindale. Guía Completa de Consulta Farmacoterapéutica. 35ª Ed. London: Pharmaceutical Press. 2007. 3ª Ed. en castellano. Pharma Editores S.L. Barcelona. 2008. 6. CONTROLES ANALÍTICOS Evaluación de los caracteres organolépticos. 7. MATERIAL DE ACONDICIONAMIENTO Envase de cristal topacio. 8. CONDICIONES DE CONSERVACIÓN Mantener el envase perfectamente cerrado, protegido de la luz y conservar en nevera. 9. CADUCIDAD En condiciones óptimas de conservación el plazo de validez es de 7 días. 10. INFORMACIÓN AL PACIENTE 10.1. Oficina de farmacia (Nombre, dirección y número de teléfono) 10.2. Composición cualitativa y cuantitativa completa, al menos, de los principios activos y de los excipientes de declaración obligatoria. Furosemida X% Procedimiento Normalizado de Fórmula no Tipificada Furosemida suspensión oral 10.3. Metilcelulosa 1% Agua csp Y ml PNT 00 abril 2012 Edición 01 Página 3 de 4 Forma farmacéutica, dosis unitaria y número de dosis. Suspensión. 10.4. Vía de administración. Vía oral. 10.5. Posología y frecuencia de administración. Según lo indicado en la receta. 10.6. Normas para la correcta administración. Agitar antes de usar. Administrar preferentemente en ayunas; los alimentos pueden modificar su absorción. 10.7. Condiciones de conservación, si procede. Mantener el envase bien cerrado, protegido de la luz y conservar en nevera. 10.8. Advertencia. Los medicamentos deben mantenerse fuera del alcance de los niños. No administrar en pacientes con sensibilidad conocida a las sulfamidas. En caso de que aparezca mareo, especialmente al levantarse de la cama o una silla, vértigos, sordera o pitidos en los oídos, sed intensa, somnolencia, calambres o debilidad muscular, se aconseja acudir al médico. 10.9. Precauciones de empleo. Se recomienda evitar la exposición directa a la luz del sol o a la ultravioleta sin protección adecuada (filtros solares, ropa). Se debe utilizar con precaución en pacientes con enfermedades hepáticas y diabetes. La furosemida puede dar lugar a hipotensión y somnolencia, especialmente al inicio del tratamiento o al modificar la dosificación. Podría afectar sustancialmente a la capacidad para conducir y/o manejar maquinaria. Los pacientes deberán evitar manejar maquinaria peligrosa, incluyendo automóviles, hasta que tengan la certeza razonable de que el tratamiento farmacológico no les afecta de forma adversa. EMBARAZO: Categoría C de la FDA. En estudios realizados con animales de experimentación, se ha observado un aumento de la incidencia de hidronefrosis (en ratones y conejas), aborto espontáneo (en conejas a dosis 2-8 veces las terapéuticas en humanos) y mortalidad materna e infantil. En ensayos con ratas, administrándose dosis de 75 mg/kg/24 horas durante los Procedimiento Normalizado de Fórmula no Tipificada Furosemida suspensión oral PNT 00 abril 2012 Edición 01 Página 4 de 4 días 7 a 11 y 14 a 18 de la gestación, se han notificado casos de retraso de la maduración renal con reducción en el número de glomérulos diferenciados en la progenie. No se han realizado ensayos adecuados y bien controlados en humanos, por lo que el uso de la furosemida sólo se acepta en caso de ausencia de alternativas terapéuticas más seguras, y siempre y cuando los beneficios superen los posibles riesgos. Las únicas probables indicaciones para la furosemida durante el embarazo serían desórdenes cardiovasculares tales como edema pulmonar, hipertensión severa e insuficiencia cardiaca congestiva. La furosemida se ha usado para comprobar el funcionamiento renal fetal, aunque el uso rutinario de diuréticos durante el embarazo normal es inadecuado y puede conllevar riesgos innecesarios. Estos fármacos no evitan la aparición de toxemia gravídica y no son útiles en el tratamiento de la toxemia. No obstante la furosemida se ha utilizado después del primer trimestre para el tratamiento de edema, hipertensión y toxemia sin causar daño fetal o al recién nacido. Se debe tener en cuenta el posible aumento del riesgo de ductus arterioso en niños con síndrome de distrés respiratorio cuando se administra antes del alumbramiento. LACTANCIA: La furosemida se excreta con la leche materna. Se desconocen las posibles consecuencias para el lactante, pero ante el riesgo de reacciones adversas graves y debido a que los diuréticos pueden inhibir la lactancia materna, se recomienda evitar su utilización o suspender la lactancia materna. NIÑOS: Se aconseja extremar las precauciones y evitar la utilización de dosis superiores a las recomendadas (2mg/kg/24 horas p.o.; 1mg/kg/24 horas i.v.), debido a que podrían aparecer fenómenos de ototoxicidad en los neonatos. Por otra parte se debe tener en cuenta que en niños prematuros con distrés respiratorio, la utilización de furosemida durante las primeras semanas de vida se ha asociado con la persistencia del ductus arterioso. Además, la furosemida se ha asociado con la formación de cálculos renales en niños pequeños en los que se empleó para disminuir el edema asociado a ductus arterioso o a distrés respiratorio. Estos cálculos suelen desaparecer al tratar al niño con diuréticos tiazídicos. ANCIANOS: Los ancianos son especialmente susceptibles a las reacciones adversas de los diuréticos, especialmente a la predisposición al desequilibrio hidroelectrolítico y a la hipotensión. Se recomienda extremar las precauciones en estos pacientes y no emplearlos durante largos períodos de tiempo.