RESUMEN PONENCIA ÁFRICA HOLGUÍN La gran heterogeneidad
Anuncio

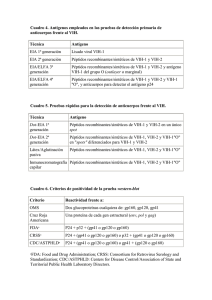
RESUMEN PONENCIA ÁFRICA HOLGUÍN La gran heterogeneidad genética del VIH es una de las causas de que existan tantas variantes de este virus, siendo el resultado de una elevada tasa de mutación, adiciones o deleciones de nucleótido y procesos de recombinación. Por ello, la clasificación genética del VIH es un primer paso necesario para identificar las cepas del VIH responsables de la infección en cada área geográfica, siendo los análisis filogenéticos de secuencias virales la técnica de referencia. Existen dos tipos de VIH identificados hasta la fecha: VIH-1 y VIH-2. El VIH-1 es el más extendido, y responsable de la mayor parte de casos de infección por VIH en el mundo. El VIH-2 se identificó en 1986 a partir de dos pacientes africanos con SIDA que no presentaban reactividad serológica frente a VIH-1. Atendiendo a su homología genética, el VIH-1 ha sido clasificado en tres grandes grupos: grupo M (main), grupo O (outlier) y grupo N (no-M, no-O). Los virus del grupo M han sido subdivididos en nueve subtipos hasta el momento (A-D, F-H, J, K). Incluso dentro ciertos subtipos se han distinguido subsubtipos. Los grupos O y N del VIH-1 presentan baja prevalencia, siendo encontrados mayoritariamente en África Subsahariana occidental. La distribución geográfica de los subtipos del grupo M del VIH-1 es muy heterogénea y, poco a poco, los límites geográficos entre subtipos van desapareciendo. Esto se debe a la gran movilidad de la población favorecida por diversos factores, como el turismo y la emigración, entre otros. Esto también provoca un aumento cada vez mayor de infecciones mixtas en países donde varios tipos de virus están presentes. De hecho, más de la mitad de los aislados del VIH-1 que han sido secuenciados en una región genómica lo suficientemente larga son recombinantes, es decir, llevan fragmentos genómicos de distintos subtipos de los viriones parentales. La recombinación en el VIH-1 sucede in vivo como consecuencia de la infección simultánea del individuo por dos variantes del virus (coinfección) o en distinto momento (superinfección o infección por VIH en un paciente previamente infectado). Dentro del VIH-1 grupo M, los recombinantes entre subtipos con puntos de recombinación comunes y reconocidos en más de tres individuos no relacionados epidemiológicamente se llaman CRF (formas recombinantes circulantes). Hasta el momento se han descrito 43 CRF, cada una designada por un número identificativo, y los subtipos genéticos que están presentes en su genoma. Los recombinantes entre subtipos URF (formas recombinantes únicas) se han encontrado en individuos aislados, no compartiendo los puntos de recombinación con las CRF conocidas. La generación y expansión de nuevas variantes recombinantes del VIH podría alterar el curso de la enfermedad, pudiendo influir en la patogenicidad, epidemiología y control del VIH, ya sea utilizando antirretrovirales o vacunas. 1 Los subtipos diferentes a los B (subtipos no-B) y recombinantes entre subtipos del VIH-1 tienen gran relevancia epidemiológica. Causan cerca del 90% de los 33 millones de infecciones a nivel mundial, siendo mayoritarios en África subsahariana. Sólo los subtipos C y A y las formas recombinantes CRF01_AE, CRF02_AG son responsables del 70% de ellas. Aunque los virus del subtipo B del VIH-1 sólo causan el 10% de infecciones, son los más estudiados desde el punto de vista genético, biológico y terapéutico. Ello se debe a que son prevalentes en países desarrollados donde la terapia antirretroviral está extendida, incluidos Europa Occidental (incluida España) y Norteamérica. Sin embargo, se estima que más del 10-15% de las nuevas infecciones por VIH-1 en Europa y el 5% en EE.UU. están causadas por subtipos no-B, llegando a porcentajes del cerca del 50% en algunos países europeos. En España ya se han detectado todos los subtipos genéticos del VIH-1 y un gran número de recombinantes, algunos muy complejos. Así la prevalencia de los subtipos no-B y recombinantes entre dos o más subtipos ha aumentado en España en los últimos años entre los nuevos diagnósticos, tanto en población nativa como en inmigrante, estando en torno al 10%. Sin embargo, infectan a más del 90% de los sujetos VIH-1+ procedentes de África subsahariana que residen en nuestro país. Entre el 2000 y 2007, tras analizar más de 1.430 nuevos diagnósticos en un hospital de Madrid, se observó un aumento de infecciones por subtipos no-B y recombinantes del VIH-1 en latinoamericanos (11%-20%) y nativos españoles (4%-10%), manteniéndose prevalencias muy altas en africanos subsaharianos infectados. La importancia del reconocimiento de subtipos no-B y recombinantes del VIH-1 puede tener implicaciones más allá del mero interés epidemiológico. Primero, se ha descrito una tasa diferente de progresión a SIDA en sujetos infectados con determinados subtipos no-B. Segundo, polimorfismos naturales en la proteasa y retrotranscriptasa virales, las dianas más habituales de los fármacos antirretrovirales, están presentes con frecuencia en posiciones asociadas a resistencia según un patrón específico de subtipos. Estas características cambiantes podrían influir en la susceptibilidad a drogas, así como a la selección de vías diferentes y/o más rápidas en el proceso de emergencia de resistencia a fármacos, con el consecuente posible fallo terapéutico a largo plazo. Tercero, las diferencias genéticas entre subtipos puede comprometer la fiabilidad de los tests de diagnóstico genético, las valoraciones de carga viral, la interpretación de los algoritmos de resistencia genotípica, y la identificación de subtipos empleando páginas web de subtipaje rápido, de uso extendido en la práctica clínica. Por último, la propagación constante de recombinantes entre subtipo podría tener serias implicaciones en los esfuerzos por controlar la pandemia de SIDA mediante procesos de vacunación. Por lo tanto, sigue siendo necesario apoyar los estudios de epidemiología molecular del VIH-1 como parte de programas de vigilancia nacional del VIH y SIDA. 2