protocolo de extracción de células de sangre periferica
Anuncio
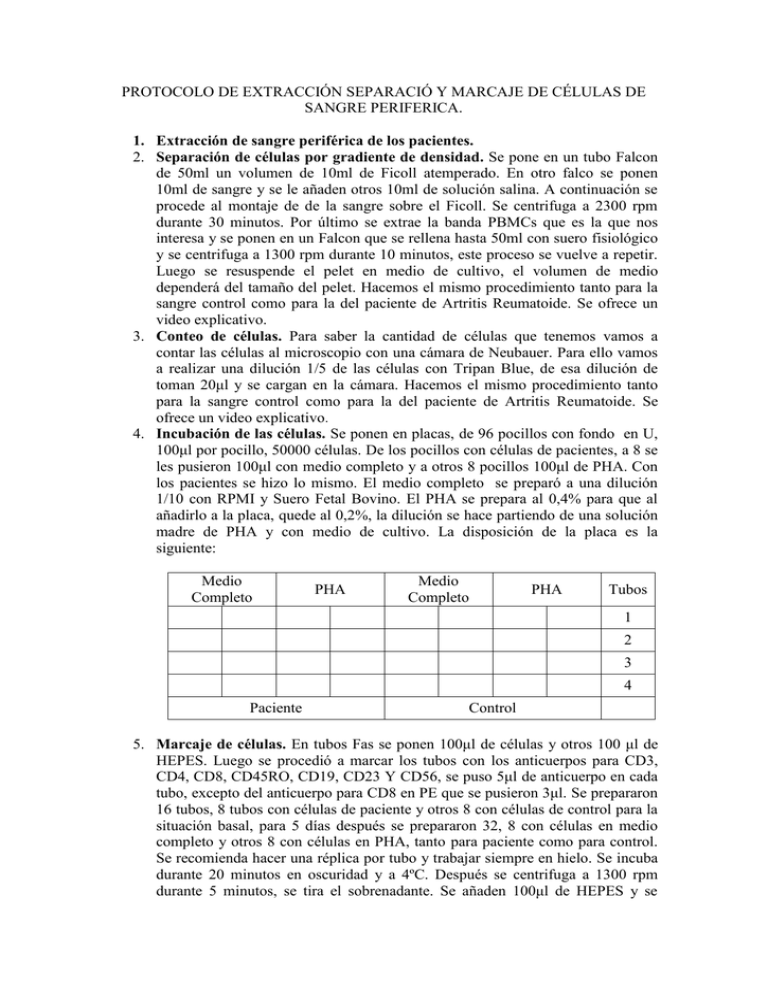
PROTOCOLO DE EXTRACCIÓN SEPARACIÓ Y MARCAJE DE CÉLULAS DE SANGRE PERIFERICA. 1. Extracción de sangre periférica de los pacientes. 2. Separación de células por gradiente de densidad. Se pone en un tubo Falcon de 50ml un volumen de 10ml de Ficoll atemperado. En otro falco se ponen 10ml de sangre y se le añaden otros 10ml de solución salina. A continuación se procede al montaje de de la sangre sobre el Ficoll. Se centrifuga a 2300 rpm durante 30 minutos. Por último se extrae la banda PBMCs que es la que nos interesa y se ponen en un Falcon que se rellena hasta 50ml con suero fisiológico y se centrifuga a 1300 rpm durante 10 minutos, este proceso se vuelve a repetir. Luego se resuspende el pelet en medio de cultivo, el volumen de medio dependerá del tamaño del pelet. Hacemos el mismo procedimiento tanto para la sangre control como para la del paciente de Artritis Reumatoide. Se ofrece un video explicativo. 3. Conteo de células. Para saber la cantidad de células que tenemos vamos a contar las células al microscopio con una cámara de Neubauer. Para ello vamos a realizar una dilución 1/5 de las células con Tripan Blue, de esa dilución de toman 20μl y se cargan en la cámara. Hacemos el mismo procedimiento tanto para la sangre control como para la del paciente de Artritis Reumatoide. Se ofrece un video explicativo. 4. Incubación de las células. Se ponen en placas, de 96 pocillos con fondo en U, 100μl por pocillo, 50000 células. De los pocillos con células de pacientes, a 8 se les pusieron 100μl con medio completo y a otros 8 pocillos 100μl de PHA. Con los pacientes se hizo lo mismo. El medio completo se preparó a una dilución 1/10 con RPMI y Suero Fetal Bovino. El PHA se prepara al 0,4% para que al añadirlo a la placa, quede al 0,2%, la dilución se hace partiendo de una solución madre de PHA y con medio de cultivo. La disposición de la placa es la siguiente: Medio Completo PHA Medio Completo PHA Tubos 1 2 3 4 Paciente Control 5. Marcaje de células. En tubos Fas se ponen 100μl de células y otros 100 μl de HEPES. Luego se procedió a marcar los tubos con los anticuerpos para CD3, CD4, CD8, CD45RO, CD19, CD23 Y CD56, se puso 5μl de anticuerpo en cada tubo, excepto del anticuerpo para CD8 en PE que se pusieron 3μl. Se prepararon 16 tubos, 8 tubos con células de paciente y otros 8 con células de control para la situación basal, para 5 días después se prepararon 32, 8 con células en medio completo y otros 8 con células en PHA, tanto para paciente como para control. Se recomienda hacer una réplica por tubo y trabajar siempre en hielo. Se incuba durante 20 minutos en oscuridad y a 4ºC. Después se centrifuga a 1300 rpm durante 5 minutos, se tira el sobrenadante. Se añaden 100μl de HEPES y se ponen 6μl de Anexina V, se incuba en la nevera y en oscuridad 15 minutos. 3-5 minutos antes de adquirir en el citómetro se añaden 100μl de 7AAD diluido en HEPES. El marcaje se hizo en base a la siguiente tabla. TUBOS FL1 FL2 FL3 FL4 1 Anexina V CD4 7-AAD CD3 2 Anexina V CD23 7-AAD CD19 3 Anexina V CD56 7-AAD CD3 4 Anexina V CD8 7-AAD CD45 RO FITC PE 6. Adquirir en el citómetro de flujo. APC









