Crassostrea gigas (Thunberg, 1793)
Anuncio

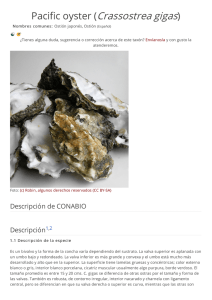
MOLLUSCA Crassostrea gigas (Thunberg, 1793) Impacto Phylum Mollusca Linnaeus, 1758 Clase Bivalvia Linnaeus, 1758 Subclase Pteriomorphia Beurlen, 1944 Orden Ostreoida Férussac, 1822 Superfamilia Ostreoidea Rafinesque, 1815 Familia Ostreidae Rafinesque, 1815 Género Crassostrea Sacco, 1897 Nombre común: Ostión japonés u ostión del Pacífico Mecanismo de introducción Intencional: Industria acuícola (GISD, 2005). Accidental: Esclerobionte en los cascos de las embarcaciones o larva en las aguas de lastre (GISD, 2005). Natural: Efecto de las mareas y corrientes (GISD, 2005). 4 El impacto ecológico de C. gigas es dramático y su efecto ha sido demostrado en varios países. Entre los daños están: el desplazamiento de especies nativas por competencia, las modificaciones en la cadena alimentaria, el cambio de hábitat, la hibridación con ostiones nativos y la transferencia de parásitos y enfermedades (Padilla et al., 2011; Nehring, 2011). La especie ha interferido con el uso recreacional de zonas costeras por su alta densidad y por el peligro que originan sus conchas (Nehring, 2011). Se incrusta en los sistemas de enfriamiento de agua siendo un problema en las centrales eléctricas (GISD, 2005). Es factible que genere pérdidas en la industria portuaria y naviera, junto con otros organismos incrustantes, favorece la corrosión de las estructuras y embarcaciones. Diagnosis Hábitat Distribución Concha pesada, variable en forma, tiende a ser alargada. Valva izquierda cóncava, con costillas grandes, fuertes y terminan en pliegues. Valva derecha plana, con lamelas hacia los bordes. Color externo: blanquecino opaco a amarillo cremoso, con manchas púrpuras. Color interno: blanco ópalo a perla, regularmente con manchas parduscas. Huella del músculo abductor generalmente sin coloración (Castillo-Rodríguez & García-Cubas, 1986; Coan et al., 2000). Estuarios, puertos y bahías de aguas tropicales y templadas. Se fija en cualquier tipo de sustrato duro en zonas protegidas y forma estructuras arrecifales en zonas intermareales; es raro encontrarla en áreas lodosas y arenosas (Nehring, 2011). Como especie nativa Estuarios y costas del Pacífico noroeste de las islas Sakhalin a Pakistán (Coan et al., 2000). Como especie exótica en Sinaloa y Pacífico mexicano Pacífico mexicano: Bahía de San Quintín (Baja California), bahía Kino y Guaymas (Sonora), y barra de Navidad (Jalisco) (Ortíz-Arellano & Salgado-Barragán, 2012 y referencias ahí citadas). Foto: Bahena-Basave, H. Biología Alimentación Filtra el material en suspensión, consume bacterias, protozoos, una amplia variedad de diatomeas, formas larvarias de otros invertebrados y detritus (GISD, 2005). Reproducción Sexual: hermafroditismo protándrico, nace como macho y a partir de la primera liberación de gametos cambia de género, aunque depende de las condiciones ambientales (Nehring, 2011). La fertilización es externa, ocurre entre 10–15 horas después del desove. Las larvas son planctónicas durante tres o cuatro semanas y miden 70–240 µm. La hembra produce entre 50–100 millones de óvulos por temporada. Maduran en un año y viven hasta 10 años (GISD, 2005). Cúmulos del ostión del Pacífico (Crassostrea gigas) cultivado en Topolobampo, Sinaloa. Comentarios Es uno de los bivalvos con mayor importancia comercial en el mundo. Se producen casi 500 millones de toneladas al año con valor de $820 MDD (FAO, 2011). Es una especie fértil y con amplia tolerancia a las condiciones ambientales (10–42 ups y 4–35°C) (Nehring, 2011). La especie fue introducida por primera vez en México (San Quintín, Baja California) en 1973. El cultivo pronto se extendió a Baja California, Baja California Sur y Sonora (Lavoie, 2005), y posteriormente, en Sinaloa, Nayarit y Jalisco. Se ha detectado el poliqueto endoparásito invasor Polydora websteri en las valvas del molusco para el último estado (Gallo-García et al., 2008). La ausencia de pigmentación en la huella del músculo abductor permite diferenciar C. gigas de sus congéneres en Sinaloa: Crassostrea columbiensis (púrpura), C. corteziensis (púrpura), C. iridescens (blanquecino a café rojizo) y C. palmula (azul-violeta a verde amarillento). En ocasiones, C. gigas puede presentar una leve coloración violácea o amarillo pardo, pero generalmente no la presenta (Castillo-Rodríguez & García-Cubas, 1986). Referencias Foto: Villalobos-Guerrero, T. F. Crassostrea gigas: Primer par, valva izquierda; segundo par, valva derecha. Sinaloa: Bahías de Altata y Navachiste, estuarios de La Pitahaya y Topolobampo (Ortíz-Arellano & Salgado-Barragán, 2012 y referencias ahí citadas). Como especie exótica en otras regiones Es uno de los invertebrados marinos con distribución más amplia. Introducida en más de 60 países repartidos en 45 ecorregiones marinas de todos los continentes, excepto en la Antártida (Molnar et al., 2008). Castillo-Rodríguez, Z. G. & García-Cubas, A. 1986. Taxonomía y anatomía comparada de las ostras en las costas de México. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. 13: 249–314. Coan, E. V., Valentich Scott, P. & Bernard, F. R. 2000. Bivalve seashells of western North America — Marine bivalve mollusks from Arctic Alaska to Baja California. Santa Barbara Museum of Natural History Monographs No. 2. 764 p. Food and Agriculture Organization (FAO). 2011. Fisheries and Aquaculture Information and Statistics Service. Fecha de actualización: 21 de octubre de 2011. http://www.fao.org/figis/servlet/ SQServlet?ds=Aquaculture&k1=SPECIES&k1v=1&k 1s=3514&outtype=html Gallo-García, M. C., García-Ulloa, M., Godínez-Siordia, D. E., Díaz, A. H. & Delgado-Blas, V. H. 2008. Polydora websteri (Annelida: Polychaeta) en el ostión del Pacífico Crassostrea gigas cultivado en Barra de Navidad, Jalisco, México. Ciencia y Mar. 12(35): 49–53. GISD (Global Invasive Species Database). 2005. Crassostrea gigas. Fecha de actualización: 01 de julio de 2005. http://www.issg.org/database/ species/ecology.asp?si=797&fr=1&sts=&lang=EN Lavoie, R. E. 2005. Oyster culture in North America history, present and future. The First International Oyster Symposium Proceedings. Oyster Research Institute News No. 17. Sendai, Japan. 10 p. Molnar, J. L., Gamboa, R. L., Revenga, C. & Spalding, M. D. 2008. Assessing the global threat of invasive species to marine biodiversity. Frontiers in Ecology and the Environment. 6: 485–492. Nehring, S. 2011. NOBANIS – Invasive Alien Species Fact Sheet – Crassostrea gigas. Fecha de actualización: 14 de marzo de 2011. http://www.nobanis.org/ files/factsheets/Crassostrea%20gigas.pdf. Ortíz-Arellano, M. A. & Salgado-Barragán, J. 2012. Capítulo III. Mollusca. En: Low Pfeng, A. M. & Peters Recagno, E. M. (Eds.). Invertebrados marinos exóticos en el Pacífico mexicano. Geomare, A. C., INE-SEMARNAT. México. En prensa. Padilla, D. K., McCann, M. J. & Shumway, S. E. 2011. Marine Invaders and Bivalve Aquaculture: Sources, impacts, and consequences. En: Shumway, S. E. (Ed.). Shellfish Aquaculture and the Environment. Wiley-Blackwell, Oxford, UK. 5 MOLLUSCA Mytilopsis adamsi Morrison, 1946 Impacto Phylum Mollusca Linnaeus, 1758 Clase Bivalvia Linnaeus, 1758 Subclase Heterodonta Neumayr, 1884 Orden Veneroida Gray, 1854 Superfamilia Dreissenoidea Gray, 1840 Familia Dreissenidae Gray, 1840 Género Mytilopsis Conrad, 1857 Se desconoce el impacto ecológico y económico de M. adamsi; sin embargo, tiene la capacidad de colonizar diversas superficies: materiales de origen natural (arena-lodosa, rocas, conchas, raíces de mangle) y de origen antrópico (muelles, pilotes, artes de pesca, jaulas de peces). Forma grandes grupos monoespecíficos, que pueden afectar la biodiversidad nativa al competir por espacio y alimento y, al igual que otros mejillones introducidos, podría alterar la composición de la comunidad fitoplanctónica (Wangkulangkul & Lheknim, 2008; Wangkulangkul, 2009). Nombre común: Falso mejillón del Pacífico Fotos: Villalobos-Guerrero, T. F. Mecanismo de introducción Accidental: Industria acuícola (camaronicultura) (SalgadoBarragán & Toledano-Granados, 2006); esclerobionte en el casco de las embarcaciones y/o larva en las aguas de lastre (Wangkulangkul & Lheknim, 2008). Diagnosis Similar a un mejillón pequeño, alargado, comprimido lateralmente, dorsalmente aguzado y ventralmente ensanchado. Alcanza 25 mm de longitud. Conchas delgadas con líneas concéntricas en el exterior; margen ventral relativamente recto. Color externo: pardo claro, en ocasiones crema y destellos blanquecinos. Color interno: blanco-crema, algunos con negro-azulado en el centro. Diente interno (apófisis) triangular, corto, más ancho que largo. Septo muy pronunciado lateralemente (Salgado-Barragán & ToledanoGranados, 2006; Wangkulangkul, 2009). 6 Mytilopsis adamsi. A) Vista interior de la valva derecha; B) vista internaanterior de la valva izquierda. Modificada de Salgado-Barragán & Toledano-Granados (2006). Biología Hábitat Estuarios y lagunas costeras de aguas tropicales. Es una especie gregaria que se fija en cualquier superficie somera, principalmente en zonas protegidas del oleaje; es raro encontrarla en solitario (Wangkulangkul, 2009). Alimentación Filtra el material en suspensión, consume fito-, zooplancton y otras partículas orgánicas suspendidas en la columna de agua (Wangkulangkul, 2009). Reproducción Sexual: funciona como macho, hembra o hermafrodita (Karande & Menon, 1975). Morton (1989) sugiere que es dioica y semélpara. La fertilización es externa, libera ~10,000 óvulos en la columna de agua (NIMPIS, 2012). Las larvas son planctónicas durante poco tiempo (~4 días). Madura en un mes, a los 8–10 mm de longitud; alcanza su talla máxima en seis meses; su longevidad es de 12–20 meses (Rao et al., 1974; Karande & Menon, 1975; Morton, 1989). Colonia de juveniles de Mytilopsis adamsi adherida a una raíz de mangle rojo. Comentarios Mytilopsis adamsi: Primer par, valva izquierda; segundo par, valva derecha. Es una especie con amplia tolerancia a las condiciones ambientales, entre 10–35°C y 0–27 ups; en laboratorio resiste un intervalo mayor, 5–40°C y 0–50 ups (Rao et al., 1975). Única especie del género presente en el Pacífico mexicano. Fue detectada por primera vez en México para el Estero de Urías, Sinaloa, en el 2000. Es probable que haya sido introducida mediante la importación de stocks de camarón blanco (Litopenaeus vannamei), cultivados en la costa atlántica de Centroamérica (Salgado-Barragán & Toledano-Granados, 2006). Recientemente, Ortíz-Arellano & Salgado-Barragán (2012) detectaron su presencia en Sinaloa (laguna Caimanero, estuarios El Verde y El Puyeque). También se ha detectado en el puerto de Lázaro Cárdenas, Michoacán; por lo que es factible que su distribución se expanda. Se diferencia del mejillón Mytella strigata, abundante en la región, por el tamaño de la concha y coloración externa, la cual es más grande y oscura (tonalidades verde militar en juveniles) (SalgadoBarragán, com. pers ). Referencias Distribución Como especie nativa Pacífico de Panamá (Salgado-Barragán & Toledano-Granados, 2006). Como especie exótica en Sinaloa y Pacífico mexicano Pacífico mexicano: Puerto de Lázaro Cárdenas, Michoacán (Ortíz-Arellano & SalgadoBarragán, 2012). Sinaloa: En raíces de mangle de los estuarios de Urías, El Verde y El Puyeque; laguna Caimanero (Ortíz-Arellano & SalgadoBarragán, 2012 y referencias ahí citadas). Como especie exótica en otras regiones Fiji, India, Malasia, Singapur, Taiwán, Japón, Tailandia y Australia (Salgado-Barragán & Toledano-Granados, 2006; Wangkulangkul & Lheknim, 2008). Karande, A. A. & Menon, K. B. 1975. Mytilopsis sallei, a fresh immigrant in Indian harbours. Bulletin of the Department of Marine Sciences, University of Cochin. 7(2): 455–466. Morton, B. 1989. Mytilopsis sallei (Recluz) (Bivalvia: Dreissenacea) recorded from Hong Kong: an introduction by Vietnamese refugees?. Malacological Review. 13: 90–92. NIMPIS. 2012. Mytilopsis sallei general information, National Introduced Marine Pest Information System. Fecha de consulta: 28 de enero de 2012. http://adl.brs.gov.au/marinepests/index. cfm?fa=main.spDetailsDB&sp =6000009583. Ortíz-Arellano, M. A. & Salgado-Barragán, J. 2012. Capítulo III. Mollusca. En: Low Pfeng, A. M. & Peters Recagno, E. M. (Eds.). Invertebrados marinos exóticos en el Pacífico mexicano. Geomare, A. C., INE-SEMARNAT. México. En prensa. Rao, K. M., Raju, P. R. & Kalyanasundaram, N. 1974. On the growth rate of Mytilopsis sallei (Recluz) a molluscan fouling species. Science and Culture. 41: 184–186. Rao, K. M., Raju, P.R., Ganti, S.S. & Kalyanasundarum, N. 1975. Metabolism in Mytilopsis sallei (Recluz) (Pelecypoda): Influence of temperature. Current Science. 44(4): 110–112. Salgado-Barragán, J. & Toledano-Granados, A. 2006. The false mussel Mytilopsis adamsi Morrison, 1946 (Mollusca: Bivalvia: Dreissenidae) in the Pacific waters of Mexico: a case of biological invasion. Hydrobiologia. 563: 1–7. Wangkulangkul, K. 2009. Variability in recruitment of non-native mussel Mytilopsis adamsi Morrison, 1946 in Haad-kaew Lagoon, Songkhla Province. Tesis de Maestría. Prince of Songkla University, Tailandia. Wangkulangkul, K. & Lheknim, V. 2008. The occurrence of an invasive alien mussel Mytilopsis adamsi Morrison, 1946 (Bivalvia: Dreissenidae) in estuaries and lagoons of the lower south of the Gulf of Thailand with comments on their establishment. Aquatic Invasions. 3(3): 325–330. 7