ejemplos de estructuras terciarias de proteínas
Anuncio

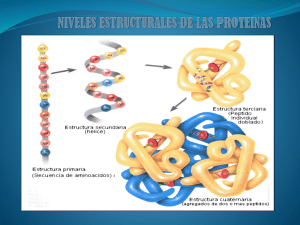
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso educativo y no de lucro IDENTIFICACIÓN DE MOTIVOS, ESTRUCTURA SECUNDARIA Y DOMINIOS EN UNA ESTRUCTURA TERCIARIA MOTIVO DOMINIO GIRO ESTRUCTURA SUPERSECUNDARIA ESTRUCTURA SECUNDARIA Arreglo (estructura tridimensional) local de los aminoácidos ESTRUCTURA TERCIARIA (ESTRUCTURA NATIVA) FUNCIÓN BIOLÓGICA ESTRUCTURA TERCIARIA 1) Estructura tridimensional de la proteína. 2) Presenta actividad biológica (estructura nativa). 3) Está dada por la manifestación de las interacciones de los grupos R de los aminoácidos: a) Interacciones hidrofóbicas. ENLACES b) Interacciones electrostáticas. NO-COVALENTES c) Puentes de hidrógeno. d) Puentes disulfuro. 4) Es una consecuencia de la estructura primaria y es por tanto, específica. 5) Es estable. 6) Los grupos polares tienden a estar en la superficie 7) Los grupos hidrofóbicos tienden a mantenerse internamente Fuerzas que generan y estabilizan la estructura terciaria de las cadenas polipeptídicas ELECTROSTÁTICAS IÓNICAS/SALINAS PUENTES DE HIDRÓGENO HIDROFÓBICAS ELECTROSTÁTICAS IÓNICAS/SALINAS HIDROFÓBICAS PUENTES DE HIDRÓGENO PUENTES DISULFURO Puentes de Hidrógeno Coordinación con iones metálicos M2+ 70 + NH3 RMET RILE 103 RFEN 30 O H O- RVAL RLEN 97 CH2 COO- COO- 85 O C CH2 CH2 45 Interacciones hidrofóbicas H3N+ CH2 H2C CH 2 H2C CH2 S S CH2 Puente disulfuro Interacciones electrostáticas ESTRUCTURA TERCIARIA DEL CITOCROMO c EJEMPLOS DE ESTRUCTURAS TERCIARIAS DE PROTEÍNAS MIOGLOBINA QUIMOTRIPSINA CADENA β DE HEMOGLOBINA EJEMPLOS DE ESTRUCTURAS TERCIARIAS DE PROTEÍNAS (a) CADENAS BETA DE LA HEMOGLOBINA. (b) PROTEINA DEL VIRUS DEL MOSAICO DEL FRIJOL EJEMPLOS DE ESTRUCTURAS TERCIARIAS DE PROTEÍNAS (c) ISOMERASA DE TRIOSAS FOSFATO (d) CARBOXIPEPTIDASA EJEMPLOS DE ESTRUCTURAS TERCIARIAS DE PROTEÍNAS (e) CITOCROMO c (f) INSULINA ESTRUCTURA CUATERNARIA (ESTRUCTURA NATIVA) FUNCIÓN BIOLÓGICA ESTRUCTURA CUATERNARIA * Es la estructura que se forma cuando dos o más polipéptidos se unen entre sí para formar una proteína con una función biológica. * Los polipéptidos que forman una proteína se llaman subunidades u oligómeros. Éstos pueden ser idénticos o diferentes. * Las interacciones que unen a los oligómeros pueden ser hidrofóbicas o puentes de Hidrógeno o iónicas o enlaces S – S. * Si los monómeros que forman un dímero son iguales forman un homodímero, por ejemplo y si son diferentes forman un heterodímero * Puede haber proteínas diméricas, triméricas, tetraméricas, etc., que están formadas por dímeros, trímeros, tetrámeros, etc. * Las proteínas con estructura cuaternaria pueden ser: GLOBULARES O FIBROSAS (aunque también las proteínas con sólo estructura terciaria pueden ser globulares) . EJEMPLOS DE PROTEÍNAS CON ESTRUCTURA CUATERNARIA EL ARREGLO DE UNA PROTEÍNA PARTICULAR ES EL RESULTADO DE SU SECUENCIA ÚNICA Y ESPECÍFICA DE AMINOÁCIDOS Y ES INDISPENSABLE PARA SU FUNCIONALIDAD Ha y Loh, 2012 Chemistry 18 (26):7984 LAS PROTEÍNAS SON MOLÉCULAS FLEXIBLES CAPACES DE ADOPTAR DIFERENTES CONFORMACIONES Dominio amino carboxilo Ha y Loh, 2012 Chemistry 18 (26):7984 UN ENTORNO CELULAR IMPLICA UNA ESTRUCTURA PROTEICA ESPECÍFICA DÍA SOLEADO Entorno: Temperatura Humedad Presión NIÑOS CON ROPA LIGERA CAMBIOS EN EL ENTORNO PUEDEN PROVOCAR CAMBIOS EN LA ESTRUCTURA LA FUNCIÓN DE UNA PROTEÍNA DEPENDE DE SU ESTRUCTURACIÓN CORRECTA LA PÉRDIDA DE LA ESTRUCTURA CONDUCE A LA PÉRDIDA DE FUNCIÓN ESTADO CONOCIDO COMO DESNATURALIZACIÓN Pérdida de la estructura terciaria de una proteína. Desnaturali_ zación. Proteína en estado nativo Actividad biológica Proteína en estado desnaturalizado Sin actividad Conformación termodinámicamente más estable. Pérdida de la estructura terciaria, y en las que la tienen, de la cuaternaria AGENTES DESNATURALIZANTES: pH extremos, temperaturas extremas, altas Fuerzas iónicas, detergentes Agentes reductores de puentes disulfuro AGENTES DESNATURALIZANTES: •pH (rompe puentes de H y salinos) •TEMPERATURA (perturba puentes de H y salinos) •SOLVENTES (perturba interacciones hidrofóbicas) •ALTAS FUERZAS IÓNICAS (perturba puentes salinos, y de H) •DETERGENTES (perturba interacciones hidrofóbicas) •AGENTES REDUCTORES DE GRUPOS S-S (reducen puentes disulfuro) β−mercaptoetanol ditiotreitol Todos ellos perturban las estructura secundaria, terciaria y cuaternaria de las proteínas, pero nunca alteran la estructura primaria, ya que estos agentes sólo rompen interacciones no covalentes (excepto los agentes reductores de S-S) Pérdida de la estructura terciaria de una proteína. Desnaturali_ zación. El caso de la Ribonucleasa (proteína que degrada al RNA) 92 58 Puentes disulfuro 65 110 26 95 40 Estado nativo Urea + β-MSH Conformación termodinámicamente más estable. Actividad biológica Agentes reductores de S S 2 SH 65 40 92 Estado desnaturalizado 58 84 26 110 Sin actividad 95 Puentes disulfuro reducidos 92 -Urea - βMSH 58 65 110 Estado Re-naturalizado 26 95 40 Pérdida de la estructura terciaria, y en ciertos casos, de la cuaternaria PLEGAMIENTO DE PROTEÍNAS LAS PROTEÍNAS ADOPTAN DURANTE Y DESPUÉS DE SU BIOSÍNTESIS EN LOS RIBOSOMAS, LA ESTRUCTURA TRIDIMENSIONAL QUE LES PERMITE LLEVAR A CABO SU FUNCIÓN BIOLÓGICA ESPECÍFICA ALGUNAS PROTEÍNAS REQUIEREN DE UN PLEGAMIENTO ASISTIDO (POR OTRAS PROTEÍNAS “CHAPERONAS”) LAS PROTEÍNAS SE PLIEGAN RÁPIDAMENTE (PARADOJA DE LEVINTHAL) PROTEÍNA (100 aa) c/aa 10 conformaciones 10010 c/conformación = 1077 años 10-13 s ALGUNAS PROTEÍNAS REQUIEREN DE UN PLEGAMIENTO ASISTIDO (POR OTRAS PROTEÍNAS “CHAPERONAS”) PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento específico de ligandos, sin transformarlo e) Unión de alguna especie para transporte f) Acarreadores en membranas:- reconocimiento, transporte y a menudo, actividad catalítica g) Estructurales.- Andamios moleculares CLASIFICACIÓN DE LAS PROTEÍNAS DE ACUERDO A SU NIVEL DE ESTRUCTURACIÓN: PROTEÍNAS FIBROSAS.- Constan mayoritariamente de un único tipo de estructura secundaria (α-QUERATINA, COLÁGENO) DAN SOPORTE, FORMA Y PROTECCIÓN EXTERNA PROTEÍNAS GLOBULARES.- Contienen varios tipos de estructura secundaria (MIOGLOBINA) SON ENZIMAS Y PROTEÍNAS REGULADORAS QUE TIENEN PATRONES DE PLEGAMIENTO MUY COMPLEJOS PROTEÍNAS FIBROSAS ♣ CONFIEREN FUERZA Y/O ELASTICIDAD ♣ SU UNIDAD ESTRUCTURAL FUNDAMENTAL ES LA REPETICIÓN DE UN ELEMENTO SIMPLE DE ESTRUCTURA SECUNDARIA ♣ SON INSOLUBLES EN AGUA (ELEVADO CONTENIDO DE aa HIDROFÓBICOS) ESTRUCTURA CARACTERÍSTICAS HÉLICE α Estructuras protectoras insolubles y resistentes, de dureza y flexibilidad variables TRIPLE HÉLICE Elevada resistencia a la tensión, sin capacidad de estiramiento EJEMPLOS α-QUERATINA (cabello, plumas y uñas) COLÁGENO (de los tendones, matriz ósea) LA α-QUERATINA = ENROLLAMIENTO EN SUPERHÉLICE (LEVÓGIRO) RESIDUOS HIDROFÓBICOS INTERACCIONES: Puentes de hidrógeno Hidrofóbicas Puentes disulfuro Estructura cuaternaria Estructura secundaria EL PAPEL DE LOS AGENTES DESNATURALIZANTES DURANTE LA ONDULACIÓN PERMANENTE Temperatura Ruptura de puentes de Hidrógeno Agente reductor LAVADO Agente oxidante EL COLÁGENO Hélice α LEVÓGIRA (3 residuos por vuelta) Gly-X-Pro Gly-Pro-4-HyP SUPERENROLLAMIENTO DEXTRÓGIRO (3 cadenas α) GLICINA ESCORBUTO (Deficiencia en Vitamina C) requerida para la hidroxilación de PROLINA IMPORTANCIA DE LA VITAMINA C PARA LA HIDROXILACIÓN DE LA PROLINA, RESIDUO NECESARIO PARA LA CORRECTA ESTRUCTURACIÓN DEL COLÁGENO Prolil 4-hidroxilasa Prolil 4hidroxilasa ESCORBUTO 1 millón de marinos murieron entre 1600-1800 PROTEÍNAS GLOBULARES ♣ LOS DIFERENTES SEGMENTOS DE UNA CADENA POLIPEPTÍCA SE PLIEGAN UNOS SOBRE OTROS (TIENEN UNA FORMA COMPACTA) ♣ DIVERSIDAD ESTRUCTURAL ♣ TIENEN AMPLIA VARIEDAD FUNCIONAL LA MIOGLOBINA CARACTERÍSTICAS: Primer proteína cristalizada Es fijadora de O2 de células musculares 16700 (153 residuos) una sola cadena polipeptídica Un grupo hemo o ferroprotoporfirina HEMO Estructura terciaria Leu, Ile, Val, Phe Pro EL GRUPO HEMO, UN GRUPO MUY VERSATIL Protoporfirina His 93 LA MIOGLOBINA ACCESO RESTRINGIDO Necesario para protección del grupo HEMO 64 98 HEMOGLOBINA Se localiza en los eritrocitos (glóbulos rojos sanguíneos) Su función es transportar oxígeno Une oxígeno TIENE ESTRUCTURA CUATERNARIA Es tetramérica (Mr 64 500) tiene 4 grupos prostéticos (gpos HEMO) unidos a cada una de las cadenas polipeptídicas TIENE DOS CADENAS α Y DOS CADENAS β Mioglobina Subunidad β de la Hemoglobina LA HEMOGLOBINA CAMBIA SU ESTRUCTURA CUANDO UNE EL OXÍGENO ES UNA PROTEÍNA ALOSTÉRICA (CAMBIA DE FORMA)