1 – Dê o nome dos compostos abaixo. a) Ca3(PO4)2 b) SnF2 c
Anuncio
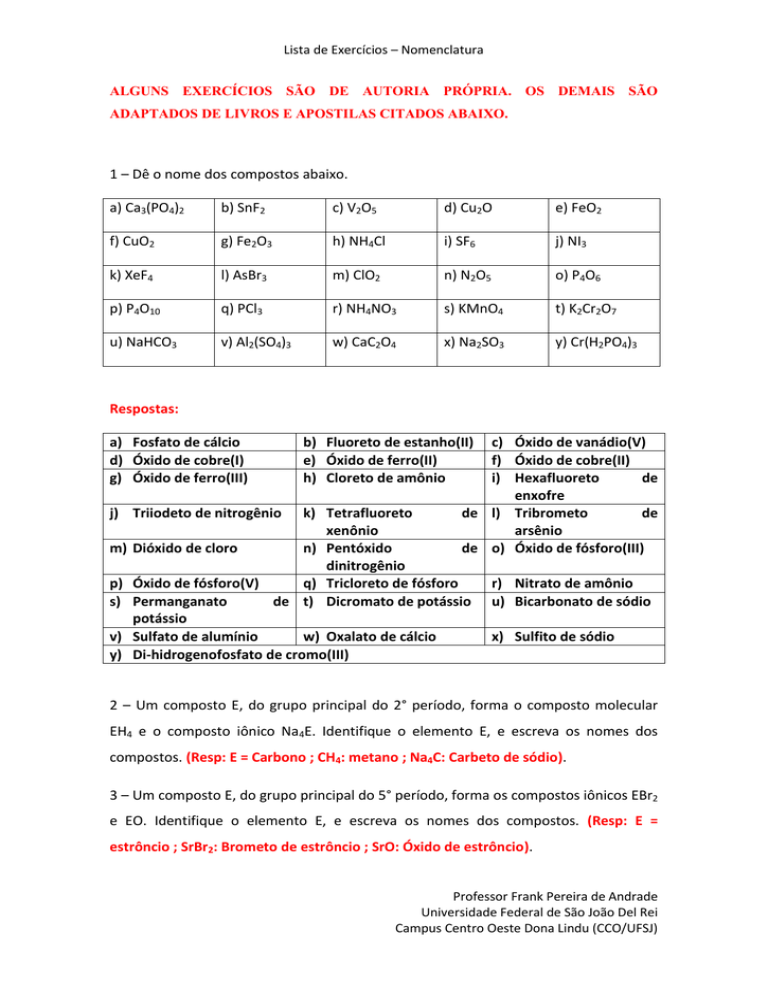
Lista de Exercícios – Nomenclatura ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS E APOSTILAS CITADOS ABAIXO. 1 – Dê o nome dos compostos abaixo. a) Ca3(PO4)2 b) SnF2 c) V2O5 d) Cu2O e) FeO2 f) CuO2 g) Fe2O3 h) NH4Cl i) SF6 j) NI3 k) XeF4 l) AsBr3 m) ClO2 n) N2O5 o) P4O6 p) P4O10 q) PCl3 r) NH4NO3 s) KMnO4 t) K2Cr2O7 u) NaHCO3 v) Al2(SO4)3 w) CaC2O4 x) Na2SO3 y) Cr(H2PO4)3 Respostas: a) Fosfato de cálcio d) Óxido de cobre(I) g) Óxido de ferro(III) j) Triiodeto de nitrogênio m) p) s) v) y) b) Fluoreto de estanho(II) e) Óxido de ferro(II) h) Cloreto de amônio c) Óxido de vanádio(V) f) Óxido de cobre(II) i) Hexafluoreto de enxofre de l) Tribrometo de arsênio de o) Óxido de fósforo(III) k) Tetrafluoreto xenônio Dióxido de cloro n) Pentóxido dinitrogênio Óxido de fósforo(V) q) Tricloreto de fósforo Permanganato de t) Dicromato de potássio potássio Sulfato de alumínio w) Oxalato de cálcio Di-hidrogenofosfato de cromo(III) r) Nitrato de amônio u) Bicarbonato de sódio x) Sulfito de sódio 2 – Um composto E, do grupo principal do 2° período, forma o composto molecular EH4 e o composto iônico Na4E. Identifique o elemento E, e escreva os nomes dos compostos. (Resp: E = Carbono ; CH4: metano ; Na4C: Carbeto de sódio). 3 – Um composto E, do grupo principal do 5° período, forma os compostos iônicos EBr2 e EO. Identifique o elemento E, e escreva os nomes dos compostos. (Resp: E = estrôncio ; SrBr2: Brometo de estrôncio ; SrO: Óxido de estrôncio). Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Nomenclatura 4 – Escreva a fórmula dos compostos abaixo. a) Fosfato de amônio b) Fosfato de alumínio c) Acetato de prata d) Carbonato de amônio e) Trióxido de diboro (óxido bórico) f) Ácido fluorídrico g) Ácido clorídrico (ácido muriático) h) Ácido fosfórico i) Ácido cianídrico j) Ácido sulfúrico k) Ácido carbônico l) Ácido acético m) Ácido nítrico n) Hidróxido de sódio (soda cáustica) o) Hidróxido de potássio p) Hidróxido de amônio q) amônia r) peróxido de hidrogênio s) decafluoreto de dienxofre t) monóxido de carbono u) dióxido de carbono v) carbonato de lítio w) bissulfito de potássio x) sulfato de cobalto(II) (hidrogenossulfito de potássio) y) hipoclorito de cálcio z) cromato de potássio Respostas: a) (NH4)3PO4 b) AlPO4 c) CH3COOAg d) (NH4)2CO3 e) B2O3 f) HF g) HCl h) H3PO4 i) HCN j) H2SO4 k) H2CO3 l) CH3COOH m) HNO3 n) NaOH o) KOH p) NH4OH q) NH3 r) H2O2 s) S2F10 t) CO u) CO2 v) Li2CO3 w) KHSO3 x) CoSO4 y) Ca(ClO)2 z) K2CrO4 Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Nomenclatura 5 – Os nomes de alguns compostos de hidrogênio são exceções às regras normais de nomenclatura. Examine os seguintes compostos, escreva seus nomes e identifique-os como iônicos ou moleculares: a) LiAlH4; b)NaH; Respostas: a) Hidreto de alumínio e lítio (iônico) ; Hidreto de sódio (iônico) 6 – Dê os nomes dos seguintes compostos: a) BaMoO4 ; b) Na3AsO4 ; c) CaSeO3 ; d) Ba3(SbO4)2; e) NH4SCN ; f) Co2(TeO4)3 ; g) AlBO3 ; h) Na2S2O3 ; i) K2S ; j) UO2Cl2 ; k) VOS Respostas: a) molibidato de bário ; b) arsenato de sódio ; c) selenato de cálcio ; d) antimoniato de bário ; e) tiocianato de amônio ; f) telurato de cobalto ; g) borato de alumínio ; h) tiossulfato de sódio ; i) dissulfeto de potássio ; j) cloreto de uranila ; k) sulfeto de vanadila. 7 – Escreva as formulas dos compostos iônicos obtidos de: a) sódio e íons óxido; b) potássio e íons sulfato; c) prata e íons fluoreto; d) zinco e íons nitrato; e) alumínio e íons sulfeto; f) cálcio e íons cloreto; g) ferro(III) e íons sulfato; h) amônio e íons iodeto; i) lítio e íons sulfeto; j) cálcio e íons fosfeto. Respostas: a) Na2O ; b) K2SO4 ; c) AgF ; d) Zn(NO3)2 ; e) Al2S3 ; f) CaCl2 ; g) Fe2(SO4)3 ; h) NH4I ; i) Li2S ; j) Ca3P Referências 1. Kotz, J. C.; Treichel, P. M.; Weaver, G. C. Química eral e Reações Químicas. 6ª ed. Cengage Learning, São Paulo, 2009. 2. Atkins, P.; Jones, L.; Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. 3ª ed. Bookman, Porto Alegre, 2006. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ)











