Transparencias del Tema 4 de Ingeniería Química 2005/2006
Anuncio

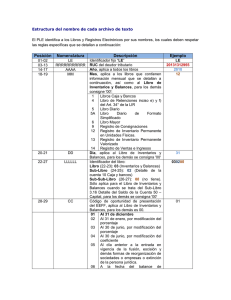
TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.1 INTRODUCCIÓN. Ecuación general de balance macroscópico de propiedad para un sistema con múltiples corrientes de entrada y salida: C.P. Generada d (V·Π) = ∑ E (ΦE·ΠE ) − ∑ S (ΦS·ΠS ) + ( FNPNAFM) ± tiempo dt d (V·Π) d (V·ΠS ) = 1. Sistema perfectamente mezclado: dt dt TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.1 INTRODUCCIÓN. Ecuación general de balance macroscópico de propiedad para un sistema con múltiples corrientes de entrada y salida: C.P. Generada d (V·ΠS ) = ∑ E (ΦE·ΠE ) − ∑ S (ΦS·ΠS ) + ( FNPNAFM) ± tiempo dt d (V·Π) d (V·ΠS ) = 1. Sistema perfectamente mezclado: dt dt 1. Sistema perfectamente mezclado: no existe gradiente. 2. Sistema monofásico: no hay corrientes de transferencia. ∃ FNPNAFM TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.1 INTRODUCCIÓN. Ecuación general de balance macroscópico de propiedad para un sistema con múltiples corrientes de entrada y salida: C.P. Generada d (V·ΠS ) = ∑ E (ΦE·ΠE ) − ∑ S (ΦS·ΠS ) ± tiempo dt d (V·Π) d (V·ΠS ) = 1. Sistema perfectamente mezclado: dt dt 1. Sistema perfectamente mezclado: no existe gradiente. 2. Sistema monofásico: no hay corrientes de transferencia. 3. Sistema sin reacción química: C.P. Generada =0 tiempo ∃ FNPNAFM TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.1 INTRODUCCIÓN. Ecuación general de balance macroscópico de propiedad para un sistema con múltiples corrientes de entrada y salida: d (V·ΠS ) ( ) ( ) Φ Π − Φ Π = · · ∑E E E ∑S S S dt d (V·Π) d (V·ΠS ) = 1. Sistema perfectamente mezclado: dt dt 1. Sistema perfectamente mezclado: no existe gradiente. 2. Sistema monofásico: no hay corrientes de transferencia. 3. Sistema sin reacción química: C.P. Generada =0 tiempo ∃ FNPNAFM TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.3 BASE DE CÁLCULO. DEFINICIÓN: Cantidad establecida arbitrariamente a la que referimos todos los cálculos de un balance. • No afecta a los resultados de las variables intensivas (composiciones, temperaturas, etc). • Afecta a los resultados de las variables extensivas (caudales, etc). • Puede afectar a la laboriosidad de los cálculos implicados. NIVELES DE PRIORIDAD PARA LA ELECCIÓN DE UNA BASE DE CÁLCULO: Son más importantes en sistemas complejos (multicomponentes, etc) 1. Una determinada cantidad de un INERTE (no sufre reacción química) que entre y salga del sistema con el mismo caudal y formando parte de una sola corriente (todo esto puede no ser posible en algunos casos). 2. Una determinada cantidad, de la corriente de entrada o de la de salida, de la que se tenga la mayor información (normalmente la más especificada). 3. Un determinado periodo de tiempo (en sistemas donde ∃ flujo). TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.3 BASE DE CÁLCULO. EJEMPLO PARA LA ELECCIÓN DE LA BASE DE CÁLCULO: Si A contiene sólo agua, calcular la relación de caudales A/S. F (Alimentación) wF sal = 0.05 EVAPORADOR A (Agua) S (Concentrado) wS sal = 0.30 NIVELES DE PRIORIDAD PARA LA ELECCIÓN DE UNA BASE DE CÁLCULO: 1. Una determinada cantidad de un INERTE. 2. Una determinada cantidad de la que se tenga la mayor información. 3. Un determinado periodo de tiempo (en sistemas donde ∃ flujo). TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.4 BALANCES ATÓMICOS. SISTEMAS CON REACCIÓN QUÍMICA: los moles de los componentes que participen en la reacción varían entre la entrada y la salida del sistema. MÉTODOS DE ESTUDIO DE SISTEMAS CON REACCIÓN QUÍMICA: 1. 2. Tener en cuenta el término de generación en los balances. Utilizar BALANCES ATÓMICOS. BALANCES ATÓMICOS: (Átomos que entran al sistema) = (Átomos que salen del sistema) FORMULACIÓN DEL BALANCE ATÓMICO: Se realizarán a uno o todos los elementos presentes (C, H, O, etc), para un elemento genérico X se utiliza: CAUDAL · Σ( mol de corriente tiempo COMPOSICIÓN DE UN COMPUESTO C DE ESA CORRIENTE mol de C mol de corriente · ÁTOMOS-GRAMO DE X EN EL COMPUESTO C átomo de X mol de C ) átomo de X tiempo TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. SISTEMAS BIFÁSICOS DE INTERÉS: • • • • • Gas – líquido (absorción). Líquido – vapor (destilación). Líquido – líquido (extracción). Aire – agua (secado, humidificación, acondicionamiento de aire). Sólido – líquido (extracción sólido – líquido o lixiviación). EQUILIBRIO: Al poner dos fases (α y β) en contacto (aisladas del entorno), sus propiedades evolucionan hasta alcanzar espontáneamente unos valores denominados de EQUILIBRIO, que no se modificarán espontáneamente. CONDICIONES TERMODINÁMICAS DEL EQUILIBRIO: 1. 2. 3. EQUILIBRIO MECÁNICO: EQUILIBRIO TÉRMICO: EQUILIBRIO DE COMPONENTES: Pα = Pβ Tα = Tβ μjα = μjβ μj = ∂ Uj ∂ nj T,P,ni ≠ j EXISTENCIA DE EQUILIBRIO ⇒ CUMPLIMIENTO LEY DE EQUILIBRIO No implica que las composiciones entre fases sean iguales (que no lo suelen ser), sino que existe una relación entre las mismas (no son independientes). TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.1 ESTUDIO DEL EQUILIBRIO DE SISTEMAS GAS-LÍQUIDO. Ley general de equilibrio: μjα = μjβ LEY DE HENRY fj = kH·aj fj = fugacidad componente j kH= constante de Henry; f(T) aj = actividad componente j a j = c j· γ aj fj = Pj· γ fj a j = x j· γ aj Pj = presión parcial j γfj = coeficiente de fugacidad de j GAS IDEAL: fj = Pj GAS REAL: fj ≠ Pj xj = fracción molar de j cj = concentración molar de j γaj = coeficiente de actividad de j γfj = γaj = 1 aj = cj aj = xj Pj = kH·c j Pj = kH·x j SISTEMA PjP SISTEMA j REAL IDEAL γfj ≠ 1 ; γaj ≠ 1 aj ≠ cj aj ≠ xj kH· γ aj Pj = ·c j γ fj kH· γ aj Pj = ·x j γ fj T1 T1 kH (T1) T2T 2 kH (T2) xjxó ócjc j j TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. Ley general de equilibrio: μjα = μjβ LEY DE RAOULT fj = fj 0·aj fj = fugacidad componente j aj = actividad componente j fj0 = fugacidad de un vapor constituido sólo por j en equilibrio con j líquido a TMEZCLA LEY DE LEWIS-RANDALL fj = fj'·Yj fj = fugacidad componente j yj = fracción molar de j en la fase gas fj’ = fugacidad de j puro a TMEZCLA y PMEZCLA PARA SISTEMAS IDEALES: LEY DE RAOULT Pj = Pj 0·xj LEY DE LEWIS-RANDALL Pj = PT·Yj TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. PARA SISTEMAS IDEALES: LEY DE RAOULT LEY DE LEWIS-RANDALL Pj = Pj 0·xj Pj = PT·Yj Sistema ideal de dos componentes: P1 = P10·x1 P1 = PT·Y1 P2 = P2 0·x2 P2 = PT·Y2 x1 + x2 = 1 x1 = x x2 = 1 − x y1 + y2 = 1 y1 = Y Y2 = 1 − Y P1 = P10·x = PT·y P2 = P2 0·(1 − x) = PT·(1 − y) PT = P1 + P2 = P10·x + P2 0·(1 − x ) TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. PARA SISTEMAS IDEALES: (TEMPERATURA CONSTANTE) PT, P1, P2 PT = P1 + P2 = P10·x + P2 0·(1 − x ) P1 = P10·x P2 = P2 0·(1 − x) P10 P20 0 1 x TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. PT, P1, P2 PARA SISTEMAS REALES: (TEMPERATURA CONSTANTE) DESVIACIÓN POSITIVA DE LA LEY DE RAOULT 0 1 x TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. PT, P1, P2 PARA SISTEMAS REALES: (TEMPERATURA CONSTANTE) PT, P1, P2 DESVIACIÓN POSITIVA DE LA LEY DE RAOULT 0 1 x DESVIACIÓN NEGATIVA DE LA LEY DE RAOULT 0 1 x TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. T (º C) P10 (mm Hg) P20 (mm Hg) α (adimensional) 98.4 760 337 2.255 102 841 380 2.213 106 941 429 2.193 108 993 452 2.197 112 1104 510 2.165 116 1228 574 2.139 120 1368 647 2.114 125 1593 760 2.096 P10 α = 0 P2 α MEDIO = 2.17 TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. APLICACIÓN DE LAS LEYES DE RAOULT Y LEWIS-RANDALL: PT = P1 + P2 = P10·x + P2 0·(1 − x ) P1 = P10·x = PT·y PT − P2 0 760 − P2 0 x = 0 = 0 P1 − P2 0 P1 − P2 0 P10·x P10·x y = = PT 760 APLICACIÓN DE LA VOLATILIDAD RELATIVA: α MEDIO = 2.17 α MEDIO·x 2.17·x Y = = 1 + x·( α MEDIO − 1) 1 + 1.17·x TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.2 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-VAPOR. 1 0.8 0.6 y Lewis-Randall Volatilidad relativa 0.4 0.2 0 0 0.2 0.4 0.6 x 0.8 1 TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. X 100 80 90 10 0 0 10 A: Mezcla binaria 80% X; 20% Y 90 20 80 70 30 70 60 40 60 50 50 50 40 60 B: Mezcla binaria 50% X;50% Z 40 30 30 70 20 90 10 0 0 100 10 20 80 0 100 Y 10 20 30 40 50 60 70 80 90 Z TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. X D: Mezcla ternaria 20% X; 40% Y; 40% Z 100 10 0 0 90 10 90 80 20 70 40% Y 80 30 70 60 40 60 50 50 40% Z 50 40 60 40 30 30 70 20 10 0 0 100 0 100 Y 20% X 90 10 20 80 10 20 30 40 50 60 70 80 90 Z TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. X SUMA DE CANTIDADES: REGLA DE LA PALANCA 100 10 0 0 Si mezclamos dos cantidades A y B, la resultante C estará en la recta que une A y B 10 90 A · AC = B · CB 90 80 80 20 30 70 A · (AX − CX ) = B · (CX − BX ) 70 40 50 60 Siendo X = X, Y o Z 60 A 50 50 AC 40 60 40 70 C 30 CB 30 20 B 90 10 10 20 80 0 100 Y 0 10 20 30 40 50 60 70 80 90 0 100 Z TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. ALIMENTACIÓN (B,S) MEZCLA DE FASES DISOLVENTE (D) REFINADO • Rico en B. • S no extraído. • D disuelto. SEPARACIÓN DE FASES EXTRACTO • Rico en D. • S extraído. • B disuelto. TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S 1 0 0 0 100 9 0 10 90 8 0 20 80 7 0 30 70 6 0 40 60 50 5 0 REFINADOS 50 4 0 60 40 70 3 0 EXTRACTOS 30 RECTAS DE REPARTO 80 20 90 10 1 0 2 0 SOLUTO 100 0 INERTE B 0 10 20 30 40 50 60 70 80 90 0 100 D DISOLVENTE TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S 1 0 0 0 9 0 10 90 8 0 20 80 7 0 30 70 6 0 40 60 CURVA BINODAL 5 0 50 50 4 0 60 40 3 0 70 30 RECTAS DE REPARTO 80 20 90 10 1 0 2 0 100 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S 1 0 0 0 9 0 10 90 8 0 20 80 7 0 30 6 0 40 5 0 60 ZONA DE MISCIBILIDAD 50 CURVA BINODAL: EQUILIBRIO ENTRE LAS DOS FASES 70 50 4 0 60 40 3 0 70 30 ZONA DE INMISCIBILIDAD 80 90 20 10 1 0 2 0 100 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S RECTAS DE REPARTO: - Sistema ideal: paralelas. - Sistema real: curva Auxiliar de SHERWOOD 1 0 0 0 8 0 9 0 10 90 20 80 7 0 30 70 6 0 40 60 5 0 50 50 4 0 60 40 3 0 70 30 80 20 90 10 1 0 2 0 100 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S Curva Auxiliar de SHERWOOD 1 0 0 0 MÉTODO DE TRAZAR LAS RECTAS DE REPARTO 8 0 9 0 10 90 20 80 30 7 0 Se conoce el EXTRACTO 70 6 0 40 60 5 0 50 50 4 0 60 40 3 0 70 30 80 20 90 10 1 0 2 0 100 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S Curva Auxiliar de SHERWOOD 1 0 0 0 MÉTODO DE TRAZAR LAS RECTAS DE REPARTO 8 0 9 0 10 90 20 80 30 7 0 Se conoce el REFINADO 70 6 0 40 60 5 0 50 50 4 0 60 40 3 0 70 30 80 20 90 10 1 0 2 0 100 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S Curva Auxiliar de SHERWOOD 1 0 0 0 MÉTODO DE TRAZAR LAS RECTAS DE REPARTO 10 9 0 8 0 1. Se coloca R. 100 90 20 7 0 30 2. Se busca E y se traza la recta de reparto Se conoce un punto bajo la curva binodal: M Nota: al estar en la zona de inmiscibilidad, se separará en 80 extracto y refinado. 70 40 6 0 60 3. Se repite 1 y 2 hasta 50 que M esté en la recta de reparto 60 4 0 5 0 50 M 40 30 R1 80 20 90 10 1 0 2 0 3 0 70 E1 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. S Curva Auxiliar de SHERWOOD 1 0 0 0 MÉTODO DE TRAZAR LAS RECTAS DE REPARTO 8 0 9 0 10 90 20 7 0 30 Se conoce un punto bajo la curva binodal: M Nota: al estar en la zona de inmiscibilidad, se separará en 80 extracto y refinado. 70 6 0 40 60 5 0 50 50 E2 4 0 60 3 0 70 40 M R2 30 80 20 90 10 1 0 2 0 100 0 100 B 0 10 20 30 40 50 60 70 80 90 0 100 D TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 60 40 30 70 30 20 20 80 10 0 0 100 10 90 0 100 Cl3CH 10 20 30 40 50 60 70 80 90 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 60 40 30 70 30 20 20 80 10 0 0 100 10 90 0 100 Cl3CH 10 20 30 40 50 60 70 80 90 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 60 40 30 70 30 20 20 80 10 0 0 100 10 90 0 100 Cl3CH 10 20 30 40 50 60 70 80 90 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 F (30% AcH, 70% Cl3CH) 60 30 70 30 80 20 20 WM AcH =0.136 40 90 10 10 M 0 100 0 Cl3CH 10 20 30 40 50 60 70 80 90 D (100% H2O) 0 100 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 60 40 30 70 30 20 20 80 90 10 10 M 0 100 0 Cl3CH 10 20 30 40 50 60 70 80 90 0 100 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 60 40 30 70 30 20 20 80 90 10 10 M 0 100 0 Cl3CH 10 20 30 40 50 60 70 80 90 0 100 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 40 60 40 30 70 30 20 20 80 90 10 10 M 0 100 0 Cl3CH 10 20 30 40 50 60 70 80 90 0 100 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.3 ESTUDIO DEL EQUILIBRIO DE SISTEMAS LÍQUIDO-LÍQUIDO. AcH 100 10 0 0 90 90 10 80 80 20 70 70 30 60 60 40 50 50 50 R: refinado 40 60 3.8 % AcH 94.7 % Cl3CH 1.5 % H2O 70 30 E: extracto 40 30 80 20 E 20 10 90 10 M R 0 100 0 Cl3CH 10 20 30 40 50 60 70 80 18.1 % AcH 2.1 % Cl3CH 79.8 % H2O 90 0 100 H2O TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.4 ESTUDIO DEL EQUILIBRIO DE SISTEMAS AIRE - AGUA. CASO PARTICULAR DEL EQUILIBRIO GAS – VAPOR Operación básica de HUMIDIFICACIÓN: (humidificación, secado, acondicionamiento de aire, acondicionamiento de humedad, etc) EQUILIBRIO AIRE – AGUA A 1 atm: Y: Humedad Absoluta: Kg vapor agua Kg aire seco wAGUA Y= 1 − wAGUA wAGUA Y = 1+ Y t: Temperatura º C DIAGRAMA PSICOMÉTRICO ϕ: Humedad Relativa % ϕ= PAGUA PAGUA 0 ϕ = 1 Aire saturado. ϕ > 1 Aire sobresaturado. ϕ < 1 Aire insaturado. tw: Temperatura Húmeda º C TEMA 4. BALANCES MACROSCÓPICOS DE MATERIA. 4.5 ESTUDIO DE SISTEMAS BIFÁSICOS EN EQUILIBRIO. 4.5.4 ESTUDIO DEL EQUILIBRIO DE SISTEMAS AIRE - AGUA. DIAGRAMA PSICOMÉTRICO ϕ = 1 (Equilibrio) Y ϕ>1 (aire sobresaturado) ISOLÍNEAS DE ϕ < 1 (aire insaturado) ISOLÍNEAS DE tw t