Diagnóstico Micológico
Anuncio

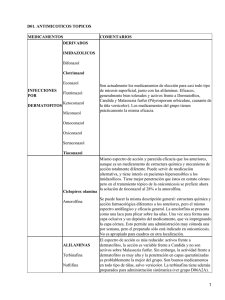
DEL “MODULO INFECCIONES MICOTICAS DEL CURSO DE ACTUALIZACION EN MICROBIOLOGIA CLINICA” dictado en Panamá en octubre de 2004 Dra Liliana Guelfand Dermatofitosis Los dermatofitos están integrados por los géneros Trichophyton (T), Microsporum (M) y Epidermophyton (E). Presentan distribución mundial aunque algunas especies están limitadas geográficamente. Se definen 3 tipos de dermatofitos dependiendo de su “hábitat” normal en: antropófilos (humano), zoófilos (animal) y geófilos (suelo) (Tabla III). Los miembros de los 3 grupos pueden causar infecciones en humanos. Tabla III. Ecología de los dermatofitos más frecuentes Antropófilos Zoófilos Geófilos E.floccosum M.canis var.canis M.gypseum M.audouinii M.equinum M.cookei T.mentagrophytes M.gallinae var.interdigitale T.rubrum T.equinum T.tonsurans T.violaceum T.mentagrophytes var.mentagrophytes T.verrucosum T.concentricum M.nanum* T.shoenleinii *Zoófito y geófilo Las dermatofitosis afectan a individuos de cualquier raza, sexo, edad u ocupación. Son contagiosos y pueden originar focos epidémicos en familias, escuelas, asilos, etc. Las manifestaciones clínicas van a depender del estado inmunológico del paciente, del tipo de dermatofito y del sitio de la infección. Producen lesiones que varían desde eritema leve y escamoso hasta lesiones severas, supurativas o costrosas. Pueden ser asintomáticas o muy pruriginosas y dolorosas. Las dermatofitosis incluyen diferentes entidades clínicas, según el sitio anatómico que afecte: Tiña del cuero cabelludo (pelo, cejas y pestañas), Tiña del cuerpo, Tiña de la ingle, Tiña de la barba y bigote, Tiña de la mano, Tiña de los pies y Tiña de las uñas. (Tabla IV) Tabla IV. Enfermedades clínicas frecuentes Enfermedad Tinea capitis (Tiña del cuero cabelludo) Tinea favica (Tiña del cuero cabelludo) Tinea corporis (Tiña del cuerpo) Tinea (Tiña Tinea (Tiña imbricata del cuerpo) cruris de la ingle) Tinea barbae (Tiña de la barba y bigote) Tinea nanuum (Tiña de las manos) Tinea pedis (Tiña de los pies) Tinea unguium (Tiña de las uñas) y agentes etiológicos mas Dermatofito Microsporum spp. Trichophyton spp. T. shoenleinii T. violaceum(infrecuente) T. gypseum (infrecuente) E. floccosum Microsporum spp. Trichophyton spp. T. concentricum E. T. T. T. T. T. T. T. T. E. T. T. T. E. floccosum rubrum. mentagrophytes mentagrophytes rubrum violaceum verrucosum megninii rubrum floccosum mentagrophytes rubrum mentagrophytes floccosum T. rubrum T. mentagrophytes Diagnóstico Micológico Consideraciones generales para el Estudio Micológico de las dermatofitosis El diagnóstico de las micosis de la piel y sus faneras se basa fundamentalmente en el hallazgo de hifas o esporos característicos en el examen microscópico directo y en el aislamiento del agente causal en los cultivos. Toma de la muestra: El paciente debe prepararse para la obtención de la muestra; esta etapa es fundamental para reducir al máximo la presencia de microorganismos contaminantes o colonizantes y de sustancias (cremas, talco, etc.) que puedan interferir en la observación microscópica. Se debe suspender todo medicamento con acción antifúngica (sistémico o tópico),10 a 15 días previos a la extracción del material. Para la obtención de la muestra se utiliza dos portaobjetos y un bisturí esterilizados en estufa de secado o a la llama. Examen microscópico: Para visualizar mejor a los elemento fúngicos durante el examen microscópico, se debe disolver la queratina sin afectar la morfología del hongo. Para ello se pueden utilizar: hidróxido de potasio (KOH) en concentraciones del 10 al 40%, se le puede agregar tinta azul negra indeleble de Parker y glicerina 1/10 y calentar el preparado a la llama; KOH con dimetilsulfóxido o blanco calco flúor para muestras poco parasitadas. Este último es el más sensible pero tiene el inconveniente de necesitar un equipo de microscopía de fluorescencia. El agregado de tinta al KOH es para visualizar mejor a los hongos y la glicerina permite que los preparados puedan observarse durante más tiempo (72-96 hs), sin que se seque la preparación. El calor acelera el proceso de disolución de la queratina. Las principales causas de error del examen microscópico directo son producidas por la presencia de fibras textiles, gotas de grasa, restos de polvo y, sobre todo, por los cristales de colesterol. Estos últimos adoptan, en las preparaciones montadas en KOH sin colorantes, una morfología que simula a la de los dermatofitos, sin embargo sólo se disponen en los contornos de las células epiteliales sin penetrarlas ni atravesarlas. Otra causa de error puede ser la presencia de filamentos y esporos de hongos contaminantes atmosféricos. Cultivo: Los materiales se siembran en 2 medios de cultivos. Es conveniente utilizar medios con antibiótico para inhibir el desarrollo de la flora bacteriana y uno de los medios con cicloheximida o actidone para inhibir a los hongos contaminantes. Los medios de cultivos más frecuentemente utilizado son el agar de Sabouraud glucosado, el lactrimel de Borelli, el medio con banana-avena-leche o el medio para dermatofito DTM (dermatophyte test médium) y agar Sabouraud glucosado con antibiótico y actidione. Identificación En general, los dermatofitos pueden identificarse en base a los caracteres macromorfológicos y micromorfológicos. Entre los primeros se tienen en cuenta el aspecto, textura y color del micelio aéreo, luego se observa el reverso de la colonia y la presencia o no de pigmento difusible al medio de cultivo. El estudio de los caracteres micromorfológicos se realiza en preparaciones por disociación o mediante la técnica del microcultivo. En el primer caso, se utiliza 1 gota de azul de lactofenol u otro líquido de montar y se disocia la colonia mediante el empleo de agujas de disección. Para no destruir las estructuras fúngicas y separar los esporos de sus esporóforos se puede realizar un microcultivo, el cual es laborioso y lento, pero es la mejor técnica para observar la morfología microscópica de las distintas estructuras fúngicas. Se utiliza para la tipificación de algunos hongos filamentosos como Dermatofitos, Aspergillus spp, hongos negros y otros. Por razones de bioseguridad del personal, esta técnica no debe ser utilizada cuando se sospecha Coccidioides immitis, Histoplasma capsulatum y Blastomyces dermatitidis. El procedimiento para realizar el Microcultivo es el siguiente (Figura 1): Utilizar una placa de Petri de vidrio y cubrir el fondo con un círculo de papel de filtro o gasa. Ubicar una varilla de vidrio en forma de V sobre el papel de filtro. Colocar un portaobjetos sobre la varilla de vidrio y tapar la placa con la tapa. Esterilizar en estufa. Cortar con un sacabocados de aproximadamente 6-9 mm de diámetro, un bloque de agar Sabouraud miel (SAB) y otra de Lactrimel (LAC) de una placa de Petri. Transferir cada uno, a un extremo del portaobjeto. Del hongo en estudio, inocular con un pinche estéril cada bloque de agar, en dos lados opuestos. Colocar un cubreobjeto previamente flameado, sobre el bloque de agar inoculado. Agregar de 2 a 3 ml de agua estéril en el fondo de la placa e ir agregándole durante los días de incubación, para mantener el cultivo en una cámara húmeda. Incubar a 28°C o a temperatura ambiente por aproximadamente dos semanas (según el hongo en estudio). Sacar el cubreobjetos y dejar que se seque boca arriba, dentro de una placa de Petri estéril. Luego agregar una gota de azul de lactofenol u otro liquido de montar, en un portaobjeto y colocar el cubreobjeto del microcultivo ya seco. Observar en microscopio, primero a 100X y luego a 400X. Figura 1. Esquema del Microcultivo. Cubreobjetos Agar SAB Portaobjetos Papel de filtro húmedo Inóculo Agar LAC Si con los estudios microscópicos no se pudo identificar al hongo, se deben emplear otros procedimientos especiales tales como: 1) el test de ureasa 2) producción de órganos perforadores en pelos humanos 3) temperatura óptima de desarrollo 4) producción de pigmentos en agar papa glucosado o agar harina de maíz 5) la determinación de los requerimientos de aminoácidos o vitaminas. La identificación de un dermatofito puede necesitar 3 semanas, en tanto que el examen micológico directo puede ser informado en pocas horas o al día siguiente. Tiña del cuero cabelludo Clínicamente se reconocen la Tiña del cuero cabelludo (que incluye pelo, cejas y pestañas) y la Tiña fávica. La Tiña del cuero cabelludo predomina en áreas rurales y suburbanas. Es mas frecuente en niños de edad escolar y en el sexo masculino. Se puede transmitir de animales (especialmente de gatos y perros) o de personas enfermas. De acuerdo al tipo de dermatofito, se la denomina “Tiña microspórica” o “Tiña tricofítica”. Los agentes etiológicos de la Tiña microspórica son: M.canis, M.audounii y M.gypseum. Se caracterizan por formar una placa redonda, escamosa, de pelos cortos (de 2 a 6 mm), quebradizos, todos a una misma altura y que dan el aspecto de una tonsura de fraile. Los pelos infectados se desprenden con facilidad. En ocasiones pueden producir una inflamación con supuración de pus por los orificios foliculares, denominada “Kerion Celsi”. La alopecia es muy importante y es difícil encontrar pelos parasitados. Los agentes etiológicos mas frecuentes de la Tiña tricofítica son el T.tonsurans y T.violaceum, seguidos de T.mentagrophytes var. mentagrophytes y T.verrucosum. Forman placas escamosas pequeñas, irregulares, donde los pelos sanos se encuentran intercalados con los pelos parasitados y se rompen a nivel de la superficie cutánea, dando el aspecto de “puntos negros”. Los dermatofitos zoófilos pueden causar lesiones del tipo “Kerion Celsi” y dejar secuelas de áreas alopécicas. La fase aguda (“Kerion Celsi”) de la Tiña del cuero cabelludo se acompaña adenopatías de los ganglios periféricos. La Tiña fávica es menos contagiosa, es usualmente contraída en la niñez pero a diferencia de la Tiña del cuero cabelludo, persiste o se contagia en la edad adulta. Se observa la formación de placas costrosas, amarillentas y cóncavas que pueden cubrir casi todo el cuero cabelludo dejando solo algunos pelos en los bordes. Los pelos son frágiles, largos y de color gris opaco. Esta tiña produce una alopecia cicatrizal. También en ocasiones, puede ocasionar lesiones cutáneas o ungeales. El principal agente etiológico es el T. shoenleinii. Los pelos infectados presentan una fluorescencia de color verde cuando se los observa bajo la lámpara de Wood. Diagnóstico Micológico Toma de muestra La extracción de muestras del cuero cabelludo se efectúa arrancando pelos con la pinza de depilar, luego raspando la superficie cutánea para desprender escamas y se recogen en una placa de Petri estéril o entre dos cubreobjetos estériles. Examen microscópico Los exámenes microscópicos se llevan a cabo con objetivo primero a 100X y luego a 400X. Los pelos pueden observarse en forma “endothrix o ectothrix”. En el pelo “endothrix” se observan cadenas de artrosporos dentro del tallo piloso. Se distinguen 2 formas, una tricofítica: con una gran cantidad de esporas en el interior del pelo (T.tonsurans) y otra forma fávica: con filamentos artrosporados, escasas esporas y numerosas burbujas de aire en el interior del pelo (T.shoenleinii) El pelo “ectothrix” se ve rodeado por una vaina de artrosporas (M.canis) o aisladas sobre su superficie por cadenetas de esporas pequeñas. Estas pueden ser “ectothrix microide” que forman cadenetas de esporas pequeñas de 3 µm de diámetro (T.mentagrophytes) o “ectothrix megasporado” que forman cadenetas de esporas mas grandes de 5 µm (T.verrucosum) (Tabla V) Tabla V. Tiña cuero cabelludo. Formas de atacar el pelo ECTOTHRIX ENDOTHRIX Microspórico (M.canis) Tricofitico (T.tonsurans) Tricofitico microide (T.mentagrophytes) Favico (T.shoenleinii) Tricofitico megasporado (T.verrucosum) Cultivo Consultar Micológico sección) “Consideraciones generales de las dermatofitosis” (al para el principio Estudio de esta Tiña del cuerpo Se refiere a la dermatofitosis que involucra la piel lampiña de las extremidades, tronco, abdomen, cara y cuello. La tinea corporis es causada por E.floccosum y varias especies de Microsporum y Trichophyton. Se presenta en todas las edades, especialmente en los niños por M.canis y T.mentagrophytes var. mentagrophytes, debido al contacto con mascotas (gatos, perros, conejos) y por T.tonsurans. En adultos además de estos agentes, también se aísla T.rubrum Se caracteriza por producir una o mas lesiones redondeadas, que se extienden en forma centrífuga, con borde eritematoso o vesiculoso y escamativo. El centro de la placa tiende a curarse espontáneamente. Puede ocasionar lesiones inflamatorias especialmente con dermatofitos zoófilos (T.mentagrophytes y T.verrucosum). En pacientes inmunocomprometidos, las lesiones son muy extensas. En algunas personas, especialmente en mujeres que se depilan las piernas, puede desarrollar un “granuloma tricofítico” (también denominado granuloma de Majocchi), que se caracteriza por lesiones papulo-pustulosas con descamación ligera o franca. Los agentes etiológicos son T.rubrum y T. mentagrophytes. La Tinea imbricata es causada por el T. concentricum. Se localiza en determinadas zonas geográficas: Islas del Pacifico de Oceanía, sudeste de Asia, América Central y Brasil. Se caracteriza por presentar grandes placas escamosas y simétricas, con disposición de anillos concéntricos, que asemejan a un encaje o arabescos. Diagnóstico Micológico Consultar “Consideraciones generales para el Estudio Micológico de las dermatofitosis” (al principio de esta sección) Tiña de la ingle También se la denomina “Eczema marginado de Hebra” o “dermatofitia perigenital”. Predomina en hombres adultos. Afecta una o ambas ingles, muslos, zona suprapúbica y a veces intergluteos. Es frecuente en regiones calurosas y en personas que están mucho tiempo sentadas, porque la oclusión de la piel le genera una zona húmeda y cálida que favorece el desarrollo de esta infección. El contagio suele ser indirecto, por uso de toallas, sabanas o ropa contaminadas. Se observan placas eritematosas de bordes más rojos, a veces con microvesículas o formación de costras y el centro de la lesión va adquiriendo un color pardo con el tiempo. Los agentes etiológicos están en la Tabla IV. Diagnóstico Micológico Consultar “Consideraciones generales Micológico de las dermatofitosis” (al sección) para el principio Estudio de esta Tiña de la barba y bigote Es una micosis propia del varón adulto. Clínicamente puede presentarse de 2 formas distintas: a) con lesiones inflamatorias con supuración de pus de los orificios foliculares que a veces dejan alopecia cicatrizal y b) con lesiones escamosas, crónicas y pelos rotos a nivel de la superficie. Los agentes etiológicos están descriptos en la Tabla IV. Diagnóstico Micológico Consultar “Consideraciones generales Micológico de las dermatofitosis” (al sección) para el principio Estudio de esta Tiña de los pies y de las manos La Tinea pedis afecta espacios interdigitales, plantas y bordes de los pies. Predomina en varones adultos y es frecuente en personas que concurren al gimnasio, piscinas o practican deportes, por eso es conocida también con el nombre de “pie de atleta”. En los espacios interdigitales se observa maceración, descamación y grietas en el fondo del pliegue. En la planta y bordes laterales de los pies se pueden observar lesiones vesico-escamosas e hiperqueratosis. Las formas agudas se presentan con intenso prurito. La Tiña de las manos se localiza en la zona palmar y laterales de los dedos, es unilateral con bordes nítidos. Se puede observar placas escamosas o con vesículas e hiperqueratosis. Los agentes etiológicos están descriptos en la Tabla IV. La forma crónica se debe a T.rubrun y la aguda a T.mentagrophytes. Diagnóstico Micológico Consultar “Consideraciones generales Micológico de las dermatofitosis” (al sección) para el principio Estudio de esta Tiña de las uñas Se refiere solamente a las infecciones ungueales por dermatofitos. A diferencia del término “Onicomicosis”, que engloba al conjunto de todas las infecciones micóticas, tanto a dermatofitos como a levaduras y otros hongos filamentosos. Las uñas de los pies se infectan más frecuentemente que las uñas de las manos. Este tipo de tiña predomina en personas adultas. Las manifestaciones clínicas pueden clasificarse en: 1) subungeal distal-lateral 2) blanca superficial y blanca proximal 3) paroniquia 1) Subungeal distal-lateral: Comienza por el borde libre y/o los laterales de la uña, progresa hacia la porción mas ventral, luego invade la capa media y dorsal, produciendo una hiperqueratosis subungeal, que es la manifestación mas común. La uña se vuelve opaca y a través de la lamina externa se observan bandas o manchas de color pardo, grisáceo y/o amarillento. Con el tiempo, va tomando la apariencia de una madera apollidada y carcomida. Pude observarse desprendimiento (onicolisis) y la evolución es lenta y progresiva. Esta forma clínica es muy frecuente y el agente etiológico mas común es el T.rubrun. 2) Blanca superficial: También denominada “leuconiquia tricofitica”. Se observa con mayor frecuencia en las uñas de los pies y se caracteriza por presentar manchas blancas solitarias o múltiples, en la parte media de la lámina ungueal. Además de ser producida por T.mentagrophytes, T.rubrun y E.floccosum pueden originarlas hongos saprofitos oportunistas como Aspergillus, Fusarium, Acremonium y Scopulariopsis. Blanca proximal: Se caracteriza por la presencia de manchas blancas en la lúnula y que avanzan con el crecimiento de la uña. Generalmente son ocasionadas por T.rubrum. En pacientes con el síndrome de la inmunodeficiencia adquirida, la afección puede ser total, desarrollando una onicomicosis de color blanca, que va desmigajando la superficie de la uña. 3) Paroniquia: Es el desprendimiento de la lámina ungueal de su lecho. Es la forma más común de candidiasis cutánea. Se produce en personas cuyas ocupaciones requieren de frecuente inmersión en agua. Presentan lesiones que se caracterizan por desarrollar una inflación enrojecida y dolorosa que se extiende fuera del borde paroniquial (denominada perionixis). En la paroniquia crónica, la uña es invadida y la placa cambia de color, se vuelve parda, endurecida, con surcos o estrías. La uña no se hace friable como en las onicomicosis por dermatofitos. Es ocasionada generalmente por el género Candida, pero también por Trichosporum, Geotrichum, Fusarium y Scopulariopsis. Diagnóstico Micológico Toma de muestra Se le indica al paciente que durante los 3 días previos no es conveniente utilizar cremas, talcos ni esmalte de uñas. La mañana de la toma de la muestra, realizar un baño con agua y sal (1 cucharada sopera de sal fina para 1 litro de agua hervida y entibiada). Si la región afectada son los pies, después del baño colocarse un calzado cerrado y medias de gruesas, cuidando que los zapatos no tengan restos de talco. Antes de tomar el material, limpiar la zona con alcohol al 70%. Para la obtención de la muestra se utiliza dos portaobjetos y un bisturí esterilizados en estufa de secado o a la llama. En las onicomicosis distales subungueales debe pasarse el bisturí por el espacio subungueal, donde se acumula la hiperqueratosis; en la onicomicosis blanco superficial se raspa la tabla externa de la uña y en las leuconiquias proximales profundas debe procurarse la obtención de una muestra que abarque el mayor espesor posible de la tabla ungueal. El material extraído se lo coloca entre los dos portaobjetos estériles hasta su siembra. Examen microscópico Se realiza el examen directo con hidróxido de potasio (KOH) al 40% con tinta azul negra indeleble de Parker y glicerina 1/10. Se calienta a la llama, sin hervir. Las muestras se observaran a 100 y luego a 400X. Los dermatofitos aparecen en las uñas como hifas hialinas, ramificadas, tabicadas y a veces artrosporadas. Si la infección es por Candida, la preparación va mostrar elementos levaduriformes brotantes y seudohifas. Cultivo Los materiales se siembran en 2 medios de cultivos con antibiótico que puede ser el lactrimel de Borelli y un medio de agar Sabouraud glucosado con antibiótico y actidione para inhibir a los hongos contaminantes. No debe utilizarse solo el medio con actidione ya que este antibiótico puede inhibir el crecimiento de agentes fúngicos eventualmente patógenos como Scopulariopsis, Fusarium, Hendersonula, Trichosporon y Aspergillus. Las muestras se transfieren a la superficie de los medios con un gancho metálico estéril y se debe presionar suavemente sobre la superficie del agar. Se incuban a temperatura ambiente o en estufa de cultivo (entre 25 y 30ºC) durante 20 días. Sólo el Trichophyton verrucosum crece mejor a 37º C.